Hukum Dasar dan Perhitungan Kimia, Mol, Rumus, Contoh Soal, Pembahasan, Praktikum, Massa, Volume Molar Gas, Tetapan Avogadro - Berdasarkan hasil penelitian secara ilmiah, telah ditemukan Hukum-Hukum Dasar Kimia, menyerupai Hukum Kekekalan Massa, Hukum Perbandingan Tetap, Hukum Perbandingan Volume, dan Hukum Avogadro. Hukum-hukum tersebut menjadi pijakan bagi perkembangan ilmu Kimia. Berdasarkan hukum-hukum tersebut, massa, volume, dan jumlah partikel zat yang terlibat dalam reaksi kimia sanggup diukur dan ditentukan. Dengan demikian, kita sanggup memprediksi banyaknya zat yang akan dihasilkan atau diharapkan dalam suatu reaksi.
Bagaimanakah menunjukan hukum-hukum dasar kimia? Bagaimanakah hubungannya dengan konsep mol dalam perhitungan kimia? Anda akan mengetahui jawabannya jikalau Anda pelajari potongan ini secara saksama.
A. Hukum-Hukum Dasar Kimia
Sejak metode ilmiah diterapkan dalam ilmu Kimia, muncullah berbagai aturan yang menjadi dasar perkembangan ilmu Kimia. Beberapa hukum dasar tersebut di antaranya Hukum Kekekalan Massa, Hukum Perbandingan Tetap, Hukum Perbandingan Berganda, dan Hukum Perbandingan Volume, dan Hukum Avogadro.
1.1. Hukum Kekekalan Massa
Apakah Hukum Kekekalan Massa itu? Jika disimak dari namanya, tentu berkaitan dengan massa zat. Dalam ilmu Kimia, boleh jadi berhubungan dengan massa zat-zat yang bereaksi dalam reaksi kimia. Beberapa masa yang lalu, Lavoisier mengajukan satu masalah. Apakah massa zat-zat yang bereaksi akan berkurang, bertambah, atau tetap setelah terjadi reaksi?
Untuk memperoleh tanggapan dari problem tersebut, Anda dapat melakukan percobaan sederhana, contohnya melaksanakan reaksi antara cuka (CH3COOH) dan soda api (NaOH). Sebelum dan setelah bereaksi zat ditimbang secara saksama (sampai dua angka di belakang koma).
Contoh :
a. 2g NaOH(s) + 10g CH3COOH(aq) →12g produk
b. 4g NaOH(s) + 10g CH3COOH(aq) →14g produk
c. 8g NaOH(s) + 10g CH3COOH(aq) →18g produk Menurut pandangan Anda, bagaimanakah massa zat-zat sebelum dan sesudah reaksi? Jika disimak dari nama hukumnya, sanggup diduga bahwa massa zat-zat sebelum dan setelah bereaksi tidak berubah atau tetap. Kemukakan dengan kalimat Anda sendiri, suara Hukum Kekekalan Massa yang diajukan Lavoisier.
Data hasil pengamatan ditulis sebagai berikut.
Berat Sebelum Reaksi (g) | Berat Sesudah Reaksi (g) |
NaOH(s) = ..... | Hasil reaksi = ........ |
Cuka(aq) = .... |
Contoh Soal Hukum Kekekalan Massa dalam Reaksi Kimia :
Kawat tembaga dibakar dalam pembakar bunsen sehingga terbentuk tembaga oksida (CuO).
2Cu(s) + O2(g) → 2CuO(s)
Jika berat Cu semula 32 g dan CuO yang terbentuk 40 g, berapa berat O2 yang bereaksi?
Penyelesaian :
Menurut Hukum Kekekalan Massa, dalam reaksi kimia tidak terjadi perubahan massa. Oleh lantaran itu, berat O2 yang bereaksi ialah 40 g – 32 g = 8 g
32 g Cu(s) + 8 g O2(g) → 40 g CuO(s)
1.2. Hukum Perbandingan Tetap
Berdasarkan pola Hukum Kekekalan Massa, 32 g Cu bereaksi dengan 8 g O2 dan terbentuk 40 g CuO. Jika 50 g Cu direaksikan dengan 8 g O2, apakah CuO yang dihasilkan menjadi 58 g?
Berdasarkan hasil penelitian, terbukti jawabannya tidak karena menurut hasil penelitian, massa CuO yang dihasilkan tetap 40 g. Setelah dianalisis, suplemen logam Cu sebanyak 18 g tidak bereaksi (tetap sebagai logam Cu). Mengapa demikian?
Anda perlu bukti? Anda sanggup membuktikannya dengan melakukan percobaan, contohnya reaksi antara HCl encer dan serbuk CaCO3. HCl encer sebagai variabel tetap, sedangkan CaCO3 sebagai variabel bebas. Berdasarkan hasil pengamatan, apakah semua CaCO3 dapat bereaksi dengan HCl untuk setiap gram yang dicampurkan?
Data hasil pengamatan ditulis sebagai berikut.
Berat CaCO3 | Volume HCl | Berat CaCO3 Sisa |
1 g | 50 mL | ............... |
2 g | 50 mL | ............... |
5 g | 50 mL | ............... |
10 g | 50 mL | ............... |
Menurut Joseph Louis Proust (1754–1826): pembentukan senyawa memiliki komposisi tidak sembarang. Dengan kata lain, perbandingan massa unsur-unsur dalam senyawa selalu tetap.
Pernyataan tersebut didasarkan pada pengukuran senyawa dari hasil reaksi-reaksi kimia dan senyawa dari banyak sekali sumber. Hukum ini disebut Hukum Perbandingan Tetap atau Hukum Komposisi Tetap. Proust melaksanakan sejumlah percobaan ihwal perbandingan massa unsur-unsur dalam suatu senyawa, karenanya sebagai berikut.
a. Pada senyawa NaCl, perbandingan massa Na dan Cl selalu tetap, yaitu 39% Na dan 61% Cl atau massa Na : massa Cl = 2 : 3.
b. Pada molekul air, perbandingan massa H dan O selalu tetap, yaitu 11% H dan 89% O atau H : O = 1 : 8.
c. Pada molekul CO2, perbandingan massa C dan O selalu tetap, yaitu 27,3% C dan 72,7% O atau 3 : 8.
Contoh Soal Menentukan Komposisi Unsur dalam Senyawa :
Kawat tembaga dibakar sehingga terbentuk tembaga oksida (CuO). Perhatikan reaksi berikut.
32g Cu(s) + 8g O2(g) → 40g CuO(s)
Berapa persen massa atau perbandingan massa unsur Cu : O dalam senyawa CuO?
Kunci Jawaban :
Untuk memilih persen massa unsur-unsur dalam senyawa ialah dengan cara membandingkan massa unsur terhadap massa senyawanya.
Persen massa Cu dalam CuO = (32 g / 40 g) x 100% = 80%
Persen massa O dalam CuO = (8 g / 40 g) x 100% = 20%
Perbandingan massa unsur Cu : O ditentukan dari perbandingan persen massa unsur-unsurnya.
Massa Cu : Massa O = 80% : 20%.
Jadi, perbandingan massa unsur Cu : O = 4 : 1.
Terdapat bukti bahwa komposisi unsur-unsur dalam suatu senyawa selalu tetap dari mana pun sumbernya, baik dari materi alam maupun dari hasil sintesis di laboratorium. Bukti tersebut sanggup Anda simak pada contoh soal berikut.
Contoh Soal Berlakunya Hukum Perbandingan Tetap :
Senyawa NaCl diperoleh dari tiga sumber berbeda. Hasilnya disusun dalam tabel berikut.
Sumber | Laut | Mineral | Sintetis |
Massa NaCl | 2,00 g | 1,50 g | 1,0 g |
Massa Na | 0,78 g | 0,59 g | 0,39 g |
Massa Cl | 1,22 g | 0,91 g | 0,61 g |
Apakah senyawa NaCl pada tabel tersebut mengikuti Hukum Proust?
Kunci Jawaban :
Untuk menunjukan kebenaran Hukum Proust, sanggup dilakukan perbandingan massa setiap unsur dari ketiga sumber tersebut. Jika perbandingan massa unsur-unsur dalam ketiga sumber itu selalu tetap, berarti Hukum Proust terbukti.
Sumber laut:
Sumber mineral:
NaCl dari maritim mempunyai komposisi yang sama, demikian pula dari hasil sintesis dengan cara yang sama akan menghasilkan perbandingan massa tetap. Jadi, Hukum Perbandingan Tetap terbukti kebenarannya.
Pengetahuan komposisi unsur-unsur dalam senyawa sanggup digunakan untuk memilih berat zat yang terlibat dalam reaksi secara tepat, seperti ditunjukkan pada pola soal berikut.
Contoh Soal 4 Kebenaran Hukum Perbandingan Tetap :
Berapa gram NH3 yang terbentuk dari 14 g N2 dan 14 g H2 ? Diketahui NH3 tersusun atas 82% N dan 18% H.
Penyelesaian :
N2(g) | + | H2(g) | → | NH3(g) |
82% | 18% | 100% |
Persen massa sanggup diartikan sebagai perbandingan massa unsur-unsur yang bersenyawa sesuai Hukum Kekekalan Massa, yaitu 82 g N2 tepat bereaksi dengan 18 g H2 membentuk 100 g NH3. Jika 14 g N2 yang bereaksi maka gas H2 yang diharapkan sebanyak:
Berdasarkan persamaan reaksinya:
14g N2(g) + 3g H2(g) → 17g NH3(g)
(sesuai Hukum Kekekalan Massa)
Jadi, berat NH3 yang dihasilkan dari reaksi 14 g N2 dan 14 g H2 sama dengan 17 g. Menurut Hukum Proust, senyawa mempunyai komposisi yang tetap. Jadi, berapa pun H2 ditambahkan, yang bereaksi hanya 3 g berat dari H2. Sisanya, tetap sebagai gas H2 sebanyak 11 g tidak bereaksi.
Praktikum Kimia Hukum Perbandingan Tetap (1) :
Tujuan
Membuktikan kebenaran aturan perbandingan tetap
Langkah Kerja
1. Amati reaksi berikut ini.
Mg(s) + O2(g) →MgO(s)
2. Amati hasil analisis percobaan I, II, dan III dalam tabel berikut.
3. Dari hasil perhitungan persentase massa pada soal nomor 2, lengkapi tabel berikut ini.
Pertanyaan :
Praktikum Kimia Hukum Perbandingan Tetap (1) :
Tujuan
Membuktikan kebenaran aturan perbandingan tetap
Langkah Kerja
1. Amati reaksi berikut ini.
Mg(s) + O2(g) →MgO(s)
2. Amati hasil analisis percobaan I, II, dan III dalam tabel berikut.
Percobaan I | Percobaan II | Percobaan III | |
Massa MgO | 2,00 g | 4,00 g | 5,00 g |
Massa Mg | 1,20 g | 2,40 g | 3,00 g |
Massa O | 0,80 g | 1,60 g | 2,00 g |
3. Dari hasil perhitungan persentase massa pada soal nomor 2, lengkapi tabel berikut ini.
Berat Mg | Berat O2 | Berat MgO | Berat Sisa Mg |
24 g | 16 g | ... | ... |
28 g | 16 g | ... | ... |
36 g | 16 g | ... | ... |
50 g | 16 g | ... | ... |
Pertanyaan :
- Tunjukkan bahwa data hasil percobaan sesuai dengan Hukum Perbandingan Tetap Proust.
- Berapakah persen massa atau perbandingan massa unsur Mg dan O?
- Berapa gram massa MgO yang dihasilkan dari reaksi tersebut?
- Berapa gram sisa Mg yang tidak bereaksi?
- Apa yang sanggup Anda simpulkan dari perhitungan itu?
1.3. Hukum Perbandingan Berganda
Apa yang dimaksud dengan Hukum Perbandingan Berganda? Jika dari namanya, Anda tentu gres mengenal. Padahal, materinya sudah banyak disebutkan sebelumnya, contohnya CO dan CO2 atau NO dan NO2. Jika pembakaran karbon dilakukan pada suhu tinggi dan pasokan O2 kurang maka akan terbentuk gas CO. Jika pembakaran dilakukan pada suhu lebih rendah dan pasokan oksigen berlebih maka akan terbentuk gas CO2.
Jika disimak dari pola tersebut, Anda tentu sanggup mengira bahwa hukum ini berafiliasi dengan senyawa yang tersusun atas unsur yang sama, tetapi komposisi berbeda.
Menurut Dalton: jikalau dua macam unsur membentuk lebih dari satu senyawa maka massa salah satu unsur berbanding sebagai kelipatan bilangan bulat dan sederhana. Pernyataan ini dikenal dengan Hukum Perbandingan Berganda dari Dalton.
Contoh :
Fosfor dan klorin sanggup membentuk dua macam senyawa. Dalam senyawa X : 2 g fosfor tepat bereaksi dengan 6,9 g klorin. Dalam senyawa Y : 2 g fosfor tepat bereaksi dengan 11,5 g oksigen. Bagaimana rumus kedua senyawa ini?
Perbandingan massa unsur klorin dalam kedua senyawa (untuk berat fosfor yang sama) ialah 6,9 : 11,5 = 3 : 5. Dengan demikian, rumus senyawa X dan Y adalah PCl3 dan PCl5 dengan bentuk struktur seperti Gambar 1.
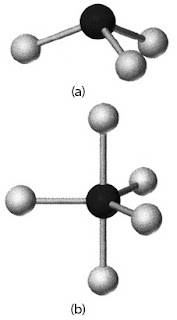 |
| Gambar 1. (a) Struktur molekul PCl3 (b) Struktur molekul PCl5 |
Contoh Soal Hukum Perbandingan Berganda Berdasarkan Massa :
Unsur nitrogen dan oksigen sanggup membentuk lebih dari satu senyawa, contohnya NO, NO2, N2O3, dan N2O4. Pada kondisi tertentu, 1 g nitrogen tepat bereaksi dengan 1,14 g oksigen. Pada kondisi yang lain, 1 g nitrogen tepat bereaksi dengan 2,28 g oksigen.
Jelaskan bahwa data ini sesuai dengan Hukum Perbandingan Berganda. Bagaimana rumus kimia kedua senyawa itu?
Kunci Jawaban :
Untuk berat nitrogen yang sama (1 g), perbandingan massa oksigen untuk kedua senyawa itu ialah 1,14 : 2,28 atau 1 : 2. Oleh lantaran perbandingan unsur oksigen pada kedua senyawa itu berupa bilangan bulat dan sederhana maka data ini sesuai Hukum Perbandingan Berganda. Rumus kimia kedua senyawa itu ialah NO dan NO2.
Contoh Soal Hukum Perbandingan Berganda Berdasarkan Persen Massa :
Unsur hidrogen dan oksigen sanggup membentuk air dan suatu peroksida. Persen massa unsur-unsur dalam air ialah 11,1% berat H dan 88,9% berat O. Persen massa dalam peroksida ialah 5,93% berat H dan 94,07% berat O.
Jelaskan bahwa data ini sesuai Hukum Perbandingan Berganda dan tentukan rumus peroksidanya.
Kunci Jawaban :
Berdasarkan persen berat, sanggup diartikan bahwa dalam air terkandung 11,1 g H dan 88,9 g O. Jika berat H = 1 g maka berat O dalam air adalah 1 g H :
 × 88,9 = 8 g
× 88,9 = 8 g
Dalam peroksida terkandung 5,93 g H dan 94,07 g O.
Jika berat H = 1g, maka berat O dalam peroksida ialah :
Untuk berat H yang sama, perbandingan massa O dalam air dan peroksida adalah 8 : 16 = 1 : 2.
Dengan demikian, data ini sesuai Hukum Perbandingan Berganda. Oleh lantaran molekul air H2O maka rumus molekul peroksida adalah H2O2.
1.4. Hukum Perbandingan Volume
Hukum-hukum perbandingan yang telah Anda pelajari hanya mengkaji komposisi senyawa, sedangkan Hukum Perbandingan Volume berhubungan dengan reaksi-reaksi kimia yang melibatkan wujud gas. Bagaimana perbandingan volume gas-gas yang bereaksi dan adakah hubungan antara volume gas-gas yang bereaksi dan koefisien reaksinya?
Untuk menjawab problem ini, Anda sanggup melaksanakan percobaan menggunakan tabung eudiometer. Misalnya, masukkan gas H2 dan gas O2 dengan volume terukur ke dalam eudiometer. Kemudian, hubungkan alat itu dengan arus listrik dan tekan tombol pembangkit bunga api listrik (piezo electric). Piezo electric ialah alat pembangkit bunga api listrik, menyerupai pada bensin dan kompor gas.
Percobaan dilakukan berulangkali pada kondisi tetap. Setiap kali percobaan, volume H2 dijadikan variabel tetap, sedangkan volume O2 dijadikan variabel bebas. Kemudian, dilakukan sebaliknya, volume O2 dijadikan variabel tetap dan volume H2 variabel bebas.
Joseph Louis Gay-Lussac (Kimiawan Prancis), dua masa yang lalu melakukan percobaan menyerupai itu. Pada percobaan I, volume H2 dibuat tetap, sedangkan volume O2 bervariasi dan sebaliknya. Hasilnya ditabulasikan ke dalam Tabel 1.
Tabel 1. Data Hasil Pengamatan Volume H2 Tetap
V H2 | V O2 | V H2O |
20 mL | 5 mL | 10 mL |
20 mL | 10 mL | 20 mL |
20 mL | 15 mL | 20 mL |
20 mL | 20 mL | 20 mL |
Volume O2 tetap :
V H2 | V O2 | V H2O |
10 mL | 10 mL | 10 mL |
15 mL | 10 mL | 15 mL |
20 mL | 10 mL | 20 mL |
25 mL | 20 mL | 20 mL |
Pada dikala volume O2 10 mL, volume H2O tidak berubah, yaitu 20 mL. Demikian pula pada percobaan II, volume H2O tidak berubah lagi (20 mL) setelah volume H2 mencapai 20 mL (volume O2 = 10 mL). Jadi, perbandingan volume dari reaksi H2 dan O2 adalah sebagai berikut.
20 mL gas H2 + 10 mL gas O2 → 20 mL H2O
Sejalan dengan percobaan tersebut, reaksi gas-gas lain juga diukur perbandingan volumenya, menyerupai ditunjukkan pada Tabel 2.
Tabel 2. Perbandingan Volume Gas-Gas dalam Reaksi
Persamaan Reaksi | Perbandingan Volume |
H2(g) + Cl2(g) → 2HCl(g) | 10 mL : 10 mL : 20 mL |
3H2(g) + N2(g) → 2NH3(g) | 15 mL : 5 mL : 10 mL |
N2(g) + 2O2(g) → 2NO2(g) | 10 mL : 20 mL : 20 mL |
Berdasarkan data perbandingan volume gas-gas yang bereaksi, Gay-Lussac menyimpulkan sebagai berikut.
Pada suhu dan tekanan tetap, volume gas-gas yang bereaksi dan volume gas-gas hasil reaksi berbanding lurus dengan koefisien reaksinya sebagai bilangan bulat dan sederhana. Pernyataan ini disebut Hukum Perbandingan Volume.
Contoh Soal Hukum Perbandingan Volume :
Ke dalam tabung eudiometer dimasukkan gas O2 dan gas SO2, kemudian dilewatkan bunga api listrik. Pada suhu 25 °C dan tekanan 1 atm, volume gas-gas yang bereaksi diukur. Hasilnya ditunjukkan pada tabel berikut.
Pada volume O2 tetap:
Percobaan | Volume O2 | Volume SO2 | Volume SO3 |
1. | 10 mL | 10 mL | 10 mL |
2. | 10 mL | 15 mL | 15 mL |
3. | 10 mL | 20 mL | 20 mL |
4. | 10 mL | 25 mL | 20 mL |
Pada volume SO2 tetap:
Percobaan | Volume O2 | Volume SO2 | Volume SO3 |
1. | 5 mL | 20 mL | 10 mL |
2. | 10 mL | 20 mL | 20 mL |
3. | 15 mL | 20 mL | 20 mL |
4. | 20 mL | 20 mL | 20 mL |
Bagaimana perbandingan volume SO2 : O2 : SO3 ? Apakah sesuai dengan Hukum Perbandingan Volume? Tuliskan persamaan reaksinya beserta koefisien reaksi berdasarkan hasil percobaan.
Kunci Jawaban :
Pada volume O2 tetap
Simak percobaan 3, volume SO3 tidak berubah lagi dikala volume SO2 mencapai 20 mL.
Pada volume SO2 tetap
Simak percobaan 2, volume SO3 tidak berubah lagi dikala volume O2 mencapai 10 mL.
Perbandingan volume SO2 : O2 : SO3 adalah :
SO2 + O2 → SO3
20 mL : 10 mL : 20 mL
Dengan demikian, data tersebut sesuai dengan Hukum Gay-Lussac.
Persamaan reaksi yang terjadi ialah :
2SO2(g) + O2(g) → 2SO3(g)
Contoh Soal Ebtanas 1992 :
Pada reaksi pembakaran etuna berdasarkan reaksi:
C2H2 (g) + O2 (g) → CO2(g) + H2O (g)
Perbandingan volume gas-gas yang bereaksi ialah ....
A. 2 : 5 : 4 : 2
B. 2 : 5 : 3 : 3
C. 1 : 3 : 2 : 2
D. 1 : 1 : 2 : 1
E. 1 : 1 : 1 : 1
Pembahasan :
Pada suhu dan tekanan, tetapi perbandingan gas-gas yang bereaksi dan hasil reaksi berbanding lurus dengan koefisien reaksinya.
2C2H2 (g) + 5O2 (g) → 4CO2(g) + 2H2O (g)
Jadi, perbandingan volumenya : 2 : 5 : 4 : 2 (A)
1.5. Hukum Avogadro
Pada reaksi pembakaran etuna berdasarkan reaksi:
C2H2 (g) + O2 (g) → CO2(g) + H2O (g)
Perbandingan volume gas-gas yang bereaksi ialah ....
A. 2 : 5 : 4 : 2
B. 2 : 5 : 3 : 3
C. 1 : 3 : 2 : 2
D. 1 : 1 : 2 : 1
E. 1 : 1 : 1 : 1
Pembahasan :
Pada suhu dan tekanan, tetapi perbandingan gas-gas yang bereaksi dan hasil reaksi berbanding lurus dengan koefisien reaksinya.
2C2H2 (g) + 5O2 (g) → 4CO2(g) + 2H2O (g)
Jadi, perbandingan volumenya : 2 : 5 : 4 : 2 (A)
1.5. Hukum Avogadro
Setelah aturan perbandingan volume dipublikasikan dalam jurnal-jurnal internasional, pakar kimia Italia, Amadeo Avogadro, berteori dengan aturan tersebut. Dia mengajukan hipotesis sebagai berikut.
Pada suhu dan tekanan sama, gas-gas yang volumenya sama mengandung jumlah molekul yang sama.
Makna hipotesis itu sanggup diartikan bahwa pada suhu dan tekanan yang sama, perbandingan volume gas-gas yang bereaksi menunjukkan perbandingan molekul-molekulnya. Sebagai gambaran, tinjau reaksi antara gas N2 dan gas O2 menghasilkan gas NO2.
1 volume N2 + 2 volume O2 →2 volume NO2
1 molekul N2 + 2 molekul O2 →2 molekul NO2
n molekul N2 + 2n molekul O2 →2n molekul NO2
Jika reaksi diukur pada suhu dan tekanan yang sama, jumlah molekul O2 yang bereaksi dua kali jumlah molekul N2 (volumenya 2×) dan jumlah molekul NO2 yang dihasilkan dua kali jumlah molekul N2 atau sama dengan jumlah molekul O2 . Oleh lantaran hipotesis Avogadro sanggup diterima kebenarannya dan sanggup dibuktikan (kapan pun, di mana pun, oleh siapa pun) maka hipotesis tersebut telah dikukuhkan sebagai Hukum Avogadro. Pada pembakaran metana juga berlaku Hukum Avogadro, menyerupai ditunjukkan pada Gambar 2.
 |
| Gambar 2. Reaksi pembakaran metana dengan perbandingan volume tetap |
Sekilas Kimia
Amadeo Avogadro
(1776–1856)
Avogadro menunjukkan bahwa dalam volume yang sama dari dua gas tertentu selalu terdapat jumlah molekul yang sama jikalau gas itu memiliki temperatur dan tekanan yang sama. Sebelum teori Avogadro lahir, ada paradigma bahwa zat-zat yang bereaksi berupa atom-atom (bukan molekul). Jika paradigma itu benar, NO2 dibentuk dari 1 atom O dan ½ atom N. Hal ini tidak sesuai dengan model atom (tidak mungkin atom pecahan).
Contoh Soal Penerapan Hipotesis Avogadro :
Pada suhu dan tekanan tertentu, gas N2 direaksikan dengan gas H2 menjadi gas NH3. Jika gas H2 yang bereaksi sebanyak 7,5 × 1023 molekul, berapakah jumlah molekul NH3 yang terbentuk?
Kunci Jawaban :
Pada suhu dan tekanan sama, gas-gas yang volumenya sama mengandung jumlah molekul yang sama (Avogadro). Koefisien reaksi menyatakan perbandingan volume gas-gas yang bereaksi (Gay-Lussac).
N2(g) | + | H2(g) | → | NH3(g) |
3 v | : | 1 v | : | 2 v |
7,5 × 1023 | ? |
Dalam 3 volume H2 terkandung 7,5 × 1023 molekul maka dalam 2 volume NH3 terkandung :
Jumlah molekul NH3 = 5,0 × 1023 molekul
B. Konsep Mol dan Tetapan Avogadro
Munculnya Hukum Avogadro besar lengan berkuasa sangat signifikan terhadap perkembangan ilmu Kimia, khususnya dalam pengukuran zat-zat di laboratorium. Pengukuran berat suatu zat pada umumnya menggunakan satuan gram, sedangkan massa atom dan molekul dinyatakan dalam satuan Ar dan Mr. Bagaimana kekerabatan Ar atau Mr dengan berat suatu zat dalam satuan gram?
2.1. Tetapan Avogadro (L)
Sumbangan Avogadro tidak berhenti hingga kekerabatan jumlah partikel (molekul, atom, ion) dan volume gas, tetapi merambah lebih jauh kepada kekerabatan jumlah partikel dan massa zat. Sebagai gambaran hubungan jumlah partikel dan massa suatu zat, mari kita tinjau partikel yang diemisikan oleh unsur radioaktif berikut ini.
Berdasarkan hasil pengukuran, diketahui bahwa satu gram radium dapat mengemisikan partikel alfa sebanyak 11,6 × 1017 partikel. Partikel alfa sebanyak 11,6 × 1017 setara dengan helium sebanyak 7,7 × 10-6 g.
Radium | → | Partikel alfa (α ) | ≈ | Atom helium |
(1 g) | : | (11,6 × 1017 partikel) | : | (7,7 × 10-6 g) |
Oleh lantaran partikel alfa ialah inti atom helium maka jumlah atom helium dalam satu gram adalah
Jadi, dalam 1g helium terkandung 1,507 × 1023 atom helium. Ini menyatakan kekerabatan massa (g) dan jumlah partikel (atom). Berdasarkan hasil perhitungan, selalu muncul bilangan sebesar 6,02 × 1023 untuk jumlah molekul yang massanya sebesar nilai massa atom relatif untuk unsur atau sebesar massa molekul relatif unsur senyawa.
Contoh Soal Hubungan Jumlah Partikel dan Massa Zat :
Pada P dan T tertentu, 1 g metana mengandung 3,75 × 1022 molekul CH4 . Berapa jumlah molekul gas CH4 dalam 16 g?
Kunci Jawaban :
Dalam 1 g CH4 terkandung 3,75 × 1022 molekul CH4.
Dalam 16 g CH4 terkandung :
Jadi, dalam 16 g metana terkandung 6,0 × 1023 molekul CH
Contoh:
Dalam 18 g air (Mr H2O = 18) terkandung 6,02 × 1023 molekul H2O.
Dalam 23 g natrium (Ar Na = 23) terkandung 6,02 × 1023 atom Na.
Dalam 58,5 g natrium klorida (Mr NaCl = 58,5) terkandung 6,02 × 1023 satuan rumus NaCl.
Oleh lantaran itu, bilangan sebesar 6,02 × 1023 dinyatakan sebagai tetapan Avogaro yang disingkat L.
L = 6,02 × 1023 partikel
Contoh Soal Ebtanas 1998 :
Sejumlah x molekul gas propana dibakar habis dengan O2 menurut persamaan:
C3H8 (g) + 5O2 (g) → 3CO2 (g) + 4H2O (g)
Pada P dan T yang sama, jumlah molekul gas CO2 yang dihasilkan ....
A. x molekul
B. 3x molekul
C. 4x molekul
D. 5x molekul
E. 6x molekul
Pembahasan :
Pada P dan T yang sama, persamaan reaksi menyatakan jumlah atom atau molekul yang terlibat dalam reaksi. Makara persamaan reaksinya yaitu:
1 molekul C3H8 (g) + 5 molekul O2 (g) → 3 molekul CO2 (g) + 4 molekul H2O (g)
1 molekul C3H8 (g) = x molekul
berarti, CO2 = 3x molekul. (B)
Contoh Soal Ebtanas 1998 :
Sejumlah x molekul gas propana dibakar habis dengan O2 menurut persamaan:
C3H8 (g) + 5O2 (g) → 3CO2 (g) + 4H2O (g)
Pada P dan T yang sama, jumlah molekul gas CO2 yang dihasilkan ....
A. x molekul
B. 3x molekul
C. 4x molekul
D. 5x molekul
E. 6x molekul
Pembahasan :
Pada P dan T yang sama, persamaan reaksi menyatakan jumlah atom atau molekul yang terlibat dalam reaksi. Makara persamaan reaksinya yaitu:
1 molekul C3H8 (g) + 5 molekul O2 (g) → 3 molekul CO2 (g) + 4 molekul H2O (g)
1 molekul C3H8 (g) = x molekul
berarti, CO2 = 3x molekul. (B)
2.2. Pengertian Mol
Berdasarkan perhitungan, dalam 56 g besi terkandung 6,02 × 1023 atom besi, dalam satu mililiter air terkandung 3,345 × 1022 molekul air.
Angka-angka sebesar ini tidak efisien jikalau digunakan untuk perhitungan zat-zat di laboratorium.
Agar lebih sederhana, para ilmuwan menetapkan suatu satuan jumlah zat yang menyatakan banyaknya partikel zat itu. Satuan ini dinamakan mol. Berdasarkan kesepakatan, untuk partikel yang jumlahnya sebesar tetapan Avogadro atau 6,02 × 1023 dinyatakan sebesar satu mol. Dengan kata lain, satu mol setiap zat mengandung 6,02 × 1023 partikel zat, baik atom, molekul, maupun ion.
Contoh :
Dalam satu mol besi terkandung 6,02 × 1023 atom Fe.
Dalam satu mol air terkandung 6,02 × 1023 molekul H2O.
Dalam satu mol natrium klorida terkandung 6,02 × 1023 ion Na+ dan 6,02 × 1023 ion Cl–.
Contoh Soal Hubungan Mol dan Jumlah Partikel :
a. Berapa jumlah atom karbon yang terkandung dalam 0,05 mol karbon?
b. Berapa mol gas O2 yang mengandung 1,5 × 1023 molekul O2?
Kunci Jawaban :
a. Dalam 1 mol karbon terkandung 6,02 × 1023 atom karbon.
Dalam 0,05 mol karbon akan mengandung atom karbon sebanyak:
b. Molekul O2 sebanyak 6,02 × 1023 adalah 1 mol.
Jumlah mol untuk 1,5 × 1023 molekul O2 adalah
C. Massa Molar dan Volume Molar Gas
Bagaimana kekerabatan antara Ar atau Mr dan massa zat biar kita dapat memilih jumlah zat-zat yang bereaksi dan meramalkan jumlah hasil reaksinya? Untuk sanggup menjawab hal tersebut, Anda harus memahami massa molar dan volume molar.
3.1. Massa Molar
Berdasarkan hasil perhitungan, diketahui bahwa dalam 18 g air terkandung 6,02 × 1023 molekul H2O. dalam 23 g natrium terkandung 6,02 × 1023 atom Na, dan dalam 58,5 g natrium klorida terkandung 6,02 × 1023 satuan rumus NaCl.
Pada potongan sebelumnya, Anda sudah sanggup memilih Mr H2O = 18; Ar Na = 23; dan Mr NaCl = 58,5. Berdasarkan informasi tersebut, terlihat adanya kekerabatan yang teratur antara massa zat (g), Ar atau Mr, dan jumlah partikel (L). Hubungan tersebut dinyatakan dalam bentuk tabel berikut.
Tabel 3. Hubungan Massa (Ar/Mr), Jumlah partikel, dan Mol Beberapa Zat
Zat | Massa (g) | A r/Mr | Jumlah Partikel | Mol |
H2O | 18 | 18 | 6,02 × 1023 molekul H2O | 1 |
Na | 23 | 23 | 6,02 × 1023 atom Na | 1 |
NaCl | 58,5 | 58,5 | 6,02 × 1023 satuan NaCl | 1 |
Berdasarkan kekerabatan pada tabel tesebut, diketahui bahwa massa zat yang besarnya sama dengan nilai Ar atau Mr mengandung jumlah partikel sebanyak 6,02 × 1023 atau sebesar satu mol. Dengan demikian, disimpulkan bahwa massa satu mol zat sama dengan nilai Ar (untuk atom) atau Mr (untuk senyawa). Massa satu mol zat disebut massa molar (Mm) dengan satuan gram per mol (g mol–1).
 |
| Gambar 3. Hubungan besaran kimia. |
Contoh Soal Penerapan Massa Molar :
- Besi beratnya 25 g. Berapa mol besi tersebut ? Diketahui Ar Fe = 56 g mol–1.
- Jumlah mol grafit dalam suatu baterai ialah 1,5 mol. Berapa berat grafit tersebut ? Diketahui Ar C = 12 g mol–1.
- Berapa berat 1 atom besi ? Diketahui Ar Fe = 56 sma.
- Berapa jumlah molekul CO2 yang terdapat dalam 4 g CO2 ? Diketahui Mr CO2 = 44 sma.
Kunci Jawaban :
1. Massa molar besi: Mm Fe = 56 g mol–1
Jumlah mol besi =  = 0,446 mol.
= 0,446 mol.
Massa 1,5 mol C = 1,5 mol x 12 g mol–1 = 18 g.
3. Ar Fe = 56 sma, Jadi, massa molar Fe = 56 g mol–1.
Massa 1 atom Fe ialah :
Jadi, berat 1 atom Fe = 9,3 × 1023 g.
4. Massa molar CO2 = 44 g mol–1
Jumlah mol CO2 =  = 0,09 mol
= 0,09 mol
3.2. Volume Molar Gas
Menurut Amedeo Avogadro: pada suhu dan tekanan tertentu, setiap gas yang volumenya sama mengandung jumlah molekul yang sama. Artinya, gas apapun selama volumenya sama dan diukur pada P dan T yang sama akan mengandung jumlah molekul yang sama. Jika jumlah molekul gas sebanyak tetapan Avogadro (L= 6,02 × 1023 molekul) maka dapat dikatakan jumlah gas tersebut ialah satu mol.
Berdasarkan perhitungan yang mengacu pada Hukum Avogadro, pada 0 °C dan 1 atm (STP, Standard Temperature and Pressure), volume satu mol gas ialah 22,4 liter. Volume satu mol gas ini dikenal dengan volume molar gas, disingkat Vm.
Tabel 4. Volume Molar Gas Beberapa Zat pada Keadaan STP
Zat | Massa (g) | Mol | Volume | Jumlah Molekul |
NO2 | 46 | 1 | 22,4 | 6,02 × 1023 |
NH3 | 17 | 1 | 22,4 | 6,02 × 1023 |
CO | 28 | 1 | 22,4 | 6,02 × 1023 |
CO | 17 | 1 | 22,4 | 6,02 × 1023 |
Sekilas Kimia
Hukum Boyle: Hubungan Tekanan dan Volume
Robert Boyle (1627–1691) adalah seorang kimiawan Inggris. Pada masa ke-17, Boyle mempelajari sifat gas-gas secara sistematis dan kuantitatif. Boyle menyelidiki hubungan antara tekanan dan volume suatu sampel gas dengan menggunakan peralatan seperti yang ditunjukkan pada gambar. Mula-mula dilakukan penekanan pada gas dengan menambahkan merkuri (Hg) pada tabung, yang tekanannya sama dengan tekanan atmosfer. Peningkatan tekanan ditunjukkan oleh merkuri dengan level berbeda pada dua kolom. Ketika percobaan, temperatur gas dijaga konstan.
Dari percobaan Boyle tersebut, diketahui bahwa volume gas (V) berbanding terbalik dengan tekanan (P) pada suhu tetap (T konstan).
V ∝ 1/P
(Sumber: Chemistry, 1994)
Dari percobaan Boyle tersebut, diketahui bahwa volume gas (V) berbanding terbalik dengan tekanan (P) pada suhu tetap (T konstan).
V ∝ 1/P
(Sumber: Chemistry, 1994)
Contoh Soal Penerapan Volume Molar Gas :
a. Berapa volume 16 g gas O2 yang diukur pada keadaan STP ? Diketahui Mr O2 = 32.
b. Berapa jumlah molekul N2 yang terdapat dalam 5,6 L gas N2 diukur pada keadaan STP ?
Penyelesaian :
Massa molar O2 = 32 g mol–1
Jumlah mol O2 = = 0,5 mol
Pada STP, volume molar O2 = 22,4 L mol–1,
maka volume 0,5 mol O2 = 0,5 mol × 22,4 L mol–1 = 11,2 L
Jadi, volume untuk 16g O2 pada STP = 11,2 L
b. Pada STP, volume molar N2 = 22,4 L mol–1
Jumlah mol N2 dalam 5,6 L = = 0,25 mol.
Jumlah molekul N2 dalam satu mol = 6,02 × 1023.
Jumlah molekul N2 dalam 0,25 mol = 0,25 mol × 6,02 × 1023 molekul/mol = 1,505 × 1023 molekul.
Jadi, jumlah N2 dalam 5,6 L = 1,505 × 1023 molekul
Penyelesaian :
Massa molar O2 = 32 g mol–1
Jumlah mol O2 = = 0,5 mol
Pada STP, volume molar O2 = 22,4 L mol–1,
maka volume 0,5 mol O2 = 0,5 mol × 22,4 L mol–1 = 11,2 L
Jadi, volume untuk 16g O2 pada STP = 11,2 L
b. Pada STP, volume molar N2 = 22,4 L mol–1
Jumlah mol N2 dalam 5,6 L = = 0,25 mol.
Jumlah molekul N2 dalam satu mol = 6,02 × 1023.
Jumlah molekul N2 dalam 0,25 mol = 0,25 mol × 6,02 × 1023 molekul/mol = 1,505 × 1023 molekul.
Jadi, jumlah N2 dalam 5,6 L = 1,505 × 1023 molekul
3.3. Volume Molar Gas Non STP
Bagaimana memilih volume suatu gas pada keadaan tidak standar? Untuk memilih volume gas pada suhu dan tekanan tertentu dapat dihitung memakai persamaan gas ideal. Persamaan gas ideal ialah suatu persamaan yang diturunkan berdasarkan perkiraan para pakar kimia dengan mengacu pada hasil-hasil percobaan menyerupai Charles, Amonton, Boyle, dan Gay-Lussac.
Hukum Charles menyatakan bahwa: pada tekanan tetap, volume gas berbanding lurus dengan suhu mutlaknya. Secara matematis dirumuskan sebagai:
V ≈ T
Hukum Amonton menyatakan bahwa: pada volume tetap, tekanan gas berbanding lurus dengan suhu mutlaknya. Secara matematis dirumuskan sebagai:
P ≈ T
Boyle dan Gay-Lussac menggabungkan ketiga besaran gas (tekanan, suhu, dan volume) menghasilkan persamaan berikut:
PV ≈ T
Menurut Avogadro, persamaan tersebut sanggup ditulis sebagai:
PV = RT
R ialah tetapan molar gas yang tidak bergantung pada P, T, dan V, tetapi hanya bergantung pada jumlah mol gas. Menurut percobaan, nilai
R = 0,082 L atm mol–1 K–1.
Berdasarkan uraian tersebut, persamaan gas ideal sanggup ditulis sebagai berikut.
Keterangan:
P = Tekanan (atm)
V = Volume (L)
T = Suhu mutlak (K)
n = Jumlah partikel (mol)
R = Tetapan gas (L atm mol–1 K–1) = 0,082 L atm mol–1 K–1.
Contoh Soal Penerapan Pesamaan Gas Ideal :
Berapa volume gas H2 yang terdapat dalam balon pada 27 °C jikalau tekanan H2 2 atm dan beratnya 0,5 g? Diketahui: R = 0,082 L atm mol–1 K–1..
Kunci Jawaban :
Untuk memilih volume H2, pertama menghitung jumlah molnya, kemudian menghitung volume gas H2 melalui persamaan untuk gas ideal PV = nRT.
Jumlah mol H2 =  = 0,25 mol.
= 0,25 mol.
Volume H2 pada 27 °C dan 1 atm :
PV = nRT
D. Perhitungan Kimia
Setelah Anda mengetahui kekerabatan antara besaran-besaran kimia seperti massa, mol, jumlah partikel, dan Ar atau Mr maka Anda dapat menerapkannya dalam perhitungan kimia. Misalnya, berapa volume gas CO2 yang dihasilkan dari pembakaran 2 liter bensin atau berapa gram aluminium yang harus direaksikan dengan HCl biar dihasikan 5 liter gas H2? Semua ini sanggup Anda lakukan sekarang.
Stoikiometri Reaksi
Kita kembali ke topik persamaan reaksi. Anda sudah mengetahui bahwa persamaan reaksi menyatakan jumlah atom atau molekul yang terlibat dalam reaksi (Hukum Avogadro). Banyaknya zat yang terlibat dalam reaksi kimia ditunjukkan oleh koefisien reaksinya.
Contoh :
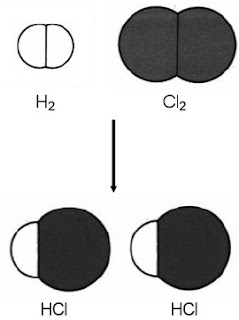 |
| Gambar 4. Reaksi antara gas klorin dan gas hidrogen. |
Reaksi antara gas hidrogen dan gas klorin membentuk hidrogen klorida (Gambar 4) diungkapkan dalam persamaan reaksi berikut.
H2(g) + Cl2(g) → 2HCl(g)
Persamaan reaksi ini bermakna bahwa:
1 molekul H2 + 1 molekul Cl2 → 2 molekul HCl
atau
n molekul H2 + n molekul Cl2 → 2n molekul HCl
Jika nilai n dari persamaan reaksi tersebut sama dengan 6,02 × 1023 atau sebesar tetapan Avogadro maka n molekul sama dengan satu mol. Dengan demikian, persamaan reaksi tersebut menyatakan perbandingan mol.
2 mol C + 1 mol O2 → 2 mol CO
Dapat disimpulkan bahwa koefisien reaksi pada persamaan kimia menunjukkan perbandingan jumlah mol zat-zat yang bereaksi dan zat-zat hasil reaksi. Perbandingan koefisien reaksi ini dinamakan rasio stoikiometri yang disingkat RS.
Sebagai citra aplikasi konsep mol dalam reaksi kimia dapat disimak pola reaksi berikut:
Contoh:
Berapa mol H2O yang dihasilkan jikalau 2 mol O2 direaksikan dengan gas H2 berlebih? Pernyataan "berlebih" mengisyaratkan bahwa jumlah H2 lebih melimpah dari yang diharapkan untuk bereaksi secara tepat dengan 2 mol O2. Oleh lantaran itu, jumlah H2O yang dihasilkan bergantung pada jumlah O2.
2H2(g) + O2(g) → 2H2O(l)
Berdasarkan persamaan reaksi, 2 mol H2 bereaksi dengan 1 mol O2 menghasilkan 2 mol H2O . Jika O2 yang bereaksi sebanyak 2 mol maka jumlah mol H2O dapat ditentukan dari rasio stoikiometri (RS H2O/O2).
Contoh Soal Terapan Mol dalam Reaksi Pembakaran :
Tentukan berat air yang dihasilkan jikalau 0,25 mol gas butana dibakar dalam oksigen berlebih.
Kunci Jawaban :
Persamaan kimia yang terjadi:
2C4H10(g) + 13O2(g) → 8CO2(g) + 10H2O(g)
Dalam persamaan tersebut, 10 mol H2O dihasilkan dari 2 mol C4H10 atau RS (H2O : C4H10) = 10 : 2
Jumlah mol air yang dihasilkan = RS × mol butana
Jumlah mol air yang dihasilkan = RS × mol butana
Jumlah mol air yang dihasilkan =  × 0,25 mol C4H10 = 1,25 mol H2O
× 0,25 mol C4H10 = 1,25 mol H2O
Massa molar H2O = 18 g mol–1
Berat H2O = 1,25 mol × 18 g mol–1 = 22,5 g
Contoh Soal Terapan Mol dalam Proses Fotosintesis :
Berapa jumlah molekul CO2 yang diharapkan untuk membentuk 90 g glukosa pada proses fotosintesis dengan santunan energi matahari?
Penyelesaian :
Pertama, tentukan dulu jumlah mol glukosa untuk mengetahui mol CO2 melalui RS (glukosa : CO2).
Kedua, tentukan jumlah molekul CO2 melalui tetapan Avogadro.
Persamaan reaksi yang terjadi :
energi | ||||||
6CO2(g) | + | 6H2O(l) | → | C6H12O6(s) | + | 12O2(g) |
Jumlah mol glukosa yang terbentuk adalah
Jumlah mol karbondioksida yang diharapkan = RS x mol glukosa :
Jumlah molekul CO2 yang diharapkan :
3 mol CO2 × 6,02 × 1023 molekul mol–1 = 18,06 × 1023.
Jadi, CO2 yang diharapkan ialah 18,06 × 1023 molekul = 1,806 x 1024.
Sekilas Kimia
CO2 dan Efek Rumah Kaca
Dari pembakaran 1,00 g C4H10 menghasilkan 3,03 g CO2. Satu galon (3,78 L) gasolin (C8H18) menghasilkan 8 kg CO2. Pembakaran materi bakar tersebut melepaskan sekitar 20 milyar ton CO2 ke atmosfer setiap tahunnya. Meskipun CO2 merupakan komponen kecil di atmosfer, CO2 berperanan penting dalam menyerap radiasi panas, bertindak seolah-olah seperti rumah kaca. Oleh lantaran itu, kita sering menyebutkan CO2 dan gas penangkap panas lainnya sebagai gas rumah kaca. Panas yang disebabkan oleh gas ini dinamakan pengaruh rumah kaca. (Sumber: Chemistry The Central Science, 2000.)
Catatan :
Koefisien reaksi dalam persamaan reaksi menyatakan perbandingan :
• Jumlah partikel (atom, molekul, ion).
• Jumlah mol.
Dalam stoikiometri reaksi, apapun jenis informasi yang diketahui dan jenis informasi yang ditanyakan sanggup diselesaikan dengan menggunakan empat langkah berikut.
- Tuliskan persamaan reaksi kimia setara.
- Ubah besaran yang diketahui ke dalam satuan mol.
- Gunakan rasio stoikiometri (RS) dari persamaan kimia setara untuk menentukan besaran yang ditanyakan dalam satuan mol.
- Ubah satuan mol ke dalam besaran yang ditanyakan, contohnya dalam satuan gram atau jumlah partikel.
Secara diagram, keempat langkah tersebut sanggup dilihat pada gambar berikut, contohnya untuk reaksi : A →B
 |
| Gambar 5. Diagram langkah penyelesaian stoikiometri reaksi. |
Oktana (C8H18) dibakar dalam mesin mobil. Berapa volume CO2 yang dihasilkan pada pembakaran tepat 2 liter oktana? Semua diukur pada STP.
Pembahasan :
Tahap 1: Persamaan reaksi kimia setara:
2C8H18(g) + 25O2(g) → 16CO2(g) + 18H2O(g)
Tahap 2: Ubah satuan volume oktana menjadi mol memakai volume molar.
Tahap 3: Tentukan jumlah mol oksigen memakai RS (CO2 : C8H18)
Mol O2 =  x 0,09 mol C8H18 = 0,72 mol
x 0,09 mol C8H18 = 0,72 mol
Tahap 4: Ubah mol O2 ke dalam satuan volume melalui volume molar.
Volume O2 = 0,72 mol × 22,4 L mol–1 = 16,128 L
Jadi, volume CO2 yang dihasilkan dari pembakaran 2 liter oktana adalah 16,128 liter.
Rangkuman :
- Dalam reaksi kimia, massa zat sebelum dan sesudah reaksi selalu tetap (Hukum Kekekalan Massa)
- Perbandingan massa unsur-unsur yang membentuk senyawa selalu tetap, tidak bergantung pada cara pembentukan maupun sumber senyawa tersebut (Hukum Perbandingan Tetap).
- Jika diukur pada suhu dan tekanan sama, volume gas-gas yang bereaksi dan volume gas-gas hasil reaksi berbanding sebagai bilangan lingkaran dan sederhana (Hukum Perbandingan Volume).
- Pada suhu dan tekanan tetap, semua gas apapun yang volumenya sama akan mengandung jumlah molekul yang sama (Hukum Avogadro).
- Satu mol setiap zat mengandung 6,022 × 1023 partikel penyusun zat itu atau sebesar tetapan Avogadro (L)
- pada atom, molekul, maupun ion.
- Massa molar (Mm) suatu zat mengatakan massa satu mol zat dalam satuan gram. Satuan massa molar adalah gram per mol.
- Volume molar (Vm) mengatakan volume satu molar gas. Pada keadaan standar (0 oC dan 1 atm), volume molar gas ialah 22,4 liter per mol.
- Untuk gas-gas pada keadaan bukan standar, perhitungan volume molar gas memakai persamaan gas ideal, yaitu PV = nRT.
- Koefisien reaksi dalam suatu persamaan reaksi kimia, selain mengatakan perbandingan volume dan jumlah partikel yang bereaksi juga menyatakan perbandingan mol zat-zat yang bereaksi. Perbandingan koefisien reaksi ini dinamakan rasio stoikiometri, disingkat RS.
Anda kini sudah mengetahui Hukum Dasar Kimia dan Perhitungan Kimia Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Sunarya, Y. dan A. Setiabudi. 2009. Praktis dan Aktif Belajar Kimia 1 : Untuk Kelas X Sekolah Menengah Atas / Madrasah Aliyah. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 226.


No comments:
Post a Comment