Reaksi Redoks, Reduksi dan Oksidasi, Contoh Soal, Aplikasi, Bilangan Oksidasi, Kimia - Selain reaksi penggabungan, reaksi penguraian, dan reaksi metatesis, masih terdapat satu jenis reaksi yang penting, yaitu reaksi reduksi-oksidasi (redoks). Reaksi ini mempunyai aplikasi yang sangat penting sebab merupakan reaksi kimia yang menghasilkan energi listrik siap pakai, seperti pada baterai dan aki (accumulator). Selain itu, pada proses pembakaran, fotosintesis, dan metabolisme makanan dalam sistem sel makhluk hidup juga terjadi reaksi redoks. Bagaimanakah perkembangan dari konsep reaksi redoks? Bagaimanakah korelasi reaksi redoks dengan tata nama senyawanya? Anda sanggup menjawab pertanyaan tersebut jikalau Anda pelajari pecahan ini dengan baik.
Pada pecahan sebelumnya, Anda sudah mengenal beberapa macam reaksi. Sebutkan kembali reaksi apa saja yang Anda ketahui. Sekarang, Anda akan dikenalkan dengan salah satu macam reaksi yang melibatkan transfer elektron dari satu spesi kimia ke spesi kimia lain, sanggup berupa senyawa, molekul, atau ion. Reaksi ini terjadi pada reaksi metabolisme zat makanan dalam tubuh, proses pemurnian logam-logam dari bijihnya, baterai, dan accumulator.
Makna reduksi oksidasi (redoks) mengalami perkembangan dari masa ke masa sejalan dengan perkembangan ilmu Kimia sendiri. Sebelum dikenal elektron, konsep redoks dihubungkan dengan reaksi kimia yang melibatkan oksigen dan hidrogen.
1. Pengikatan Oksigen
Sejak dulu, para pakar kimia sudah mengetahui bahwa oksigen dapat bereaksi dengan banyak unsur. Senyawa yang terbentuk dari hasil reaksi dengan oksigen dinamakan oksida sehingga reaksi antara oksigen dan suatu unsur dinamakan reaksi oksidasi ibarat teladan pada Gambar 1.
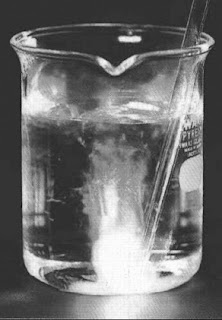 |
| Gambar 1. Fosfor putih dalam air diaerasi dengan udara sehingga terjadi reaksi oksidasi disertai nyala api dalam air. P4(s) + 5O2 (g) → 2P2O5(g) |
4Fe(s) + 3O2(g) → 2Fe2O3(s)
Pada reaksi tersebut, besi mengalami oksidasi dengan cara mengikat oksigen menjadi besi oksida.
Kebalikan dari reaksi oksidasi dinamakan reaksi reduksi. Pada reaksi reduksi terjadi pelepasan oksigen. Besi oksida sanggup direduksi dengan cara direaksikan dengan gas hidrogen, persamaan reaksinya:
Fe2O3(s) + 3H2(g) → 2Fe(s) + 3H2O(g)
Contoh:
C(s) + O2(g) → CO2(g) ...........(reaksi oksidasi)
CO(g) + H2(g) → C(s) + H2O(g) ........(reaksi reduksi)
2SO2(g) + O2(g) → 2SO3(g) .........(reaksi oksidasi)
CH4(g) + 2O2(g) → CO2(s) + 2H2O(g) .........(reaksi oksidasi) Contoh Soal Konsep Redoks Melibatkan Oksigen (1) :
Manakah di antara reaksi berikut yang tergolong reaksi reduksi-oksidasi menurut konsep pelepasan dan pengikatan oksigen?
A. 2H2O2(aq) → 2H2O(l) + O2(g)
B. Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g)Jawaban :
Reaksi (a) terjadi pelepasan oksigen maka reaksinya tergolong reaksi reduksi.
Reaksi (b) terjadi pelepasan oksigen, tergolong reaksi reduksi.
2. Pelepasan dan Penerimaan Elektron
Konsep redoks yang melibatkan transfer elektron berkembang setelah diketahui adanya elektron dalam atom dan reaksi pembentukan senyawa ion (lihat kembali topik ikatan ion). Tuliskan pembentukan senyawa NaCl dari unsur-unsurnya. Spesi manakah yang melepaskan elektron dan yang menerima elektron?
Dalam konsep redoks, insiden pelepasan elektron dinamakan oksidasi, sedangkan insiden penerimaan elektron dinamakan reduksi. Pada pembentukan senyawa NaCl dari unsur-unsurnya, atom natrium mengalami oksidasi, sedangkan atom klorin mengalami reduksi. Penggabungan kedua proses itu dinamakan reaksi redoks.
Reaksi redoks pada insiden perkaratan besi sanggup dijelaskan dengan reaksi berikut :
2Fe → 2Fe3+ + 6e– (oksidasi)
3O2 + 6e– → 3O2– (reduksi)
Pada reaksi tersebut, enam elektron dilepaskan oleh dua atom besi dan diterima oleh tiga atom oksigen membentuk senyawa Fe2O3. Oleh karena itu, insiden oksidasi selalu disertai insiden reduksi. Pada setiap persamaan reaksi, massa dan muatan harus setara antara ruas kanan dan ruas kiri (ingat kembali penulisan persamaan reaksi).
Persamaan reaksi redoks tersebut mempunyai muatan dan jumlah atom yang sama antara ruas sebelah kiri dan sebelah kanan persamaan reaksi. Oksidasi besi netral melepaskan elektron yang membuatnya kehilangan muatan. Dengan menyamakan koefisiennya maka muatan pada kedua ruas persamaan reaksi menjadi sama. Penyetaraan pada reaksi reduksi oksigen juga memakai cara yang sama.
Contoh Soal Reduksi Oksidasi Berdasarkan Transfer Elektron (2) :
Manakah dari reaksi berikut yang mengalami oksidasi dan reduksi berdasarkan
konsep transfer elektron?
Mg(s) + Cl2(g) → MgCl2(g)
Pembahasan :
Persamaan reaksi ionnya:
Dari persamaan tersebut, sanggup diketahui bahwa Mg melepaskan elektron dan Cl mendapatkan elektron. Dengan demikian, Mg mengalami oksidasi dan Cl mengalami reduksi.
3. Reduktor dan Oksidator
Berdasarkan uraian sebelumnya, apa yang sanggup Anda simpulkan mengenai zat-zat kimia dihubungkan dengan konsep redoks? Semua zat kimia sanggup dikelompokkan ke dalam dua kelompok, yakni zat-zat yang mengalami oksidasi dan zat-zat yang mengalami reduksi.
Dalam reaksi redoks, pereaksi yang sanggup mengoksidasi pereaksi lain dinamakan zat pengoksidasi atau oksidator. Sebaliknya, zat yang dapat mereduksi zat lain dinamakan zat pereduksi atau reduktor.
Pada Contoh 2, magnesium melepaskan elektron yang menyebabkan klorin mengalami reduksi. Dalam hal ini, magnesium disebut zat pereduksi atau reduktor. Sebaliknya, atom klorin berperan dalam mengoksidasi magnesium sehingga klorin disebut oksidator.
Contoh Soal Reduktor dan Oksidator (3) :
Kelompokkan pereaksi-pereaksi berikut ke dalam oksidator dan reduktor.
a. 4Cu(s) + O2(g) → 2Cu2O(s)
b. 2Na(s) + H2(g) → 2NaH(s)Jawaban :
4Cu → 4Cu++ 4e– (reduktor)
O2 + 4e– → 2O2– (oksidator)
2Na → 2Na+ + 2e– (reduktor)
H2 + 2e– → 2H– (oksidator)
B. Reaksi Reduksi Oksidasi
Perkembangan konsep redoks tidak berhenti hingga transfer elektron. Konsep tersebut berkembang terus sejalan dengan munculnya masalah dalam reaksi-reaksi redoks yang tidak sanggup dijelaskan dengan konsep transfer elektron maupun dengan konsep pengikatan oksigen. Akan tetapi, hanya sanggup dijelaskan dengan konsep bilangan oksidasi.
1. Bilangan Oksidasi dan Penentuan Bilangan Oksidasi
Apa yang dimaksud dengan bilangan oksidasi? Bilangan oksidasi adalah suatu bilangan yang menyatakan valensi atom dalam suatu senyawa yang sanggup mempunyai harga positif maupun negatif. Bagaimana memilih bilangan oksidasi (biloks) atom suatu unsur? Dalam hal ini, para pakar kimia bersepakat menyebarkan hukum yang berkaitan dengan biloks unsur, yaitu sebagai berikut.
a. Dalam bentuk unsur atau molekul unsur (Gambar 2), bilangan oksidasi atom-atomnya sama dengan nol.
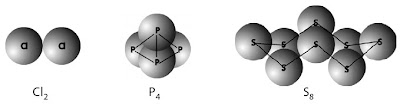 |
| Gambar 2. Contoh molekul unsur: Cl2, P4, S8. |
Biloks Na dalam unsur Na = 0; biloks O dalam molekul O2 = 0;
biloks Cl dalam molekul Cl2 = 0; biloks P dalam molekul P4 = 0.
b. Dalam senyawa ion, bilangan oksidasi atom-atom sama dengan muatan kation dan anionnya.
Contoh:
Dalam senyawa NaCl, atom Na bermuatan +1 dan atom Cl bermuatan –1 sehingga bilangan oksidasi Na = +1 dan Cl = –1.
c. Bilangan oksidasi atom-atom yang lain ditentukan berdasarkan aturan berikut.
1) Biloks atom golongan IA dalam semua senyawa ialah +1. Biloks atom golongan IIA dalam semua senyawa ialah +2.
2) Biloks atom-atom unsur halogen dalam senyawa biner ialah –1, sedangkan dalam senyawa poliatom bergantung pada senyawanya.
3) Biloks atom oksigen dalam senyawa ialah –2, kecuali dalam peroksida (H2O2, Na2O) sama dengan –1 dan dalam superoksida sama dengan – ½ .
4) Biloks atom hidrogen dalam senyawa ialah +1, kecuali dalam senyawa hidrida sama dengan –1.
d. Jumlah total bilangan oksidasi dalam senyawa netral sama dengan nol (Gambar 3). Jumlah total bilangan oksidasi untuk ion sama dengan muatan ionnya.
 |
| Gambar 3. Biloks total molekul-molekul sama dengan nol. |
Biloks total dalam molekul H2O = 0; biloks total dalam ion CO32– = –2; biloks total dalam ion NH4+ = +1.
Contoh Soal Menentukan Bilangan Oksidasi Atom dalam Senyawa Ion (3) :
Tentukan biloks setiap atom dalam senyawa dan ion berikut: NO2, ClO3– , NH4+.
Penyelesaian :
Dalam NO2 :
• Biloks total molekul NO2 = 0 (aturan d)
• Biloks O dalam NO2 = –2 (aturan c.3)
• Biloks N dalam NO2 = {biloks N + 2(biloks O) = 0}
Jadi, biloks N dalam NO2 = +4.
Dalam ion ClO3– :
• Biloks total ion ClO3– = –1 (aturan d)
• Biloks O dalam ClO3– = –2 (aturan c.3)
• Biloks Cl dalam ClO3– = {biloks Cl + 3(biloks O) = –1}
Jadi, biloks Cl dalam ClO3– = +5.
Dalam ion NH4+ :
• Biloks ion NH4+ = +1 (aturan d)
• Biloks H dalam NH4+ = +1 (aturan c.4)
• Biloks N dalam NH4+ = {biloks N + 4(biloks H)= +1}
Jadi, biloks N dalam NH4+ = –3.
Pada teladan soal tersebut, atom N sanggup mempunyai biloks lebih dari satu, yakni –3 dan +4. Kenyataannya bukan hanya atom N, melainkan banyak atom-atom yang mempunyai biloks lebih dari satu, terutama atomatom
unsur transisi dan beberapa atom nonlogam.
Bagaimana memilih biloks atom yang mempunyai lebih dari satu bilangan oksidasi, ibarat yang terdapat dalam senyawa poliatom, misalnya FeSO4, Fe2(SO3)3, KCrO3, dan K2Cr2O7? Biloks atom dalam senyawa ion poliatom sanggup ditentukan dengan gampang jikalau Anda mengetahui muatan setiap ion.
Dalam senyawa FeSO4, atom Fe dan S mempunyai biloks lebih dari satu sehingga sukar memilih biloksnya secara langsung. Akan tetapi, jika Anda mengetahui muatan setiap ion, contohnya ion Fe = 2+ dan ion SO4 = 2– (aturan d) maka biloks Fe dan S sanggup ditentukan. Agar lebih mudah, perhatikan reaksi penguraian FeSO4 berikut.
FeSO4(s) → Fe2+(aq) + SO4 2–(aq)
Menurut hukum b, biloks ion sama dengan muatannya maka biloks Fe = +2. Biloks S ditentukan dengan cara yang sama ibarat pada contoh soal sebelumnya, hasilnya biloks S = +6. Jadi, biloks atom-atom dalam FeSO4 adalah Fe = +2, S = +6, dan O = –2.
Contoh Soal Menentukan Bilangan Oksidasi Atom dalam Senyawa Poliatom (5) :
Tentukan biloks atom-atom dalam Fe2(SO3)3.
Pembahasan :
Muatan ion dalam Fe2(SO3)3 adalah
Fe3+ = 3+ dan SO3 2– = 2–
Biloks Fe = +3 (aturan 4)
Biloks total ion SO3 2– = –2 (aturan 4)
Biloks O dalam SO3 2– = –2 (aturan 3.c)
Biloks S dalam SO3 2– = {biloks S + 3 (biloks O) = –2}.
Jadi, biloks S dalam SO3 2– = +4.
Contoh Soal Ebtanas 1999–2000 :
Bilangan oksidasi atom Mn tertinggi di antara senyawa berikut ialah ....
Jawaban :
A. biloks O = –2, MnO2 = 0
biloks MnO2 = {biloks Mn +2 (biloks O)}
biloks Mn= +4
Dengan cara yang sama:
B. biloks Mn= –3
C. biloks Mn= +2
D. biloks Mn= +7
E. biloks Mn= +6
Jadi, biloks Mn tertinggi sama dengan +7 (D).
Contoh Soal Ebtanas 1999–2000 :
Bilangan oksidasi atom Mn tertinggi di antara senyawa berikut ialah ....
A. MnO2
B. Mn2O3
C. Mn3O4
D. KMnO4
E. K2MnO4Jawaban :
A. biloks O = –2, MnO2 = 0
biloks MnO2 = {biloks Mn +2 (biloks O)}
biloks Mn= +4
Dengan cara yang sama:
B. biloks Mn= –3
C. biloks Mn= +2
D. biloks Mn= +7
E. biloks Mn= +6
Jadi, biloks Mn tertinggi sama dengan +7 (D).
2. Reaksi Reduksi Oksidasi dan Bilangan Oksidasi
Bagaimana bilangan oksidasi sanggup menjelaskan reaksi redoks? Apa Anda cukup puas dengan konsep transfer elektron? Tinjau reaksi antara SO2 dan O2 membentuk SO3. Reaksinya dapat ditulis sebagai berikut.
2SO2(g) + O2(g) → 2SO3(g)
Jika dikaji berdasarkan konsep pengikatan oksigen maka reaksi tersebut ialah reaksi oksidasi. Jika dikaji berdasarkan transfer elektron maka Anda mungkin akan bingung, mengapa? Pada reaksi tersebut tidak terjadi transfer elektron, tetapi melalui penggunaan bersama pasangan elektron membentuk ikatan kovalen. Oleh lantaran senyawa SO3 merupakan senyawa kovalen (perhatikan Gambar 4) maka reaksi tersebut tidak sanggup dijelaskan dengan konsep transfer elektron.
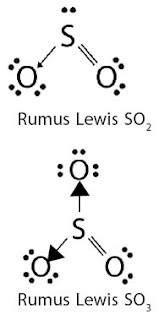 |
| Gambar 4. Rumus struktur lewis SO2 dan SO3. |
a) CO2(g) + 4H2(g) → CH4(g) + 2H2O(l)
b) I2(g) + 3Cl2(g) → 2ICl3(g)
c) Cu(s) + HNO3(aq) → Cu(NO3)2(aq) + NO2(g) + H2O(l)
d) Na2S2O3(aq) + 2HCl(aq) → 2NaCl(aq) + H2O(l) + SO2(g) + S(s)Oleh lantaran banyak reaksi redoks yang tidak sanggup dijelaskan dengan konsep pengikatan oksigen maupun transfer elektron maka para pakar kimia mengembangkan konsep alternatif, yaitu perubahan bilangan oksidasi. Menurut konsep ini, jikalau dalam reaksi bilangan oksidasi atom meningkat maka atom tersebut mengalami oksidasi. Sebaliknya, jikalau bilangan oksidasinya turun maka atom tersebut mengalami reduksi.
Berdasarkan konsep bilangan oksidasi, apakah reaksi SO2 dan O2 tersebut merupakan reaksi redoks? Untuk mengetahui suatu reaksi tergolong reaksi redoks atau bukan berdasarkan konsep perubahan bilangan oksidasi maka perlu diketahui biloks dari setiap atom, baik dalam pereaksi maupun hasil reaksi. Biloks dari SO2, O2, dan SO3 adalah 0 (aturan d). Biloks O dalam SO2 dan SO3 = –2 (aturan c.3) maka biloks S dalam SO2 = +4 dan biloks S dalam SO3 = +6. Secara diagram sanggup dinyatakan sebagai berikut.
a) atom S mengalami kenaikan biloks dari +4 menjadi +6, peristiwa ini disebut oksidasi;
b) atom O mengalami penurunan biloks dari 0 menjadi –2, insiden ini disebut reduksi.
Dengan demikian, reaksi tersebut ialah reaksi redoks. Manakah reduktor dan oksidator pada reaksi di atas? Oleh karena molekul O2 menyebabkan molekul SO2 teroksidasi maka molekul O2 adalah oksidator. Molekul O2 sendiri mengalami reduksi jawaban molekul SO2 sehingga SO2 disebut reduktor.
Contoh Soal Reaksi Redoks Menurut Perubahan Bilangan Oksidasi (7) :
Tentukan manakah oksidasi dan reduksi serta reduktor dan oksidator pada reaksi berikut:
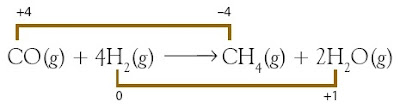
CO2(g) + 4H2(g) → CH4(g) + 2H2O(g)
Jawaban :
Tentukan biloks setiap atom.
Dalam CO2, biloks O = –2 dan C = +4.
Dalam H2, biloks H = 0
Dalam CH4, biloks H = +1, dan C = –4
Dalam H2O, biloks H = +1 dan O = –2
Atom C mengalami penurunan biloks dari +4 menjadi –4 (reduksi) dan atom H mengalami kenaikan biloks dari 0 menjadi +1 (oksidasi). Dalam bentuk diagram sanggup dinyatakan sebagai berikut:
Contoh Soal UMPTN 1999/B :
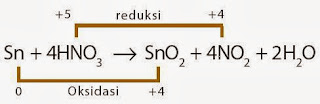
Perhatikan reaksi redoks berikut:
Sn + 4HNO3 → SnO2 + 4NO2 + H2O
Senyawa yang berperan sebagai reduktor ialah ....
A. Sn
Pembahasan :
Oksidator ialah N Reduktor ialah Sn Jadi, lantaran Sn mengakibatkan N mengalami reduksi maka Sn bertindak sebagai reduktor (A)
Reaksi Disproporsionasi
Perhatikan reaksi redoks berikut:
Sn + 4HNO3 → SnO2 + 4NO2 + H2O
Senyawa yang berperan sebagai reduktor ialah ....
A. Sn
B. HNO3
C. SnO2
D. NO2
E. H2OPembahasan :
Oksidator ialah N Reduktor ialah Sn Jadi, lantaran Sn mengakibatkan N mengalami reduksi maka Sn bertindak sebagai reduktor (A)
Reaksi Disproporsionasi
Apa yang dimaksud dengan reaksi disproporsionasi? Reaksi disproporsionasi atau disebut juga reaksi swaredoks ialah suatu reaksi yang mengalami oksidasi dan juga reduksi pada pereaksinya.
Contoh :
Hidrogen peroksida dipanaskan pada suhu di atas 60 °C dan terurai menurut persamaan reaksi berikut:
H2O2(l) → H2O(l) + O2(g)
Biloks atom O dalam H2O2 adalah –1 (aturan c.3). Setelah terurai berubah menjadi –2 (dalam H2O) dan 0 dalam (O2). Persamaan kerangkanya:
Oleh lantaran molekul H2O2 dapat berperan sebagai oksidator dan juga reduktor maka reaksi tersebut dinamakan reaksi disproporsionasi atau reaksi swaredoks.
3. Tata Nama Senyawa dan Biloks
Pada pecahan sebelumnya, Anda telah berguru tata nama senyawa biner dan senyawa poliatom. Tata nama tersebut berlaku untuk zat molekuler atau senyawa ion yang mengandung kation hanya mempunyai satu harga muatan atau biloks logam golongan IA dan IIA.
Untuk kation-kation logam yang mempunyai lebih dari satu harga biloks (khususnya unsur-unsur transisi), tata namanya ditambah angka romawi dalam tanda kurung yang menunjukkan harga biloks. Angka romawi tersebut tidak terpisahkan dari nama kationnya.
Catatan :
Walaupun biloks yang berubah hanya satu atom dalam molekul, tetapi yang disebut reduktor atau oksidator bukan atomnya, melainkan molekulnya.
Contoh:
SnCl2 dan SnCl4, keduanya mempunyai unsur yang sama. Untuk membedakan nama kedua senyawa itu, harga biloks timah disisipkan ke dalam nama berdasarkan hukum sebelumnya (timah klorida). Biloks Sn dalam SnCl2 adalah +2 dan dalam SnCl4 adalah +4. Jadi, nama kedua senyawa itu adalah
SnCl2 : timah(II) klorida
SnCl4 : timah(IV) klorida
C. Aplikasi Reaksi Reduksi Oksidasi
Secara kimia, reaksi redoks tidak berbeda dengan reaksi-reaksi kimia yang lain, tetapi dalam reaksi redoks ada perubahan bilangan oksidasi akibat perubahan muatan. Perubahan muatan ini disebabkan adanya transfer elektron dari satu atom ke atom lain. Jika transfer elektron ini dimanfaatkan akan menghasilkan energi listrik arus searah alasannya aliran listrik tiada lain ialah aliran elektron.
1. Sel Volta Komersial
Sel Volta ialah sumber energi listrik siap pakai yang dikemas dalam bentuk dan ukuran sesuai kegunaan. Sel Volta terdiri atas elektrode (anode dan katode) kawasan terjadinya reaksi redoks. Kedua elektrode ini dicelupkan ke dalam zat kimia yang berperan sebagai medium aliran listrik dan sebagai oksidator atau reduktor.
Sekilas Kimia
Alessandro Volta
(1745–1827)
Umumnya, sel Volta komersial berupa sel kering baterai dan accumulator (accu). Jenis baterai majemuk di antaranya baterai seng-karbon, baterai litium, dan baterai nikel-kadmium (nicad).
a. Baterai Seng-Karbon
Baterai jenis seng-karbon atau Leclanche ialah baterai generasi pertama yang dikomersilkan, digunakan untuk lampu senter, jam dinding, radio, dan alat-alat elektronik lainnya. Baterai ini terdiri atas seng (anode) dan batang grafit (katode). Sebagai zat elektrolitnya ialah campuran MnO2, NH4Cl, dan serbuk karbon yang dikemas dalam bentuk pasta. Reaksi redoks yang terjadi sangat rumit, tetapi secara sederhana dapat ditulis dalam bentuk persamaan berikut.
Zn(s) → Zn2+(aq) + 2e– .................................................................................................. (anode)
2MnO2(s) + 2NH4+(aq) + 2e– → Mn2O3(s) + 2NH3(aq) + H2O .................................... (katode)
Potensial sel yang dihasilkan ialah 1,5 V dan arus listrik yang mengalir akan berkurang jikalau dipakai. Potensial sel juga akan berkurang jika cuaca dingin.
b. Baterai Merkuri
Sel Volta yang lain ialah sel merkuri atau disebut juga baterai kancing jenis Ruben-Mallory. Sel jenis ini banyak digunakan untuk baterai arloji, kalkulator, dan komputer. Baterai merkuri ini telah dilarang penggunaannya dan ditarik dari peredaran alasannya ancaman yang dikandungnya (logam berat merkuri).
Baterai kancing ini terdiri atas seng (anode) dan merkuri (II) oksida (katode). Kedua elektrode tersebut berupa serbuk padat. Ruang di antara kedua elektrode diisi dengan materi penyerap yang mengandung elektrolit kalium hidroksida (basa, alkalin) (perhatikan Gambar 5).
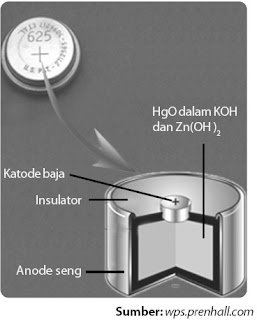 |
| Gambar 5. Baterai merkuri. |
Zn(s) + 2OH–(aq) → ZnO(s) + H2O(l) + 2e– ............................(anode)
HgO(s) + H2O(l) + 2e– → Hg(l) + 2OH– (aq) ...........................(katode)
Potensial sel yang dihasilkan ialah 1,35 V.
c. Baterai Litium
Sel kering tersebut (baterai seng-karbon dan baterai merkuri) tidak benar-benar kering alasannya elektrolit yang digunakan masih berupa pasta. Sel kering yang benar-benar kering ialah sel jenis litium-iodin. Sel litium-iodin ialah sel Volta dengan logam litium sebagai anode dan senyawa kompleks I2 sebagai katode. Kedua elektrode ini dipisahkan oleh lapisan tipis dari litium iodida. Reaksi redoks yang terjadi adalah sebagai berikut.
2Li(s) → 2Li+ (aq) + 2e– .......................................(anode)
3I2(s) + 2e– → 2I3–(aq) ........................................(katode)
Potensial sel yang dihasilkan sebesar 3,6 V.
Baterai jenis litium berbeda dengan baterai seng-karbon dan baterai merkuri alasannya baterai ini sanggup diisi ulang (rechargeable). Baterai litium banyak digunakan untuk mobilephone (HP) dan kendaraan beroda empat mainan.
d. Baterai Nikel-Kadmium
Selain baterai litium-iodin, baterai yang sanggup diisi ulang lainnya adalah baterai nikel-kadmium (nicad). Sel nicad ialah baterai untuk penyimpan muatan. Sel nicad tergolong sel Volta yang terdiri atas kadmium sebagai anode, nikel oksida sebagai katode, dengan elektrolit kalium hidroksida. Baterai nicad banyak digunakan untuk baterai penerang isi ulang. Reaksi sel selama pemakaian ialah sebagai berikut.
Cd(s) + 2OH– (aq) → Cd(OH)2(s) + 2e– .......................................(anode)
2NiO2H(s) + 2H2O(l) + 2e– → 2Ni(OH)2(s) + 2OH– (aq) .............(katode)
2. Sel Accumulator
Sel Volta komersial jenis lain yang sanggup diisi ulang ialah sel timbel atau dikenal dengan accumulator (accu), terdiri atas timbel oksida sebagai katode dan logam timbel berbentuk bunga karang sebagai anode. Kedua elektrode ini dicelupkan dalam larutan H2SO4 10% (perhatikan Gambar 6).
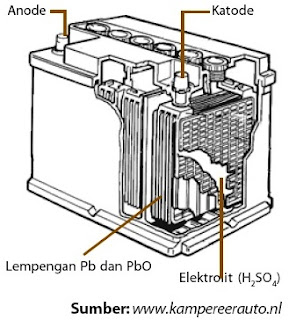 |
| Gambar 6. Accumulator atau aki kendaraan. |
Pb(s) + HSO4 – (aq) → PbSO4(s) + H+(aq) + 2e– .............................(anode)
PbO2(s) + 3H+ (aq) + HSO4 – (aq) + 2e– → PbSO4(s) + 2H2O(l) (katode)
Potensial sel yang dihasilkan dari reaksi tersebut, yaitu sekitar 2 V.
Untuk memperoleh potensial sel sebesar 6 V, diharapkan tiga buah sel yang disusun secara seri. Berapa jumlah sel yang harus disusun seri untuk menghasilkan potensial sel 12 V?
Jika accu telah dipakai, accu sanggup diisi ulang memakai arus listrik searah. Selama proses isi ulang, reaksi dalam sel merupakan kebalikan dari reaksi pemakaian. Reaksinya ialah sebagai berikut:
2PbSO4(s) + 2H2O(l) → Pb(s) +PbO2(s) + 2H2SO4(aq)
Selama proses isi ulang, sejumlah air dalam accu terurai menjadi H2 dan O2, risikonya accu kekurangan air. Oleh lantaran itu, accu yang sering dipakai dan diisi ulang, cairan elektrolitnya harus diganti dengan yang baru.
Sekilas Kimia
Baterai Alkalin
Pernahkah Anda mendengar sebutan baterai alkalin? Baterai alkalin termasuk jenis sel Volta. Elektron yang di hasilkan dari reaksi oksidasi terkumpul di anode dan mengalir melalui kawat eksternal menuju katode, kawasan terjadinya reduksi. Perbedaan voltase atau potensial di antara dua elektrode sebanding dengan energi yang terbentuk.
Reaksi sel keseluruhan :
Zn(s) + 2MnO2(s) + H2O(l) → ZnOH2(s) + Mn2O3(s)
Voltase yang dihasilkan dari sel ini sama dengan 1,54 V. Voltase bergantung pada unsur dan senyawa dalam reaksi.
3. Merancang Sel Volta Sederhana
Pada pecahan sebelumnya, Anda sudah berguru larutan elektrolit, yaitu larutan yang sanggup menghantarkan arus listrik. Selain itu, dalam reaksi redoks terjadi transfer elektron yang sanggup menghasilkan energi listrik. Jika reaksi redoks dilakukan dalam larutan maka larutan tersebut dapat dimanfaatkan sebagai sumber arus listrik. Dapatkah Anda merancang sel Volta sederhana? Prinsip sel Volta ialah adanya elektrode sebagai tempat terjadinya reaksi reduksi (katode) dan oksidasi (anode), serta larutan sebagai media untuk menghantarkan arus listrik.
Setelah Anda melaksanakan percobaan sel Volta berdasarkan hasil rancang-bangun sendiri, dapatkah Anda menjelaskan secara kimia terjadinya aliran listrik pada sel Volta? Mari kita bahas bersama. Ketika logam Zn dan Cu dicelupkan ke dalam larutan H2SO4, keduanya bersaing untuk bereaksi dengan H2SO4. Oleh lantaran logam Zn lebih reaktif maka Zn bereaksi dengan H2SO4 membentuk ZnSO4.
Persamaan reaksinya:
Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g)
Bagaimana hubungannya dengan aliran listrik atau aliran elektron yang sanggup menyalakan lampu? Jika persamaan reaksi tersebut diuraikan maka Anda akan mengetahui sumber elektron dan arah aliran elektron. Oleh lantaran reaksi tersebut ialah reaksi ion maka terjadi transfer elektron. Dalam hal ini, Zn melepaskan elektron membentuk Zn2+ (perhatikan Gambar 7).
Persamaan reaksinya:
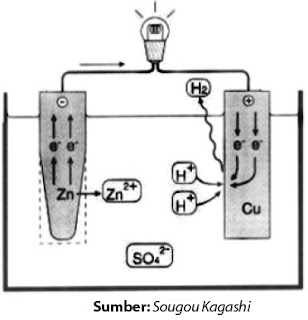 |
| Gambar 7. Mekanisme reaksi dan transfer elektron yang terjadi pada sel Volta. |
Zn(s) → Zn2+ (aq) + 2e–
Elektron yang dihasilkan mengalir melalui rangkaian kawat menuju logam Cu. Aliran elektron ini sanggup menyalakan lampu. Pada elektrode Cu, elektron-elektron ditangkap oleh ion-ion H+ yang terdapat dalam larutan membentuk H2. Persamaan reaksinya:
2H+(aq) + 2e– → H2(g)
Dengan demikian, reaksi redoks yang bekerjsama terjadi dalam sel Volta rancangan Anda, yaitu sebagai berikut.
Zn(s) + 2H+(aq) → Zn2+(aq) + H2(g)
Reaksi totalnya: Zn(s) + H2SO4(aq) → ZnSO44(aq) + H2(g)
Rangkuman :
1. Pengertian reaksi reduksi oksidasi (redoks) mengalami perkembangan sebagai berikut.
a. Pengikatan oksigen dan hidrogen
b. Transfer elektron
c. Perubahan bilangan oksidasi
2. Menurut konsep pengikatan oksigen/hidrogen, oksidasi ialah pengikatan atom oksigen atau pelepasan atom hidrogen. Reduksi ialah proses sebaliknya.
3. Menurut konsep transfer elektron, oksidasi adalah pelepasan elektron dan reduksi ialah penerimaan elektron.
4. Menurut konsep perubahan bilangan oksidasi, oksidasi ialah kenaikan bilangan oksidasi dan reduksi ialah penurunan bilangan oksidasi.
5. Bilangan oksidasi ialah suatu bilangan yang menyatakan valensi atom dalam suatu senyawa yang dapat mempunyai harga positif maupun negatif.
6. Bilangan oksidasi unsur dalam senyawa ditentukan dengan suatu aturan.
7. Dalam reaksi redoks, zat yang sanggup mengoksidasi zat lain dinamakan oksidator dan zat yang dapat mereduksi zat lain dinamakan reduktor.
8. Reaksi redoks sanggup dimanfaatkan sebagai sumber arus listrik searah, ibarat pada sel Volta atau dikenal dengan baterai dan accumulator (accu).
9. Sel Volta sederhana sanggup dibangun dari dua buah elektrode yang dicelupkan ke dalam larutan elektrolit.
Anda kini sudah mengetahui Reaksi Redoks. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Sunarya, Y. dan A. Setiabudi. 2009. Praktis dan Aktif Belajar Kimia 1 : Untuk Kelas X Sekolah Menengah Atas / Madrasah Aliyah. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 226.





No comments:
Post a Comment