Ikatan Kimia, Ion, Kovalen, Logam, Sifat Senyawa, Kestabilan Unsur dan Konfigurasi Elektron, Contoh Soal, Pembahasan, Praktikum - Unsur-unsur biasanya ditemukan di alam dalam keadaan tidak stabil dan unsur-unsur tersebut cenderung untuk membentuk senyawa yang lebih stabil. Pembentukan senyawa ini terjadi melalui ikatan kimia. Ikatan kimia yang terdapat dalam senyawa sanggup berupa ikatan ion atau ikatan kovalen. Garam dapur (NaCl) merupakan pola dari senyawa yang dibentuk secara ikatan ion. Apakah yang dimaksud dengan ikatan ion? Apakah perbedaan antara ikatan ion dan ikatan kovalen? Anda akan mengetahuinya sesudah mempelajari konsep ikatan kimia di dalam bab ini.
A. Kestabilan Unsur dan Konfigurasi Elektron
Selain gas mulia, hampir semua unsur yang ada di alam terdapat sebagai senyawa (gabungan dua unsur atau lebih yang terikat secara ikatan kimia). Semua ini memperlihatkan bahwa di alam unsur-unsur tidak stabil dalam keadaan unsur bebas. Ketidakstabilan unsur-unsur ini ada hubungannya dengan konfigurasi elektron yang dimilikinya. Pada 1916, G.N. Lewis dan Langmuir menyatakan bahwa unsur-unsur gas mulia sukar berikatan dengan unsur lain maupun dengan unsur sejenis lantaran elektron valensinya sudah penuh. Konfigurasi elektron valensi gas mulia sebanyak 8 elektron (oktet), kecuali helium 2 elektron (duplet), mirip ditunjukkan pada Tabel 1.
Tabel 1. Konfigurasi Elektron Unsur-Unsur Gas Mulia
Unsur | Nomor Atom | Konfigurasi Elektron |
He | 2 | 2 |
Ne | 10 | 2 8 |
Ar | 18 | 2 8 8 |
Kr | 36 | 2 8 18 8 |
Xe | 54 | 2 8 18 18 8 |
Rn | 86 | 2 8 18 32 18 8 |
Dengan demikian, sanggup disimpulkan bahwa suatu atom yang memiliki konfigurasi elektron serupa dengan gas mulia akan stabil. Dengan kata lain, unsur-unsur yang mempunyai konfigurasi elektron tidak mirip dengan konfigurasi elektron gas mulia tidak stabil. Berdasarkan hal itu, Lewis menyatakan bahwa unsur-unsur selain gas mulia sanggup mencapai stabil dengan cara bersenyawa dengan unsur lain atau unsur yang sama biar konfigurasi elektron dari setiap atom itu menyerupai konfigurasi elektron gas mulia. Suatu atom sanggup mencapai konfigurasi elektron gas mulia dengan cara melepaskan elektron valensi, menangkap elektron, atau memakai bersama elektron valensi membentuk pasangan elektron.
Sekilas Kimia
G. N. Lewis
Lewis menjelaskan tentang ikatan kovalen didasarkan pada konfigurasi elektron gas mulia dengan delapan elektron valensi (oktet). Oleh lantaran itu, teori Lewis dikenal dengan teori oktet.
B. Ikatan Ion
Untuk mencapai keadaan stabil, atom-atom melaksanakan ikatan satu sama lain dengan cara serah-terima elektron valensi membentuk ikatan ion. Senyawa yang dibuat dinamakan senyawa ion. Ikatan ion terbentuk akibat adanya serah-terima elektron di antara atom-atom yang berikatan sehingga konfigurasi elektron dari atom-atom itu ibarat konfigurasi elektron gas mulia. Adanya serah-terima elektron menghasilkan atom-atom bermuatan listrik yang berlawanan sehingga terjadi gaya tarik-menarik elektrostatik. Gaya tarik-menarik inilah yang disebut ikatan ion. Atom-atom yang menyerahkan elektron valensinya kepada atom pasangannya yang bermuatan positif disebut kation. Adapun atom-atom yang mendapatkan elektron yang bermuatan negatif disebut anion.
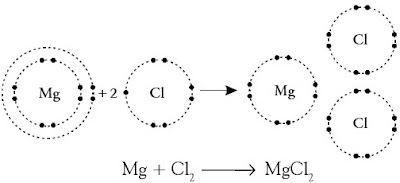
Lewis menggambarkan elektron valensi atom dengan titik yang mengelilingi lambang atomnya. Jumlah titik menyatakan jumlah elektron valensi. Penulisan mirip itu dikenal dengan rumus titik elektron. Perhatikan proses pembentukan senyawa natrium klorida (NaCl) yang terbentuk dari atom natrium (Na) dan atom klorin (Cl) berikut.
Na + Cl → Na+ Cl –
Atom natrium melepaskan satu elektron membentuk kation Na+ , konfigurasi elektronnya sama dengan atom neon (2 8). Pada saat bersamaan, atom klorin mendapatkan elektron dari atom natrium membentuk anion Cl –, konfigurasinya sama dengan atom argon (2 8 8). Oleh karena kedua ion yang terbentuk mempunyai muatan berlawanan maka terjadi gaya tarik-menarik elektrostatik (gaya coulomb) membentuk ikatan ion (perhatikan Gambar 1).
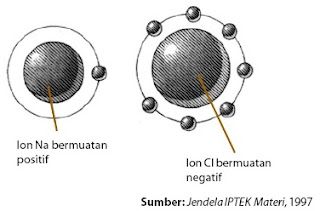 |
| Gambar 1. Ikatan Ion. |
Tabel 2. Anion dan Kation Beberapa Unsur
IA | IIA | VIA | VIIA |
Li+ | Be2+ | O2– | F– |
Na+ | Mg2+ | S2– | Cl– |
K+ | Ca2+ | – | Br– |
Rb+ | Sr2+ | – | I– |
Contoh Soal Pembentukan Ikatan Ion (1) :
Tuliskan pembentukan ikatan ion dari magnesium dan klorin dalam senyawa MgCl2.
Pembahasan :
Pada pembentukan senyawa MgCl2 , satu atom Mg mengikat dua atom Cl. Konfigurasi elektron 12Mg : 2 8 2. Atom Mg akan stabil jikalau melepaskan dua elektron valensinya membentuk Mg2+ (2 8). Konfigurasi elektron 17Cl : 2 8 7. Atom Cl akan stabil jikalau mendapatkan satu elektron valensi menjadi Cl – (2 8 8).
Dengan demikian, dua elektron yang dilepaskan Mg akan diterima oleh dua atom klor. Ketiga ion ini akan tarik menarik membentuk ikatan ion.
Contoh Soal Ebtanas 1999-2000 :
Diketahui unsur-unsur P, Q, R, S, T dengan nomor atom berturut-turut 12, 13, 14, 15 , dan 35. Ikatan ion sanggup terjadi antara atom-atom unsur ....
A. P dan Q
B. Q dan R
C. R dan S
D. P dan T
E. S dan T
Pembahasan :
Konfigurasi elektron:
• 12P : 2 8 2 (atom logam)
• 13Q : 2 8 3 (atom logam)
• 14R : 2 8 4 (atom semi logam)
• 35T : 2 8 18 7 (atom nonlogam)
Ikatan ion terjadi antara atom logam dan nonlogam.
Jadi, jawabannya yaitu (D).
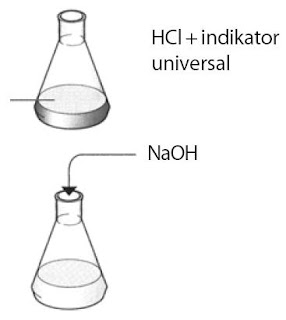
Praktikum Kimia Pembuatan Garam Natrium Klorida (1) :
Tujuan :
Membuktikan ikatan ion melalui pembuatan garam dari ion natrium dan klorin.
Alat :
Diketahui unsur-unsur P, Q, R, S, T dengan nomor atom berturut-turut 12, 13, 14, 15 , dan 35. Ikatan ion sanggup terjadi antara atom-atom unsur ....
A. P dan Q
B. Q dan R
C. R dan S
D. P dan T
E. S dan T
Pembahasan :
Konfigurasi elektron:
• 12P : 2 8 2 (atom logam)
• 13Q : 2 8 3 (atom logam)
• 14R : 2 8 4 (atom semi logam)
• 35T : 2 8 18 7 (atom nonlogam)
Ikatan ion terjadi antara atom logam dan nonlogam.
Jadi, jawabannya yaitu (D).
Praktikum Kimia Pembuatan Garam Natrium Klorida (1) :
Tujuan :
Membuktikan ikatan ion melalui pembuatan garam dari ion natrium dan klorin.
Alat :
- Labu erlenmeyer
- Pembakar bunsen
- Gelas kimia
- Cawan penguap
- Kaki tiga
- Kasa
- Spatula
- HCl 10 mL
- NaOH 10 mL
- Larutan indikator
- Air
- Tuangkan 10 mL HCl encer ke dalam labu erlenmeyer.
- Campurkan dengan 10 mL larutan NaOH.
- Amati warna yang terjadi.
- Jika warnanya masih merah, tambahkan beberapa tetes natrium hidroksida hingga netral. Amati warna yang dihasilkan.
- Aduk labu setiap menambahkan NaOH.
- Cek larutan yang dihasilkan dengan larutan indikator.
- Tuangkan larutan garam netral tersebut pada gelas kimia. Kemudian, panaskan hingga terbentuk kristal garam.
- Letakkan kristal garam tersebut pada cawan penguap.
- Apakah yang sanggup Anda amati ketika larutan menjadi netral?
- Apakah nama garam yang Anda buat?
- Dapatkah Anda menggambarkan pembentukan garam dengan menuliskan reaksinya?
- Jelaskan jenis ikatan garam yang terjadi.
Unsur-unsur logam dan bukan logam cenderung membentuk senyawa ion untuk mencapai keadaan stabil melalui serah terima elektron sehingga tercapai konfigurasi elektron mirip gas mulia. Di alam, banyak senyawa yang terbentuk dari unsur-unsur bukan logam mirip gas oksigen (O2), nitrogen (N2), dan metana (CH4). Bagaimanakah molekul-molekul tersebut dibentuk?
3.1. Ikatan Kovalen
Menurut Lewis, atom-atom bukan logam sanggup membentuk ikatan dengan atom-atom bukan logam melalui penggunaan bersama pasangan elektron valensinya. Apa yang dimaksud dengan penggunaan bersama pasangan elektron valensi? Mengapa ikatan antar-atom bukan logam tidak melalui serah-terima elektron?
Tabel 3. Beberapa Unsur Bukan Logam yang Dapat Membentuk Ikatan Kovalen
IA | IVA | VA | VIA | VIIA |
H | C | N | O | F |
P | S | Cl | ||
Br | ||||
I |
Atom-atom bukan logam umumnya berada pada golongan VA–VIIA, artinya atom-atom tersebut mempunyai elektron valensi banyak (5–7). Jika elektron valensinya banyak, apakah yang akan dilakukan atom-atom golongan VA–VIIA untuk mencapai konfigurasi elektron mirip gas mulia? Untuk mencapai konfigurasi elektron mirip gas mulia, atom-atom cenderung mengadakan saham (saling menyumbang), setiap atom menyumbang elektron valensi untuk digunakan bersama. Ikatan yang terbentuk melalui penggunaan bersama pasangan elektron valensi dinamakan ikatan kovalen. Senyawa yang dibuat dinamakan senyawa kovalen. Untuk menyatakan elektron valensi dalam ikatan kovalen, Lewis menggunakan rumus titik elektron.
Ikatan kovalen tunggal yaitu ikatan yang terbentuk dari penggunaan bersama sepasang elektron (setiap atom memperlihatkan saham satu elektron untuk digunakan bersama).
Contoh :
Atom H sanggup berikatan kovalen dengan Cl membentuk HCl. Perhatikan konfigurasi elektron atom H dan Cl berikut.
1H = 1 dan 17Cl = 2 8 7
1H = 1 dan 17Cl = 2 8 7
Agar elektron valensi atom H mirip dengan atom He (2) maka diperlukan satu elektron. Demikian pula atom Cl, biar mirip dengan konfigurasi elektron atom Ar (2 8 8), dibutuhkan satu elektron. Oleh lantaran kedua atom tersebut masing-masing memerlukan satu elektron maka cara yang paling mungkin yaitu setiap atom memberikan satu elektron valensi untuk membentuk sepasang elektron ikatan. Perhatikan Gambar 2.
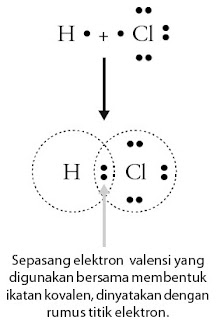 |
| Gambar 2. Pembentukan ikatan kovalen tunggal pada molekul HCl |
Tuliskan pembentukan ikatan kovalen tunggal antara atom C dan H dalam molekul CH4.
Penyelesaian :
Konfigurasi elektron atom 1H = 1.
Konfigurasi elektron atom 6C = 2 4.
Atom C akan stabil jikalau mengikat empat elektron membentuk konfigurasi mirip dengan atom Ne (2 8). Empat elektron ini sanggup diperoleh dengan cara menyumbangkan empat atom H. Jadi, setiap atom H memperlihatkan saham 1 elektron valensinya.
Pada CH4, setiap atom H mempunyai 2 elektron valensi (seperti He) dan atom C memiliki 8 elektron valensi (seperti Ne). Dalam molekul CH4 terdapat 4 pasang elektron ikatan atau 4 ikatan kovalen tunggal.
Sepasang elektron ikatan sanggup dinyatakan dengan satu garis. Misalnya, pada molekul HCl, sepasang elektron ikatan sanggup dituliskan dalam bentuk H–Cl. Pada molekul CH4 , keempat pasang elektron ikatan dapat dituliskan dalam bentuk mirip ditunjukkan pada Gambar 3.
3.3. Ikatan Kovalen Rangkap
 |
| Gambar 3. Garis yang menyatakan pasangan elektron ikatan. |
Dalam ikatan kovalen, selain ikatan kovalen tunggal juga terdapat ikatan kovalen rangkap dua dan ikatan kovalen rangkap tiga. Ikatan kovalen rangkap dua terbentuk dari dua elektron valensi yang disahamkan oleh setiap atom, contohnya pada molekul O2. Ikatan kovalen rangkap tiga terbentuk dari tiga elektron valensi yang disahamkan oleh setiap atom, misalnya dalam molekul N2.
Dapatkah Anda menggambarkan pembentukan ikatan kovalen rangkap dua dan rangkap tiga pada molekul O2 dan N2 ? Konfigurasi elektron atom 8O = 2 6. Atom O akan stabil jikalau konfigurasi elektronnya serupa dengan 10Ne = 2 8. Agar stabil maka atom O memerlukan 2 elektron tambahan. Kedua elektron ini diperoleh dengan cara patungan 2 elektron valensi dari masing-masing atom O membentuk ikatan kovalen rangkap dua (perhatikan Gambar 4).
 |
| Gambar 4. Pembentukan ikatan kovalen rangkap dua dalam molekul O2. |
Gambarkan pembentukan ikatan kovalen rangkap dua dalam molekul CO2 .
Penyelesaian :
Konfigurasi elektron atom 6C = 2 4.
Untuk membentuk konfigurasi Ne (2 8), dibutuhkan 4 elektron tambahan. Ke-4 elektron ini diperoleh dari atom O. Setiap atom O menyumbang 2 elektron valensi sehingga membentuk dua buah ikatan kovalen rangkap dua.
Berdasarkan uraian dan pola soal tersebut, dapatkah Anda menyimpulkan hubungan jumlah ikatan rangkap dengan nomor golongan dalam sistem periodik?
Contoh ikatan kovalen rangkap :
Atom N yang terdapat dalam golongan VA membentuk ikatan kovalen rangkap tiga. Atom O dan S yang terdapat dalam golongan VIA membentuk ikatan kovalen rangkap dua. Atom halogen (F, Cl, Br, I) membentuk ikatan kovalen tunggal.
3.4. Ikatan Kovalen Polar
Dalam molekul diatom homointi, seperti H2, Cl2, N2, O2, dan sejenisnya, kedua inti atom saling menarik pasangan elektron dengan ikatan sama besar lantaran skala keelektronegatifan setiap atomnya sama. Untuk mengingat skala keelektronegatifan atom, simak kembali Bab Sistem Periodik Unsur-Unsur.
Apakah yang terjadi jikalau atom H dan atom Cl berikatan? Anda tahu bahwa atom Cl lebih elektronegatif daripada atom H. Kelektronegatifan Cl = 3,0 dan H =2,1. Oleh lantaran atom Cl mempunyai daya tarik terhadap pasangan elektron yang digunakan bersama lebih berpengaruh maka pasangan elektron tersebut akan lebih bersahabat ke arah atom klorin. Apa akibatnya terhadap atom H maupun atom Cl dalam molekul HCl jikalau pasangan elektron pada ikatan itu lebih tertarik kepada atom klorin?
Gejala tersebut menimbulkan terjadinya pengkutuban muatan. Oleh karena pasangan elektron ikatan lebih bersahabat ke arah atom Cl maka atom Cl akan kelebihan muatan negatif. Dengan kata lain, atom Cl membentuk kutub negatif. Akibat bergesernya pasangan elektron ikatan ke arah atom Cl maka atom H akan kekurangan muatan negatif sehingga atom H akan membentuk kutub positif.
Oleh lantaran molekul HCl bersifat netral maka besarnya muatan negatif pada atom Cl harus sama dengan muatan positif pada atom H. Selain itu, kutub positif dan kutub negatif dalam molekul kovalen bukan pemisahan muatan total mirip pada ikatan ion, melainkan secara parsial, dilambangkan dengan δ .
Jika dalam suatu ikatan kovalen terjadi pengkutuban muatan maka ikatan tersebut dinamakan ikatan kovalen polar. Molekul yang dibentuknya dinamakan molekul polar. Sebaran muatan elektron pada molekul polar terdapat di antara rentang ikatan kovalen murni seperti H2 dan ikatan ion mirip NaCl, perhatikan Gambar 5.
 |
| Gambar 5. Rentang kepolaran ikatan berada di antara ikatan kovalen murni dan ikatan ion. |
Bagaimana memilih bahwa suatu molekul tergolong kovalen nonpolar atau kovalen polar? Untuk menjawab duduk masalah ini diperlukan pengetahuan perihal keelektronegatifan unsur-unsur.
Kepolaran molekul berkaitan dengan kemampuan suatu atom dalam molekul untuk menarik pasangan elektron ikatan ke arahnya. Kemampuan tersebut dinyatakan dengan skala keelektronegatifan. Selisih nilai keelektronegatifan dua buah atom yang berikatan kovalen memberikan informasi perihal ukuran kepolaran dari ikatan yang dibentuknya. Jika selisih keelektronegatifan nol atau sangat kecil, ikatan yang terbentuk cenderung kovalen murni. Jika selisihnya besar, ikatan yang terbentuk polar. Jika selisihnya sangat besar, berpeluang membentuk ikatan ion. Selisih keelektronegatifan antara atom H dan H (dalam molekul H2) ; atom H dan Cl (dalam HCl); dan atom Na dan Cl (dalam NaCl) berturut-turut yaitu 0; 0,9; dan 2,1.
Contoh Soal Menentukan Kepolaran Senyawa (3) :
Manakah di antara senyawa berikut yang mempunyai kepolaran tinggi?
a. CO
b. NO
c. HCl
Kunci Jawaban :
Keelektronegatifan setiap atom adalah
C = 2,5; O = 3,5; N = 3,0; Cl = 3,0; H = 2,1
Pada molekul CO, selisih keelektronegatifannya yaitu 3,5 – 2,5 = 1,0.
Pada molekul NO, selisih keelektronegatifannya yaitu 3,5 – 3,0 = 0,5.
Pada molekul HCl, selisih keelektronegatifannya yaitu 3,0 – 2,1 = 0,9.
Jadi, kepolaran molekul sanggup diurutkan sebagai berikut: CO > HCl > NO.
Praktikum Kimia Membuktikan Kepolaran Molekul (2) :
Tujuan :
Membuktikan kepolaran suatu molekul atau senyawa polar yang mempunyai muatan parsial.
Alat :
Pertanyaan :
Tujuan :
Membuktikan kepolaran suatu molekul atau senyawa polar yang mempunyai muatan parsial.
Alat :
- Buret
- Batang fiber/sisir plastik
- Kain wol
- Metanol
- Bensin
- Air
- Benzena
- Alirkan setiap senyawa (metanol, bensin, air, dan benzena) melalui buret secara bergantian.
- Pasang batang fiber atau sisir yang digosok-gosokkan pada kain wol terhadap jalannya aliran senyawa.
- Amati apa yang terjadi.
Pertanyaan :
- Senyawa manakah yang memperlihatkan senyawa polar?
- Mengapa senyawa kovalen polar sanggup dibelokkan ke arah batang fiber atau sisir yang telah digosok-gosokkan pada kain?
- Apa yang sanggup Anda simpulkan dari analisis percobaan tersebut?
Dalam ikatan kovalen terjadi penggunaan bersama pasangan elektron valensi untuk mencapai konfigurasi elektron mirip gas mulia (oktet atau duplet). Jika pasangan elektron yang digunakan pada ikatan kovalen berasal hanya dari salah satu atom, mungkinkah ini terjadi?
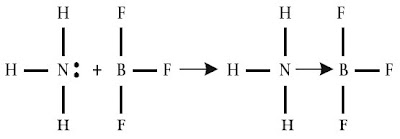
Berdasarkan tanda-tanda kimia, ternyata ada senyawa kovalen yang memiliki sepasang elektron untuk digunakan bersama yang berasal dari salah satu atom. Ikatan mirip ini dinamakan ikatan kovalen koordinasi.
Tinjauan ion amonium, NH4+. Ion ini dibuat dari amonia (NH3) dan ion hidrogen melalui ikatan kovalen koordinasi, mirip yang ditunjukkan berikut ini.
Pada ion amonium, sepasang elektron yang digunakan bersama antara atom nitrogen dan ion H+ berasal dari atom nitrogen. Jadi, dalam ion amonium terdapat ikatan kovalen koordinasi.
Jika ikatan kovalen dinyatakan dengan garis maka ikatan kovalen koordinasi dinyatakan dengan anak panah. Arah anak panah yaitu dari atom yang menyediakan pasangan elektron menuju atom yang menggunakan pasangan elektron tersebut. Perhatikan reaksi berikut.
Jika ikatan kovalen dinyatakan dengan garis maka ikatan kovalen koordinasi dinyatakan dengan anak panah. Arah anak panah yaitu dari atom yang menyediakan pasangan elektron menuju atom yang menggunakan pasangan elektron tersebut. Perhatikan reaksi berikut.
Contoh Soal Menentukan Ikatan Kovalen Koordinasi (4) :
Pada struktur senyawa SO3, manakah yang merupakan ikatan kovalen koordinasi ?
Pembahasan :
Konfigurasi elektron 16S : 2 8 6
Konfigurasi elektron 8O : 2 6
Untuk mencapai konfigurasi oktet, atom S kekurangan 2 elektron, demikian pula atom O. Salah satu atom O mengadakan saham 2 elektron dengan atom S membentuk ikatan rangkap dua. Oleh lantaran S dan O sudah mencapai oktet maka kedua atom O yang lain memakai pasangan elektron dari atom S untuk berikatan membentuk ikatan kovalen koordinasi. Dalam bentuk garis diungkapkan sebagai berikut.
D. Ikatan pada Logam
Logam dan bukan logam membentuk ikatan ion, bukan logam dan bukan logam membentuk ikatan kovalen. Ikatan apa yang terjadi jika atom logam dan atom logam berikatan? Atom logam dan atom logam membentuk kristal logam. Kristal logam yang Anda lihat sehari-hari, seperti logam besi, tembaga, dan aluminium mempunyai ikatan logam pada atom-atomnya.
Ikatan pada logam berbeda dengan ikatan kimia lainnya sebab elektron-elektron dalam kristal logam bergerak bebas. Berikut ini dipaparkan sifat-sifat fisik logam.
4.1. Teori Lautan Elektron
Terdapat beberapa teori yang mengambarkan ikatan pada logam, di antaranya yaitu teori lautan elektron dan teori pita. Khusus untuk teori pita tidak dibahas di sini lantaran memerlukan pengetahuan perihal ikatan kovalen dengan pendekatan teori Mekanika Kuantum.
Teori ikatan logam kali pertama dikembangkan oleh Drude (1902), kemudian diuraikan oleh Lorentz (1916) sehingga dikenal dengan teori elektron bebas atau teori lautan elektron dari Drude-Lorentz. Menurut teori ini, kristal logam tersusun atas kation-kation logam yang terpateri di tempat (tidak bergerak) dikelilingi oleh lautan elektron valensi yang bergerak bebas dalam kisi kristal (perhatikan Gambar 7). Ikatan logam terbentuk antara kation-kation logam dan elektron valensi.
 |
| Gambar 7. Kation-kation logam yang kaku dikelilingi lautan elektron valensi yang bergerak bebas. |
Apakah Anda percaya dan yakin bahwa teori ini sanggup diterima kebenaranya? Tentu Anda tidak akan percaya begitu saja jikalau tidak ada bukti. Suatu teori sanggup diterima jikalau teori itu bisa menjelaskan gejala atau fakta secara sederhana.
4.2. Sifat Mengkilap Logam
Fakta memperlihatkan bahwa logam mengkilap. Bagaimana teori di atas menjelaskan fakta ini?
Menurut teori Drude-Lorentz, jikalau cahaya tampak (visible) jatuh pada permukaan logam, sebagian elektron valensi logam akan tereksitasi. Ketika elektron yang tereksitasi itu kembali ke keadaan dasar akan disertai pembebasan energi dalam bentuk cahaya atau kilap. Peristiwa ini menimbulkan sifat mengkilap pada permukaan logam. Apakah penjelasan ini sanggup diterima?
4.3. Konduktor Listrik dan Panas
Semua logam bersifat konduktor (penghantar) listrik dan panas yang baik. Bagaimana teori tersebut menjelaskan fakta ini? Daya hantar listrik pada logam disebabkan oleh adanya elektron valensi yang bergerak bebas dalam kristal logam. Jika listrik dialirkan melalui logam, elektron-elektron valensi logam akan membawa muatan listrik ke seluruh logam dan bergerak menuju potensial yang lebih rendahsehingga terjadi aliran listrik dalam logam.
Jika sejumlah kalor (panas) diserap oleh logam, elektron-elektron valensi logam akan bergerak lebih cepat dan elektron-elektron tersebut membawa sejumlah kalor yang diserap. Akibatnya, kalor sanggup didistribusikan oleh logam ke seluruh kristal logam sehingga logam menjadi panas.
4.4. Lentur (Tidak Kaku)
Logam mempunyai sifat elastis (mudah ditempa, dibengkokkan, tetapi tidak gampang patah). Bagaimana fakta ini sanggup dijelaskan? Kisi-kisi kation bersifat kaku (tetap di tempat), sedangkan elektron valensi logam bergerak bebas. Jika logam ditempa atau dibengkokkan terjadi pergeseran kation-kation, tetapi pergeseran ini tidak menyebabkan patah lantaran selalu dikelilingi oleh lautan elektron (perhatikan Gambar 8).
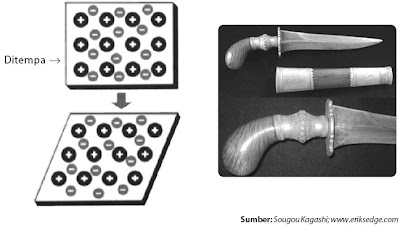 |
| Gambar 8. Kristal logam pada pisau jikalau ditempa tidak akan gampang patah. |
Pada ketika kristal NaCl ditekan, terjadi pergeseran kisi. Kisi-kisi kationakan bersinggungan dengan kisi-kisi kation lainnya sehingga terjadi tolakmenolak (perhatikan Gambar 9). Tolakan antarkisi ini menimbulkan perpecahan antarkisi, yang akhirnya kristal akan pecah menjadi serbuk.
E. Perbandingan Sifat Senyawa Ion dan Kovalen
 |
| Gambar 9. Kristal ion jikalau ditempa akan pecah. |
Oleh lantaran ikatan ion dan ikatan kovalen berbeda dalam proses pembentukannya maka senyawa yang dibentuknya juga mempunyai sifat-sifat fisika dan kimia yang berbeda. Berikut ini akan dibahas beberapa perbedaan sifat fisika senyawa ion dan senyawa kovalen, seperti kemudahan menguap (volatile), daya hantar listrik, dan kelarutan.
5.1. Kemudahan Menguap
Jika di dapur terdapat cuka (senyawa kovalen) dan garam dapur (senyawa ion), senyawa mana yang akan tercium baunya? Tentu yang tercium yaitu cuka. Mengapa garam dapur tidak tercium baunya?
Jika Anda mencicipi amis sesuatu, berarti ada gas atau uap dari suatu zat yang masuk ke hidung Anda. Uap tersebut tentu berasal dari zat yang ada di sekitar Anda. Jika suatu zat berwujud padat atau cair tercium baunya, berarti zat tersebut gampang menguap atau mempunyai titik didih relatif rendah pada tekanan normal. Pada masalah tersebut, cuka mudah menguap dibandingkan garam dapur. Titik didih cuka 119 °C dan garam dapur 1.517 °C. Kemudahan menguap dari suatu zat bekerjasama dengan gaya tarik antar molekul.
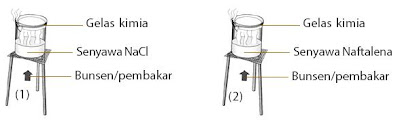
Praktikum Kimia Membandingkan Sifat Fisik (Kemudahan Menguap) Senyawa Ion dan Senyawa Kovalen (3) :
Tujuan :
Membandingkan akomodasi menguap garam dapur (senyawa ion) dan naftalena (senyawa kovalen) .
Alat :
Langkah Kerja :
Pertanyaan :
Praktikum Kimia Membandingkan Sifat Fisik (Kemudahan Menguap) Senyawa Ion dan Senyawa Kovalen (3) :
Tujuan :
Membandingkan akomodasi menguap garam dapur (senyawa ion) dan naftalena (senyawa kovalen) .
Alat :
- Cawan penguap
- Gelas kimia
- Bunsen
- NaCl (garam dapur)
- Naftalena
 |
| Struktur molekul naftalena |
- Siapkan wadah berisi air, kemudian masukkan NaCl ke dalam wadah 1 dan naftalena ke dalam wadah 2.
- Uapkan setiap senyawa NaCl dan naftalena pada wadah berisi air dengan waktu yang sama.
- Amati apa yang terjadi.
- Bandingkan zat mana yang lebih gampang menguap.
- Pindahkan kristal yang terbentuk ke cawan penguap.
Pertanyaan :
- Apa yang terjadi pada ketika beberapa usang mulai dilakukan pemanasan.
- Senyawa manakah yang lebih gampang menguap? Mengapa?
- Apa yang sanggup Anda simpulkan dari percobaan tersebut?
Gaya tarik antar molekul harus dibedakan dengan ikatan antar atom dalam molekul. Gaya tarik antar molekul yaitu antar agresi antar molekul yang berdampak pada wujud zat bersangkutan, sedangkan ikatan antar atom adalah antar agresi antara atom-atom yang membentuk molekul atau senyawa.
Gaya tarik antar molekul dalam senyawa kovalen relatif lemah dibandingkan senyawa ion. Akibatnya, senyawa kovalen pada umumnya mudah menguap dibandingkan senyawa ion, kecuali senyawa kovalen yang membentuk jaringan raksasa, mirip intan dan grafit.
Kemudahan menguap dari senyawa kovalen banyak dimanfaatkan sebagai parfum atau deodorant. Sejumlah kecil senyawa kovalen yang dicampurkan ke dalam produk komersial memperlihatkan amis yang harum. Gambar 10. memperlihatkan contoh-contoh produk komersial yang mengandung senyawa kovalen.
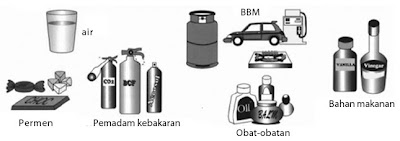 |
| Gambar 10. Produk-produk komersial yang mengandung senyawa kovalen. |
Logam sanggup menghantarkan arus listrik disebabkan oleh elektron-elektronnya bergerak bebas di seluruh kisi logam. Apakah senyawa ion dan senyawa kovalen sanggup menghantarkan arus listrik? Untuk dapat menjawab pertanyaan tersebut, Anda sanggup mempelajari kegiatan penyelidikan berikut.
Serbuk NaCl dimasukkan ke dalam cawan pijar dan dihubungkan dengan alat uji hantaran listrik. Berdasarkan penyelidikan, diperoleh data sebagai berikut.
- Dalam wujud padat, senyawa ion tidak sanggup menghantarkan listrik, tetapi dalam wujud cair (meleleh) sanggup menghantarkan arus listrik.
- Senyawa kovalen, baik dalam keadaan padat maupun cairan tidak dapat menghantarkan arus listrik. Mengapa terjadi tanda-tanda mirip itu?
Dalam bentuk padatan, senyawa ion membentuk kisi-kisi kristal yang kaku. Dalam hal ini, kation dan anion berantaraksi sangat berpengaruh satu dan lainnya sehingga tidak sanggup bergerak bebas. Oleh lantaran kation dan anion tidak sanggup bergerak melainkan hanya bergetar di tempat, jadinya tidak ada spesi yang sanggup menghantarkan arus listrik. Ketika senyawa ion dilelehkan, antaraksi antara kation dan anion melemah dan sanggup bergerak lebih leluasa. Akibatnya, jikalau arus listrik dilewatkan, ion-ion tersebut dapat menghantarkan arus listrik dari potensial tinggi ke potensial rendah.
Pada senyawa kovalen, baik bentuk padatan maupun cairannya bersifat netral. Artinya, tidak terjadi pemisahan atom-atom membentuk ion yang bermuatan listrik, melainkan tetap sebagai molekul kovalen. Oleh karena dalam senyawa kovalen tidak ada spesi yang bermuatan listrik maka arus listrik yang dikenakan pada senyawa kovalen tidak sanggup dialirkan.
5.3. Kelarutan
Bagaimana kelarutan senyawa kovalen dan senyawa ion di dalam pelarut tertentu? Untuk mengetahui kelarutan senyawa-senyawa itu, Anda sanggup mempelajari penyelidikan berikut. Setiap tiga macam zat terlarut, NaCl, naftalena, dan gula dimasukkan pada tiga macam pelarut, contohnya air, alkohol, dan benzena sehingga diperoleh 9 macam larutan.
Data hasil pengamatan
NaCl | C10H8 | Gula | |
Air | √ | √ | |
Alkohol | √ | ||
Benzena | √ |
Berdasarkan hasil penyelidikan diketahui bahwa:
- senyawa NaCl (senyawa ion) larut dalam pelarut air, tetapi tidak larut dalam pelarut organik mirip alkohol dan benzena;
- naftalena larut dalam benzena, tetapi tidak larut dalam air maupun alkohol;
- gula pasir larut dalam air dan alkohol, tetapi tidak larut dalam pelarut benzena.
Apa yang sanggup Anda simpulkan perihal data tersebut? Bagaimana menjelaskan fakta tersebut? Pada umumnya, senyawa ion tidak larut dalam pelarut organik, tetapi larut dalam air walaupun ada juga yang kurang bahkan tidak larut dalam air. Beberapa senyawa ion yang larut dan tidak larut dalam air ditunjukkan pada Tabel 4.
Tabel 4. Aturan Empirik Kelarutan Senyawa Ionik dalam Air
Kation | Anion | Kelarutan dalam Air | Kecuali |
Na+, K+, NH4 + | CH3COO–, NO3 – | Larut | Pb2+, Ag+ |
F–, Cl–, Br–, I– | Hg+ | ||
SO4 2– | Ca2+, Sr2+, Ba2+ | ||
CO3 2–, PO4 3 | Tidak larut | Na+, K+, NH4 + | |
S2–, OH– | Na+, K+, Ca2+ |
Mengapa gula pasir (C12H22O11) larut dalam air dan alkohol, tetapi tidak larut dalam benzena, sedangkan naftalena larut dalam benzena, tetapi tidak larut dalam air maupun alkohol? Gula pasir dan naftalena, keduanya senyawa kovalen. Bedanya, gula pasir merupakan senyawa kovalen polar, sedangkan naftalena kovalen murni (nonpolar). Selain itu, air dan alkohol juga polar, sedangkan benzena nonpolar.
Berdasarkan uraian tersebut, sanggup disimpulkan bahwa pada umumnya senyawa kovalen polar akan larut dalam pelarut polar, sedangkan senyawa kovalen nonpolar akan larut dalam pelarut yang juga nonpolar. Alkohol yang bersifat kovalen polar akan larut dalam air yang juga bersifat polar dan alkohol tidak akan larut dalam pelarut benzena. Perbedaan utama antara senyawa ion dan senyawa kovalen dapat dilihat pada Tabel 5.
Tabel 5 Sifat-Sifat Fisika Senyawa Ion dan Senyawa Kovalen
No. | Sifat-sifat Fisika | Senyawa Ion | Senyawa Kovalen |
1 | Titik didih dan titik leleh | Tinggi | Rendah |
2 | Konduktivitas listrik | Sebagai konduktor dalam bentuk lelehan atau larutan dalam air | Bukan konduktor dalam setiap keadaan |
3 | Kelarutan dalam air | Umumnya larut | Senyawa kovalen polar |
4 | Kelarutan dalam pelarut polar | Tidak larut | Umumnya larut dalam air dan pelarut polar |
5 | Kelarutan dalam pelarut nonpolar | Tidak larut | Senyawa kovalen nonpolar umumnya larut |
Rangkuman :
- Konfigurasi elektron yang stabil terdiri atas delapan elektron pada kulit terluar (oktet) sebagaimana yang dimiliki oleh atom-atom gas mulia, kecuali helium (dua elektron).
- Menurut teori oktet, untuk mencapai keadaan stabil dari unsur-unsur sanggup terjadi melalui penerimaan atau pelepasan satu/lebih elektron atau melalui penggunaan bersama pasangan elektron untuk membentuk ikatan suatu senyawa.
- Lambang Lewis digunakan untuk menjelaskan ikatan kimia antara atom-atom. Rumus yang disusun menggunakan lambang Lewis dinamakan rumus Lewis atau rumus titik-elektron. Lambang tersebut berguna dalam mengambarkan ikatan kimia.
- Ikatan ion terbentuk akhir gaya elektrostatik antara ion-ion berlawanan muatan yang terjadi lantaran adanya serah terima elektron dari satu atom ke atom lain sebagai pasangannya.
- Menurut Lewis, ikatan kovalen yang terjadi pada atom yaitu dengan cara membentuk pasangan elektron yang disumbangkan oleh kedua atom dan menjadi milik bersama atom-atom yang berikatan.
- Pada umumnya, jumlah ikatan yang sanggup dibentuk oleh suatu atom sama dengan jumlah elektron yang tidak berpasangan berdasarkan hukum Lewis atau sama dengan delapan dikurangi nomor golongan.
- Ikatan kovalen rangkap melibatkan penggunaan bersama lebih dari sepasang elektron oleh dua atom yang berikatan. Terdapat ikatan kovalen rangkap dua dan ikatan kovalen rangkap tiga.
- Pada ikatan kovalen koordinasi, pasangan elektron yang digunakan bersama berasal dari salah satu atom yang berikatan.
- Ikatan pada logam diterangkan melalui teori lautan elektron atau teori elektron bebas. Menurut teori ini, dalam kristal logam, inti atom terpateri pada kisi-kisi atom, sedangkan elektron valensi bergerak bebas di seluruh kristal logam.
- Teori lautan elektron sanggup mengambarkan sifat kilap logam, daya hantar listrik, panas, dan sanggup ditempa.
Anda kini sudah mengetahui Ikatan Kimia. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Sunarya, Y. dan A. Setiabudi. 2009. Praktis dan Aktif Belajar Kimia 1 : Untuk Kelas X Sekolah Menengah Atas / Madrasah Aliyah. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 226.











No comments:
Post a Comment