fisika-dan-sifat-kimia-alkohol" target="_blank">Sifat Fisika dan Sifat Kimia Alkohol, Senyawa, Gugus Fungsi - Bagaimanakah sifat-sifat senyawa alkohol. Perhatikan uraian berikut ini.
a. Sifat Fisika Alkohol
1) Titik didih
Titik didih alkohol relatif tinggi. Hal ini merupakan akhir pribadi dari daya tarik intermolekuler yang kuat. Ingat bahwa titik didih ialah ukuran garang dari jumlah energi yang diharapkan untuk memisahkan suatu molekul cair dari molekul terdekatnya.
Jika molekul terdekatnya menempel pada molekul tersebut sebagai ikatan hidrogen, dibutuhkan energi yang cukup besar untuk memisahkan ikatan tersebut. Setelah itu molekul tersebut sanggup terlepas dari cairan menjadi gas. Perhatikan titik didih beberapa senyawa alkohol pada Tabel 1. berikut.
Tabel 1. Perbandingan Titik Didih dan Massa Molekul Relatif
| Rumus | Nama | Massa Molekul Relatif (Mr) | Titik didih (°C) |
| CH3–OH | metanol | 32 | 65 |
| CH3–CH2–OH | etanol | 46 | 78 |
| CH3–CH2–CH2–OH | propanol | 46 | 98 |
| CH3–CH2–CH2–CH2–OH | 1-butanol | 74 | 117 |
| | 2-metil propanol | 74 | 108 |
| | 2-butanol | 74 | 100 |
Berdasarkan data pada Tabel 1, apa yang sanggup disimpulkan perihal relasi antara massa molekul relatif dengan titik didih? Semakin besar massa molekul relatif alkohol maka titik didih makin tinggi. Titik didih alkohol bercabang lebih rendah daripada alkohol berantai lurus meskipun massa molekul relatifnya sama.
2) Kelarutan Alkohol
Kepolaran dan ikatan hidrogen merupakan faktor yang memilih besarnya kelarutan alkohol dan eter dalam air. Dalam membahas kelarutan, kita memakai prinsip like dissolves like yang berarti pelarut polar melarutkan zat terlarut polar dan pelarut nonpolar melarutkan zat terlarut nonpolar. Akan tetapi prinsip tersebut tidak berlaku untuk semua kasus. Semua alkohol ialah polar tetapi tidak semua alkohol sanggup larut dalam air.
Perhatikan kelarutan alkohol dalam air berikut ini.
Tabel 2. Kelarutan Alkohol dalam Air
| Nama | Rumus | Kelarutan (g/100 mL) |
| Metanol | CH3OH | tidak terhingga |
| Etanol | CH3CH2OH | tidak terhingga |
| 1-propanol | CH3CH2CH2OH | tidak terhingga |
| 1-butanol | CH3CH2CH2CH2OH | 8,3 |
| 1-pentanol | CH3CH2CH2CH2CH2OH | 2,6 |
Alkohol dengan massa molekul rendah larut dalam air. Kelarutan dalam air ini lebih disebabkan oleh ikatan hidrogen antara alkohol dan air. Dengan bertambahnya massa molekul relatif maka gaya-gaya Van der Waals antara bagian-bagian hidrokarbon dari alkohol menjadi lebih efektif menarik molekul-molekul alkohol satu sama lain. Oleh lantaran itu, semakin panjang rantai karbon semakin kecil kelarutannya dalam air.
b. Sifat Kimia Alkohol
1) Dehidrasi alkohol
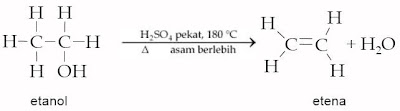
Dehidrasi (pelepasan air) merupakan reaksi yang melibatkan terlepasnya H dan OH. Reaksi kekurangan cairan tubuh alkohol sanggup membentuk alkena atau eter dan air. Asam sulfat pekat berlebih dicampurkan dalam alkohol lalu gabungan tersebut dipanaskan sampai 180 °C, maka gugus hidroksil akan terlepas dan atom hidrogen dari karbon terdekatnya juga terlepas, membentuk H2O.
Jika gabungan tersebut dipanaskan sampai 140 °C maka terbentuk etil eter.
| 2CH3CH2OH | H2SO4 pekat | CH3CH2–O–CH2CH3 + H2O |
| → | ||
| 140 °C | ||
| etanol | | etoksi etana |
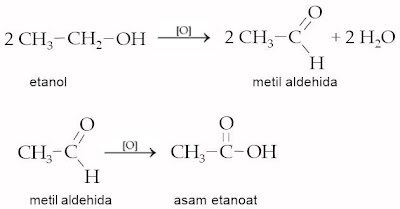
2) Oksidasi alkohol
Oksidasi alkohol akan menghasilkan senyawa yang berbeda, tergantung jenis alkoholnya. Perhatikan denah hasil oksidasi alkohol berikut.
| a. | alkohol primer | [O] | aldehida | [O] | asam karboksilat |
| → | → | ||||
| | Contoh : | ||||
| | | ||||
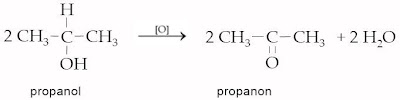
| b. | alkohol sekunder | [O] | keton | | |
| → | | | |||
| | Contoh : | ||||
| | | ||||
| c. | alkohol tersier sukar dioksidasi | ||||
3) Reaksi alkohol dengan logam Na atau K
Alkohol kering (tidak mengandung air) sanggup bereaksi dengan logam Na dan K tetapi tidak sereaktif air dengan logam Na ataupun K. Atom H dari gugus –OH digantikan dengan logam tersebut sehingga terbentuk Na-alkoholat.
| 2R–OH(s) | + | 2Na(s) | → | 2R–ONa(s) | + | H2(g) |
| alkohol | | | | natrium alkoholat | | |
Contoh :
| 2C2H5–OH(s) | + | 2Na(s) | → | 2C2H5–ONa(s) | + | H2(g) |
| etanol | | | | natrium etanolat | | |
Jika terdapat air maka alkoholat terurai kembali menjadi alkohol dan natrium hidroksida (NaOH).
C2H5–ONa(s) + H2O(l) → C2H5–OH(l) + NaOH(l)
4) Esterifikasi
Alkohol dengan asam alkanoat sanggup membentuk ester. Reaksi ini disebut dengan reaksi esterifikasi.
Contoh :
5) Reaksi dengan hidrogen halida
Alkohol direaksikan dengan hidrogen halida menghasilkan haloalkana dan air.
R–OH + HX → R–X + H2O
Contoh :
| CH3–CH2–OH | + | HCl | → | CH3–CH2–Cl | + | H2O |
| metanol | | | | etil klorida | | |
Anda kini sudah mengetahui Sifat Fisika dan Sifat Kimia Alkohol. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Sukmanawati, W. 2009. Kimia 3 : Untuk SMA/ MA Kelas XII. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 266.



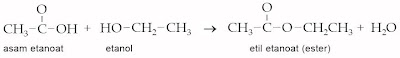
No comments:
Post a Comment