Persamaan Reaksi dan Rumus Kimia, Tata Nama, Senyawa, Contoh Soal - Kajian utama ilmu Kimia yaitu memahami perubahan materi atau reaksi kimia. Agar reaksi kimia gampang dipelajari, perlu dinyatakan dalam bentuk persamaan. Ungkapan reaksi kimia dalam bentuk persamaan disebut persamaan kimia atau reaksi kimia. Suatu persamaan kimia dinyatakan dengan rumus kimia yang ditulis dengan lambang unsurnya. Oleh lantaran itu, perlu diketahui lambang unsur dan tata nama dari suatu senyawa. Bagaimanakah cara memberi nama suatu senyawa kimia? Bagaimana pula cara menuliskan persamaan kimia? Pertanyaan tersebut sanggup Anda jawab jikalau Anda mempelajari uraian pada kepingan ini dengan baik.
A. Tata Nama Senyawa Kimia
Setiap hari selalu ditemukan senyawa baru, baik hasil sintesis di laboratorium maupun hasil isolasi dari materi alam. Jika senyawa baru yang ditemukan sederhana, namanya diadaptasi dengan aturan, tetapi jika senyawa itu kompleks, biasanya didasarkan pada asal materi atau dihubungkan dengan sifat senyawanya. Penamaan senyawa diatur oleh IUPAC berdasarkan hasil akad para ilmuwan sedunia, bertujuan agar nama senyawa di seluruh negara sama.Terdapat dua kelompok besar senyawa, yaitu senyawa anorganik dan senyawa organik.
1. Tata Nama Senyawa Anorganik
Senyawa anorganik yaitu golongan senyawa yang tersusun dari unsur-unsur yang tidak mengandung atom karbon organik. Umumnya senyawa anorganik relatif sederhana dan dikelompokkan ke dalam senyawa biner dan senyawa poliatom.
a. Tata Nama Senyawa Biner
Senyawa biner yaitu senyawa yang tersusun dari dua macam unsur. Penamaan senyawa ini didasarkan pada nama unsur pembentuknya yang ditulis secara berurutan sesuai penulisan rumus kimia (lambang senyawa) dan akhiran dari unsur keduanya diganti -ida.
Contoh:
Senyawa KCl tersusun dari unsur kalium dan klorin, namanya adalah kalium klorida. Senyawa Na2O tersusun dari unsur natrium dan oksigen, namanya yaitu natrium oksida.
Jika dua unsur sanggup membentuk lebih dari satu senyawa, seperti NO, NO2, dan N2O4 penambahan kata 'ida' tidak cukup alasannya yaitu akan muncul senyawa dengan nama yang sama. Untuk kasus ini, nama senyawa ditambah dengan kata mono-(satu), di-(dua), tri-(tiga), atau tetra-(empat) yang menawarkan jumlah unsur.
Contoh :
NO = nitrogen monoksida
NO2 = nitrogen dioksida
N2O4 = dinitrogen tetraoksida atau nitrogen tetraoksida
Contoh Soal Tata Nama Senyawa Biner (1) :
Tuliskan nama senyawa berikut.
a. P2O3
b. P2O5
c. P4O10
Jawaban :
Oleh lantaran ada tiga senyawa yang tersusun atas unsur yang sama maka nama senyawanya ditambahkan kata depan yang sesuai dengan bilangan unsur penyusun senyawa itu.
a. Difosfor trioksida
b. Difosfor pentoksida
c. Tetrafosfor dekoksida
Kata depan di- dan tetra- boleh tidak digunakan alasannya yaitu tidak menimbulkan nama sama. Jadi, untuk ketiga nama senyawa itu sanggup di tulis:
a. Fosfor trioksida
b. Fosfor pentoksida
c. Fosfor dekoksida
b. Tata Nama Senyawa Poliatom
Senyawa yang tersusun lebih dari dua unsur digolongkan sebagai senyawa poliatom, seperti Ca(ClO)2 atau kaporit, NaCO3 (soda kue), dan H2SO4 (asam sulfat). Senyawa poliatom umumnya mengandung oksigen. Tata nama senyawa poliatom yang mengandung oksigen didasarkan pada jumlah atom oksigen yang dikandungnya. Senyawa yang mengandung jumlah oksigen paling banyak diberi akhiran -at, sedangkan yang paling sedikit diberi akhiran -it.
Contoh :
Na2SO4 (natrium sulfat), Na2SO3 (natrium sulfit), KClO3 (kalium klorat), KClO2 (kalium klorit).
Tata nama senyawa tersebut tidak memadai sesudah ditemukan senyawa yang mengandung atom oksigen lebih banyak atau lebih sedikit dari senyawa tersebut. Untuk itu, senyawa yang mengandung atom oksigen lebih banyak lagi diberi awalan per-, sedangkan senyawa yang lebih sedikit dari rujukan senyawa di atas diberi awalan hipo-.
Contoh :
KClO4 dinamakan kalium perklorat
KClO3 dinamakan kalium klorat
KClO2 dinamakan kalium klorit
KClO dinamakan kalium hipoklorit
Terdapat nama senyawa yang tidak mengikuti aturan IUPAC disebabkan namanya sudah umum (trivial). Beberapa rujukan nama trivial senyawa disajikan pada Tabel 1.
Tabel 1. Beberapa Nama Senyawa Secara Trivial
NH3 | amonia | KAl(SO4)2 | tawas |
H2O | air | Hg2Cl2 | kalomel |
FeS | ferit | N2H4 | hidrazin |
Catatan :
Urutan nama senyawa biner :
Lima (penta-)
Enam (heksa)
Tujuh (hepta-)
Delapan (okta-)
Sembilan (nona-)
Sepuluh (deka-)
2. Tata Nama Senyawa Organik
Senyawa organik yaitu senyawa yang mengandung atom karbon, kecuali CO, CO2, CN, dan ion CO3 2– tergolong senyawa anorganik. Senyawa organik diklasifikasikan ke dalam senyawa hidrokarbon dan turunan hidrokarbon. Senyawa hidrokarbon yaitu senyawa yang hanya terdiri atas atom karbon dan hidrogen. Senyawa hidrokarbon digolongkan ke dalam alkana, alkena, dan alkuna.
Catatan :
Dalam senyawa organik, atom karbon dapat mengikat atom karbon yang lain membentuk rantai sangat panjang atau bercabang, seperti:
CH3 = CH2 = CH2 = CH2 = CH2 = CH3
Atau,
Alkana yaitu senyawa hidrokarbon yang mengandung ikatan kovalen tunggal di antara atom-atom karbonnya. Alkena mengandung ikatan kovalen rangkap dua karbon-karbon, sedangkan alkuna mengandung ikatan kovalen rangkap tiga karbon-karbon (perhatikan Gambar 1).
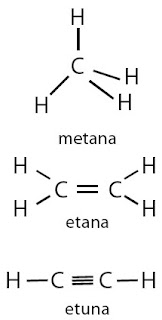 |
| Gambar 1. Struktur molekul senyawa hidrokarbon: alkana, alkena, dan alkuna. |
Senyawa alkana paling sederhana yaitu metana (CH4), etana (C2H6), propana (C3H8), dan butana (C4H10). Keempat nama senyawa ini sudah dikenal umum (trivial). Senyawa alkana lain dengan jumlah atom karbon lebih tinggi dari keempat alkana itu diberi nama berdasarkan aturan IUPAC dengan menambahkan akhiran -ana.
Contoh:
C5H12 dinamakan pentana (penta: lima)
C6H12 dinamakan heksana (heksa: enam)
C7H14 dinamakan heptana (hepta: tujuh)
b. Tata Nama Alkena dan Alkuna
Tata nama senyawa golongan alkena sama ibarat pada alkana, hanya akhiran -ana diganti dengan -ena.
Contoh :
C2H4 dinamakan etena
C3H6 dinamakan propena
Tata nama senyawa golongan alkuna juga tidak berbeda dengan alkana atau alkena, tetapi akhirannya menjadi -una.
Contoh :
C2H2 dinamakan etuna
C3H4 dinamakan propuna
Untuk tata nama senyawa yang mengandung atom karbon lebih banyak ibarat alkena dan alkuna, perlu diketahui posisi ikatan rangkapnya. Posisi ikatan rangkap dalam alkena dan alkuna yaitu pada atom karbon dengan nomor urut terkecil.
Contoh :
1. CH3=CH–CH2–CH2–CH3 dinamakan 1-pentena
2. CH3–CH2–CH=CH–CH2–CH3 dinamakan 3-heksena
3. CH≡ C–CH2–CH2–CH2–CH3 dinamakan 1-heksuna
4. CH3–C ≡ C–CH2–CH2–CH2–CH3 dinamakan 2-heptuna Catatan :
Dalam senyawa organik, atom karbon dapat mengikat atom karbon yang lain membentuk rantai sangat panjang atau bercabang, seperti:
Contoh Soal Tata Nama Senyawa Organik (2) :
Tuliskan nama senyawa organik berikut.
a. CH3–CH2–CH2–CH2–CH=CH2
b. CH3–C ≡ C–CH2–CH2–CH2–CH2–CH2–CH2–CH3Pembahasan :
Kedudukan ikatan rangkap dalam alkena dan alkuna diposisikan pada nomor urut terkecil. Pada soal (a) mempunyai ikatan rangkap dua sehingga senyawanya tergolong alkena. Pada soal (b) mempunyai ikatan rangkap tiga (suatu alkuna). Jumlah atom karbon pada (a) sebanyak 6 (heksa-) dan pada (b) sebanyak 10 (deka). Jadi, nama senyawa itu adalah
a. 1-heksena
b. 2-dekuna
B. Rumus Kimia
Pada pembahasan sebelumnya, semua senyawa dituliskan menggunakan lambang yang menawarkan jenis dan komposisi unsur penyusunnya. Lambang senyawa ibarat itu dinamakan rumus kimia atau formula.
Rumus kimia didefinisikan sebagai rumus suatu zat yang menggunakan lambang dan jumlah atom-atom unsur penyusun senyawa. Dalam rumus kimia, bilangan yang menyatakan jumlah unsur ditulis dalam bentuk indeks bawah (tikalas) sesudah lambang unsurnya.
1. Rumus Empirik dan Rumus Molekul
Untuk memilih rumus molekul suatu senyawa dilakukan dalam dua tahap. Tahap pertama, memilih unsur-unsur yang terkandung dalam senyawa dan komposisinya. Temuan yang diperoleh dinamakan rumus empirik. Tahap kedua, memilih massa molekul relatifnya.
Rumus empirik yaitu rumus paling sederhana dari suatu molekul, yang hanya menawarkan jenis dan perbandingan terkecil dari unsur yang menyusun senyawa itu.
Contoh :
Rumus empirik etena adalah CH2. Rumus sebetulnya dari etena adalah C2H4.
Rumus empirik amonia adalah NH3. Rumus sebetulnya dari amonia juga NH3.
Untuk senyawa berupa molekul(molekuler), penting diketahui berapa jumlah atom sebetulnya yang terdapat dalam setiap molekul. Hal ini dapat diketahui sesudah massa molekul relatif dari molekul ditentukan.
2. Massa Molekul Relatif
Apa yang dimaksud dengan massa molekul relatif? Massa molekul relatif ditentukan di laboratorium dengan aneka macam metode atau dapat juga dihitung dari massa atom relatif jikalau jumlah dan jenis unsurnya diketahui. Massa molekul relatif disingkat dengan Mr. Tinjau molekul amonia dengan rumus molekul NH3 . Dalam molekul ini terkandung satu atom nitrogen dan tiga atom hidrogen. Jika Ar N = 14 sma dan Ar H = 1 sma maka rumus molekul relatif NH3 = 17 sma atau Mr NH3 = 17 sma.
Contoh Soal Menentukan Massa Molekul Relatif (3) :
Berapakah massa molekul relatif: CH4, H2O, C2H4 ?
Diketahui Ar C = 12; H = 1; O = 16
Penyelesaian :
Massa molekul relatif yaitu jumlah massa atom relatif unsur-unsur penyusun molekul.
Dalam CH4 terdapat 1 atom C dan 4 atom H.
Mr CH4 = Ar C + 4. Ar H
Mr CH4 = 12 + 4 = 16
Mr H2O = 2. Ar H + Ar O
Mr H2O = 2 + 16 = 18
Mr C2H4 = 2. Ar C + 4 Ar H
Mr H2O = 24 + 4 = 28
Contoh Soal Menentukan Rumus Molekul (4) :
Pada hasil penelitian diketahui bahwa suatu molekul mempunyai rumus empirik CH. Jika Mr zat itu 26, tentukan rumus molekulnya.
Jawaban :
Rumus molekul (RM) yaitu kelipatan dari rumus empirik (RE) atau RM = (RE)n
Mr = (Ar C + Ar H)n = (12 + 1)n =26
n = 2
Jadi, rumus molekulnya adalah C2H2.
Contoh Soal Ebtanas: 1995–1996 :
Dari tabel kation dan anion di bawah ini;
rumus senyawa yang benar yaitu ....
Pembahasan :
A. Seharusnya: K2CO3
B. Seharusnya: Na3PO4
C. Seharusnya: BaCO3
D. Seharusnya: NaCl
E. Sudah benar: Fe2(SO4)3
3. Rumus Senyawa Ion
Dari tabel kation dan anion di bawah ini;
| Kation | Anion |
| K+ Na+ Ba2+ Fe3+ | Cl– SO4 2– PO4 3– CO3 2– |
rumus senyawa yang benar yaitu ....
A. KCO3
B. NaPO4
C. Ba(CO3)2
D. NaCl2
E. Fe2(SO4)3Pembahasan :
A. Seharusnya: K2CO3
B. Seharusnya: Na3PO4
C. Seharusnya: BaCO3
D. Seharusnya: NaCl
E. Sudah benar: Fe2(SO4)3
3. Rumus Senyawa Ion
Senyawa ion dibuat melalui serah-terima elektron menghasilkan kation dan anion. Dalam senyawa ion, jumlah muatan kation harus sama dengan muatan anion biar dihasilkan senyawa netral secara listrik. Tinjau senyawa NaCl. Ion Na+ memiliki muatan positif satu dan ion Cl– memiliki muatan negatif satu sehingga rumus kimianya NaCl.
 |
| Gambar 2.(a) Struktur molekul CH4 atau senyawa molekuler (b) Struktur kristal NaCl atau senyawa ion. |
dari natrium sulfat adalah Na2SO4. Dalam Al2(SO4)3 ion aluminium bermuatan 3+ (Al3+) dan ion sulfat bermuatan 2– (SO4 2–) Agar senyawa yang terbentuk netral maka ion aluminium dikalikan muatan ion sulfat dan sebaliknya sehingga rumus kimianya adalah Al2(SO4)3 Untuk memilih rumus kimia dari ionion perlu diperhatikan hal-hal berikut.
a. Tuliskan nama senyawa ionnya.
b. Tuliskan ion-ion yang terlibat.
c. Setarakan muatan positif dan negatif.
d. Tuliskan rumus kimia tanpa muatan.
Tabel 2. Muatan Total Ion dalam Senyawa
Ion dan senyawa | Na+ Na+ | CO3 2– | Na2CO3 |
Muatan Total | 2+ | 2– | 0 |
Ion dan senyawa | Al3+ Al3+ | SO4 2– SO4 2– SO4 2– | Al2(SO4)3 |
Muatan Total | 6+ | 6– | 0 |
Pada Tabel 3. disajikan beberapa rumus kimia dari senyawa ion beserta nama dan muatan ionnya.
Tabel 3. Rumus Kimia Senyawa Ion
Nama Senyawa | Ion | Rumus Kimia | |
Positif | Negatif | ||
Natrium hidroksida | Na+ | OH – | NaOH |
Kalium nitrat | K+ | NO3 – | KNO3 |
Amonium sulfat | NH4 + | SO4 2– | (NH4)2SO4 |
Kalsium karbonat | Ca2+ | CO3 2– | CaCO3 |
Kalsium bikarbonat | Ca2+ | HCO3 – | Ca(HCO3)2 |
Magnesium klorida | Mg2+ | Cl– | MgCl2 |
Contoh Soal Menuliskan Rumus Kimia dari Senyawa Ion (5) :
a. Logam magnesium dicelupkan ke dalam asam sulfat sampai terbentuk magnesium sulfat. Tuliskan rumus kimianya.
b. Na3PO4 adalah senyawa ion yang banyak digunakan sebagai pupuk. Ion-ion apa yang menyusun senyawa itu? Tuliskan nama senyawanya.
Jawaban :
a. Magnesium sulfat yaitu senyawa ion, terdiri atas ion Mg2+ dan ion SO4 2– . Kedua ion muatannya sama. Jadi, rumus kimianya MgSO4.
b. Na3PO4 tersusun atas ion Na+ dan ion PO4 3– maka nama senyawa ion tersebut adalah natrium fosfat.
Senyawa ion berbeda dengan senyawa molekuler. Umumnya senyawa molekuler berupa molekul sebagaimana tersirat dalam rumus kimianya. Adapun senyawa ion membentuk struktur kristal yang sangat besar, tersusun dari kation dan anion secara bergantian. Bagaimana menentukan massa molekul relatif dari senyawa ion? Menentukan massa molekul relatif senyawa ion diambil dari rumus empiriknya.
Contoh :
Walaupun kristal NaCl tersusun dari jutaan ion Na+ dan Cl–, massa molekul relatifnya ditentukan dari satuan rumusnya, yaitu NaCl. Jadi, massa rumus relatif NaCl = Ar Na + Ar Cl = 58,5 sma.
C. Persamaan Kimia
Kajian utama dalam ilmu Kimia yaitu mempelajari perubahan materi atau reaksi kimia. Agar reaksi kimia yang terjadi gampang dikomunikasikan, digunakan lambang dan zat-zat yang terlibat dalam reaksi kimia yang dinyatakan dalam bentuk persamaan kimia atau persamaan reaksi.
1. Persamaan Reaksi
Persamaan reaksi didefinisikan sebagai persamaan yang menyatakan kesetaraan jumlah zat-zat yang terlibat dalam reaksi kimia dengan menggunakan rumus kimia. Dalam reaksi kimia terdapat zat-zat pereaksi dan zat-zat hasil reaksi. Dalam menuliskan persamaan reaksi, rumus kimia pereaksi dituliskan di ruas kiri dan rumus kimia hasil reaksi dituliskan di ruas kanan. Antara kedua ruas itu dihubungkan dengan anak panah ( → ) yang menyatakan arah reaksi kimia.
Contoh :
Logam magnesium bereaksi dengan gas klorin membentuk magnesium klorida. Tuliskan persamaan reaksinya.
Persamaan reaksinya yaitu Mg + Cl2 → MgCl2
2. Menyetarakan Persamaan Reaksi
Tinjau reaksi antara logam natrium dan gas klorin. Berdasarkan percobaan, dalam reaksi tersebut dihasilkan natrium klorida dengan rumus kimia NaCl. Bagaimana persamaan reaksinya?
Penulisan persamaan reaksi harus tunduk pada hukum-hukum dasar :
• Hukum kekekalan massa (jumlah zat)
• Hukum perbandingan tetap (rumus kimia)
• Sifat-sifat listrik (muatan)
Suatu persamaan reaksi dikatakan benar jikalau memenuhi aturan kimia, yaitu zat-zat yang terlibat dalam reaksi harus setara, baik jumlah zat maupun muatannya. Sebelum menuliskan persamaan reaksi yang benar, tuliskan dulu persamaan kerangkanya. Persamaan kerangka untuk reaksi ini adalah
Na + Cl2 → NaCl
Apakah persamaan sudah setara jumlah atomnya? Persamaan tersebut belum setara alasannya yaitu pada hasil reaksi ada satu atom klorin, sedangkan pada pereaksi ada dua atom klorin dalam bentuk molekul Cl2. Untuk menyetarakan persamaan reaksi, manakah cara berikut yang benar?
a. Mengubah pereaksi menjadi atom klorin, persamaan menjadi:
Na + Cl → NaCI
b. Mengubah hasil reaksi menjadi NaCl2 , dan persamaan menjadi:
Na + Cl2 → NaCl2
Kedua persamaan tampak setara, tetapi kedua cara tersebut tidak benar, sebab mengubah fakta hasil percobaan.
Gas klorin yang direaksikan berupa molekul diatom sehingga harus tetap sebagai molekul diatom. Demikian pula hasil reaksinya berupa NaCl bukan NaCl2. Jadi, kedua persamaan reaksi tersebut tidak sesuai Hukum Perbandingan Tetap.
Cara yang benar untuk menyetarakan persamaan reaksi yaitu dengan menambahkan bilangan di depan setiap rumus kimia dengan angka yang sesuai. Bilangan yang ditambahkan ini dinamakan koefisien reaksi. Jadi, cara yang benar untuk menyetarakan persamaan reaksi yaitu dengan cara memilih nilai koefisien reaksi. Adapun langkah-langkahnya adalah sebagai berikut.
a. Oleh lantaran ada dua atom Cl yang bereaksi maka bubuhkan angka 2 di depan NaCl. Persamaan kerangka menjadi:
Na + Cl2 → 2NaCl
b. Jumlah atom Cl di sebelah kiri dan kanan persamaan sudah setara (ruas kiri dan kanan mengandung 2 atom Cl).
c. Di ruas kanan jumlah atom Na menjadi 2, sedangkan ruas kiri hanya 1 atom. Untuk menyetarakannya, tambahkan angka 2 di depan lambang unsur Na sehingga persamaan menjadi:
2Na + Cl2 → 2NaCl
Dengan cara ibarat itu, jumlah atom di ruas kiri sama dengan di ruas kanan. Dengan demikian, persamaan reaksi sudah setara.
Catatan :
Penulisan persamaan reaksi harus tunduk pada hukum-hukum dasar:
• Hukum kekekalan massa (jumlah zat)
• Hukum perbandingan tetap (rumus kimia)
• Sifat-sifat listrik (muatan)
Sekilas Kimia
Antoine Lavoisier
(1743–1794)
Lavoisier, mengemukakan prinsip kekekalan materi pada 1789. Lavoisier yaitu orang pertama yang menawarkan prinsip ini secara giat.
Persamaan reaksi tersebut belum lengkap alasannya yaitu belum mencantumkan wujud atau fasa zat yang terlibat dalam reaksi kimia. Menurut aturan IUPAC, penulisan fasa atau wujud zat dalam persamaan reaksi sejajar dengan rumus kimianya. Adapun aturan usang fasa dituliskan sebagai indeks bawah. Untuk melengkapinya, gunakan lambang-lambang berikut.
a. Tambahkan aksara (g), kependekan dari gas untuk zat berupa gas.
b. Tambahkan aksara (l), kependekan dari liquid untuk zat berupa cair.
c. Tambahkan aksara (s), kependekan dari solid untuk zat berupa padat.
d. Tambahkan aksara (aq), kependekan dari aqueous untuk zat berupa larutan.
Dengan demikian, persamaan reaksi tersebut sanggup ditulis secara lengkap menjadi:
2Na(s) + Cl2(g) → 2NaCl(s)
Berikut ini beberapa persamaan reaksi kimia yang sudah setara dan lengkap.
Persamaan Reaksi :
Na2O(s) + SO3(g ) → Na2SO4(s)
NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l)
CaCO3(s) + 2HCl(aq) → CaCl2(aq) + H2O(l) + CO2(g)
NaHCO3(s) + HCl(aq) → NaCl(aq) + H2O(l) + CO2(g) Contoh Soal Menyetarakan Persamaan Reaksi Sederhana (6) :
Gas nitrogen bereaksi dengan gas oksigen menjadi gas dinitrogen tetroksida. Tuliskan persamaan reaksinya.
Penyelesaian :
Langkah I : tuliskan persamaan kerangkanya.
N2 + O2 → N2O4
Langkah II: setarakan persamaan kerangka dengan memilih koefisien reaksinya.
Atom | Ruas Kiri | Ruas Kanan | Penyetaraan |
O | 2 | 4 | Ruas kiri × 2 |
N | 2 | 2 | – |
Persamaan reaksinya menjadi : N2 + 2O2 → N2O4
Periksa apakah jumlah atom pada kedua ruas sama. Jika sudah setara, lengkapi fasanya.
N2(g) + 2O2(g) → N2O4(g)
Contoh soal Menyetarakan Persamaan Reaksi Agak Rumit (7) :
Gas butana, C4H10 digunakan sebagai materi bakar untuk kompor gas. Tuliskan persamaan reaksi pembakarannya.
Pembahasan :
Pembakaran artinya mereaksikan zat dengan gas oksigen. Jika pembakaran sempurna akan terbentuk gas karbon dioksida dan uap air.
Persamaan kerangkanya:
C4H10 + O2 → CO2 + H2O
Setarakan dulu atom yang tidak sering muncul. Dalam hal ini yaitu C atau H sehingga sanggup disetarakan bersamaan.
Jika C dan H sudah setara, selanjutnya yaitu menyetarakan atom O yang sering muncul.
C : C4H10 + O2 → 4CO2 + H2O
Penyetaraan H : C4H10 + O2 → 4CO2 + 5H2O
Penyetaraan O : C4H10 + 13/2 O2 → 4CO2 + 5H2O
Untuk menyatakan persamaan reaksi, koefisien harus bilangan bundar (kecuali untuk perhitungan).
Jadi, persamaan reaksi pembakaran gas butana:
2C4H10(g) + 13O2(g) → 8CO2(g) + 10H2O(g)
Periksa apakah persamaan sudah setara?
Atom | Ruas Kiri | Ruas Kanan |
C | 8 | 8 |
H | 20 | 20 |
O | 26 | 16 + 10 |
Jadi, persamaan di atas sudah setara.
Contoh soal Ebtanas 2000 :
Pada reaksi:
a Cl2 + b NaOH → c NaCl + d NaClO + e H2O
Harga a, b, c, d, dan e berturut-turut yaitu ....
A. 1, 2, 2, 5, 6
B. 3, 3, 1, 5, 6
C. 1, 2, 1, 1, 1
D. 3, 1, 3, 5, 6
E. 3, 5, 3, 1, 6
Pembahasan :
Setarakan dulu atom yang tidak sering muncul, yaitu H. Kemudian, menyetarakan atom Na, O, dan Cl yang sering muncul.
Penyetaraan H :
Cl2 + 2NaOH → NaCl + NaClO + H2O
Perhatikan jumlah atom pada kedua ruas sama.
Semua atom yang terlibat dalam persamaan reaksi di atas sudah setara sehingga tidak perlu lagi merubah koefisien reaksi atom lain. Jadi, persamaan reaksinya:
Cl2 + 2NaOH → NaCl + NaClO + H2O
Harga a, b, c, d, dan e berturut-turut yaitu 1, 2, 1, 1, 1 (C)
Contoh soal Ebtanas 2000 :
Pada reaksi:
a Cl2 + b NaOH → c NaCl + d NaClO + e H2O
Harga a, b, c, d, dan e berturut-turut yaitu ....
A. 1, 2, 2, 5, 6
B. 3, 3, 1, 5, 6
C. 1, 2, 1, 1, 1
D. 3, 1, 3, 5, 6
E. 3, 5, 3, 1, 6
Pembahasan :
Setarakan dulu atom yang tidak sering muncul, yaitu H. Kemudian, menyetarakan atom Na, O, dan Cl yang sering muncul.
Penyetaraan H :
Cl2 + 2NaOH → NaCl + NaClO + H2O
Perhatikan jumlah atom pada kedua ruas sama.
| Atom | Ruas Kiri | Ruas Kanan |
| Na | 2 | 1 + 1 |
| H | 2 | 2 |
| O | 2 | 1 + 1 |
| Cl | 2 | 1 + 1 |
Semua atom yang terlibat dalam persamaan reaksi di atas sudah setara sehingga tidak perlu lagi merubah koefisien reaksi atom lain. Jadi, persamaan reaksinya:
Cl2 + 2NaOH → NaCl + NaClO + H2O
Harga a, b, c, d, dan e berturut-turut yaitu 1, 2, 1, 1, 1 (C)
3. Contoh-Contoh Reaksi
a. Reaksi Penguraian
Reaksi penguraian yaitu suatu reaksi senyawa tunggal terurai menjadi dua atau lebih zat yang baru.
Contoh:
Jika amonium klorida dipanaskan maka akan terurai menjadi amonia dan asam klorida. Persamaan reaksinya:
NH4Cl(s) → NH3(g) + HCl(g)
b. Reaksi Penggabungan
Reaksi penggabungan yaitu reaksi dimana dua buah zat atau lebih bergabung membentuk satu jenis zat yang baru.
Contoh :
Di atmosfir gas nitrogen dan gas hidrogen sanggup bereaksi membentuk amonia dengan sumbangan petir. Persamaan reaksinya:
N2(g) + 3H2(g) → 2NH3(g)
c. Reaksi Pendesakan
Reaksi pendesakan atau disebut juga reaksi pertukaran tunggal adalah reaksi dimana suatu unsur menggantikan posisi unsur lain dalam suatu senyawa.
Contoh :
Jika logam seng dicelupkan ke dalam larutan tembaga (II) sulfat akan menggantikan posisi tembaga. Persamaan reaksinya:
Zn(s) + CuSO4(aq) → Cu(s) + ZnSO4(aq)
d. Reaksi Metatesis
Reaksi metatesis atau reaksi pertukaran ganda yaitu reaksi kimia yang melibatkan pertukaran antar ion-ion dalam senyawa yang bereaksi.
Contoh :
Larutan natrium sulfat bereaksi dengan barium nitrat membentuk endapan putih dari barium sulfat. Persamaan reaksinya:
Na2SO4(aq) + Ba(NO3)2(aq) → 2NaNO3(aq) + BaSO4(s)
Contoh Soal Penggolongan Reaksi (8) :
Golongkan reaksi berikut berdasarkan jenisnya:
a. 2KClO3(s) → 2KCl(s) + 3O2(g)
b. 2Na(s) + H2SO4(g) → Na2SO4(aq) + H2(g)
c. 2NaI(aq) + Cl2(g) → 2NaCl(aq) + I2(aq)Jawaban :
a. Reaksi penguraian
b. Reaksi pendesakan
c. Reaksi metatesis
Pupuk Kimia
Pupuk nitrogen mengandung garam nitrat (NO3 –), garam amonium (NH4+) dan senyawa lainnya. Tanaman sanggup menyerap pribadi nitrogen dalam bentuk nitrat, tetapi garam amonium dan amonia (NH3) harus dikonversikan dulu menjadi nitrat melalui kerja kuman tanah. Bahan dasar pupuk nitrogen yaitu amonium yang dibuat dari reaksi penggabungan antara hidrogen dan nitrogen
3H2(g) + N2(g) → 2NH3(g)
Dalam bentuk cairnya, amonia sanggup terserap pribadi dalam tanah.
Pupuk Kimia
Pupuk nitrogen mengandung garam nitrat (NO3 –), garam amonium (NH4+) dan senyawa lainnya. Tanaman sanggup menyerap pribadi nitrogen dalam bentuk nitrat, tetapi garam amonium dan amonia (NH3) harus dikonversikan dulu menjadi nitrat melalui kerja kuman tanah. Bahan dasar pupuk nitrogen yaitu amonium yang dibuat dari reaksi penggabungan antara hidrogen dan nitrogen
3H2(g) + N2(g) → 2NH3(g)
Dalam bentuk cairnya, amonia sanggup terserap pribadi dalam tanah.
Rangkuman :
- Tata nama senyawa biner dilakukan dengan cara menuliskan nama kedua unsur pembentuknya secara berurutan sesuai dengan urutan penulisan pada rumus kimia, ditambah akhiran ‘ida’ pada nama unsur kedua.
- Tata nama senyawa poliatom yang mengandung oksigen didasarkan pada jumlah atom oksigen. Jumlah atom oksigen paling banyak diberi akhiran ‘at’, sedangkan yang sedikit diberi akhiran ‘it’.
- Tata nama senyawa organik didasarkan pada jumlah atom karbonnya dan diberi akhiran ‘ana’ untuk senyawa ikatan tunggal, ‘ena’ untuk senyawa berikatan rangkap dua, dan ‘una’ untuk senyawa rangkap tiga.
- Dalam Ilmu Kimia, semua senyawa dituliskan menggunakan rumus (formula) kimia. Rumus kimia adalah ungkapan suatu zat memakai lambanglambang unsur pembentuk senyawa dan perbandingan relatif atom-atom unsur yang menyusun senyawa itu.
- Rumus kimia senyawa berupa molekul menunjukkan rumus molekul senyawa bersangkutan, yakni rumus yang menggambarkan jumlah dan jenis atom unsur yang membentuk molekul senyawa itu.
- Rumus kimia paling sederhana yang ditemukan secara percobaan di laboratorium dinamakan rumus empiris. Rumus kimia sebetulnya merupakan kelipatan bilangan bundar dari rumus empirisnya.
- Rumus kimia senyawa ionik dinyatakan dengan satuan rumus, yaitu deretan atom atau ion yang dilambangkan secara eksplisit di dalam rumus kimianya.
- Untuk menyatakan reaksi kimia yang terjadi, zat-zat yang terlibat dalam reaksi ditulis dalam bentuk persamaan kimia. Persamaan kimia menyatakan kesetaraan jumlah zat-zat yang bereaksi dan jumlah zat-zat hasil reaksi. Penulisan zat tersebut menggunakan lambang unsur atau rumus kimia.
- Umumnya reaksi-reaksi kimia digolongkan menurut jenisnya, yaitu: (a) reaksi penggabungan; (b) reaksi penguraian; (c) reaksi pendesakan (reaksi pertukaran tunggal); dan (d) reaksi metatesis (reaksi pertukaran ganda).
Anda kini sudah mengetahui Persamaan Reaksi dan Rumus Kimia Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Sunarya, Y. dan A. Setiabudi. 2009. Praktis dan Aktif Belajar Kimia 1 : Untuk Kelas X Sekolah Menengah Atas / Madrasah Aliyah. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 226.


No comments:
Post a Comment