Sifat Koligatif Larutan Elektrolit dan Non Elektrolit, Contoh Soal, Pembahasan - Di alam bebas hampir tidak ditemukan zat cair murni 100 %. Hampir semua cairan yang ada di bumi berbentuk larutan atau campuran. Larutan merupakan adonan yang homogen, yaitu suatu adonan serba sama, antara zat terlarut (solute) dan zat pelarut (solvent), sehingga tidak sanggup dibedakan satu sama lain. Adanya zat terlarut di dalam pelarut menimbulkan perubahan sifat fisik pada pelarut dan larutan tersebut. Sifat fisik yang mengalami perubahan contohnya penurunan tekanan uap, penurunan titik didih, kenaikan titik didih, dan tekanan osmosis.
Ada banyak hal yang menimbulkan larutan mempunyai sifat yang berbeda dengan pelarutnya. Salah satu sifat terpenting dari larutan yaitu sifat koligatif larutan. Sifat koligatif didefinisikan sebagai sifat fisik larutan yang hanya ditentukan oleh jumlah partikel dalam larutan dan tidak tergantung jenis partikelnya.
Beberapa sifat koligatif yang akan dibicarakan dalam penggalan ini meliputi penurunan tekanan uap pelarut, penurunan titik beku larutan, kenaikan titik didih larutan, dan tekanan osmosis larutan. Misalnya kristal garam. Kristal garam diperoleh dari air laut yang diuapkan. Kristal garam tersebut, jika dilarutkan dalam air berubah menjadi partikel yang sangat kecil, sehingga garam dapat larut dalam air. Larutan garam merupakan campuran homogen.
Jumlah zat terlarut dalam suatu larutan dinyatakan dengan konsentrasi larutan. Konsentrasi menyatakan komposisi secara kuantitatif perbandingan zat terlarut dengan pelarut dan atau larutan. Ada beberapa cara untuk menyatakan secara kuantitatif komposisi tersebut, antara lain yaitu molaritas, molalitas, dan fraksi mol. Ketiganya akan menjadi dasar untuk mempelajari sifat koligatif larutan, sehingga ketiganya harus dipelajari terlebih dahulu.
A. Molalitas dan Fraksi Mol
Dalam larutan, terdapat beberapa sifat zat yang hanya ditentukan oleh banyaknya partikel zat terlarut. Sifat ini disebut sebagai sifat koligatif larutan. Oleh lantaran sifat koligatif larutan ditentukan oleh banyaknya partikel zat terlarut, penggalan ini akan diawali dengan pembahasan mengenai konsentrasi larutan.
1. Molalitas
Pada pelajaran sebelumnya, kita menyatakan konsentrasi dengan persentase (%) dan molaritas (M). Dalam perhitungan molaritas, kuantitas larutan didasarkan pada volume. Anda tentu ingat, volume merupakan fungsi suhu (zat akan memuai ketika dipanaskan). Oleh lantaran sifat koligatif larutan dipengaruhi suhu, diharapkan suatu besaran yang tidak bergantung pada suhu. Besaran tersebut dinyatakan berdasarkan massa lantaran massa tidak bergantung pada suhu, baik dari kuantitas zat terlarut maupun pelarutnya. Untuk itu, digunakan molalitas yang menyatakan jumlah partikel zat terlarut (mol) setiap 1 kg pelarut (bukan larutan). Larutan yang dibentuk dari 1 mol NaCl yang dilarutkan dalam 1.000 g air dinyatakan sebagai larutan 1 molal dan diberi lambang 1 m NaCl.
 |
| Gambar 1. Satuan konsentrasi molalitas memegang peranan penting dalam kegiatan di laboratorium |
Molalitas didefinisikan dengan persamaan berikut.
Molalitas (m) = 
atau,
m = 
Keterangan :
m = molalitas (mol/kg)
Mr = massa molar zat terlarut (g/mol)
massa = massa zat terlarut (g)
p = massa zat pelarut (g)
Molalitas juga berkhasiat pada keadaan lain, contohnya lantaran pelarut merupakan padatan pada suhu kamar dan hanya sanggup diukur massanya, bukan volumenya sehingga mustahil dinyatakan dalam bentuk molaritas. Perhatikanlah referensi soal penentuan molalitas berikut.
Contoh Soal Molalitas (1) :
Sebanyak 30 g urea (Mr = 60 g/mol) dilarutkan ke dalam 100 g air. Hitunglah molalitas larutan!
Pembahasan :
Mol urea = massa urea / Mr urea = 30 g / 60 g/mol = 0,5 mol
Massa pelarut = 100 g = 100 / 1.000 = 0,1 kg
Molalitas (m) = 0,5 mol / 0,1 kg = 5 m
Massa pelarut = 100 g = 100 / 1.000 = 0,1 kg
Molalitas (m) = 0,5 mol / 0,1 kg = 5 m
Jadi, molalitas larutan urea yaitu 5 m.
Contoh Soal Molalitas (2) :
Berapa gram NaCl yang harus dilarutkan dalam 500 g air untuk menghasilkan larutan 0,15 m?
Penyelesaian :
Molalitas artinya jumlah mol zat terlarut per kilogram pelarut. 0,15 m berarti 0,15 mol NaCl dalam 1 kg (1.000 g) air.
0,15 mol NaCl dalam 1.000 g H2O
Untuk menghitung jumlah mol NaCl yang diharapkan untuk 500 g H2O, kita dapat menggunakan korelasi tersebut sebagai faktor konversi. Kemudian, kita dapat menggunakan massa molar NaCl untuk mengubah mol NaCl menjadi massa NaCl.
500 g H2O x  = 4,38 g NaCl
= 4,38 g NaCl
Jadi, massa NaCl yang harus dilarutkan pada 500 g air untuk menghasilkan larutan 0,15 m yaitu 4,38 g.
Contoh Soal Molalitas (3) :
Molalitas suatu larutan 20% berat C2H5OH (Mr = 46 g/mol) adalah....
Jawaban :
C2H5OH 20% artinya 20 gram
C2H5OH dalam 80 gram air :
m =  =
=  = 5,4
= 5,4
Jadi, kemolalan larutan 20% berat C2H5OH adalah 5,4 m.
Contoh Soal Molalitas (4) :
Berapakah kemolalan dari larutan 10% (w/w) NaCl? (w/w = persen berat)
Penyelesaian :
Larutan 10% (w/w), artinya = 
w berasal dari kata weight.
Untuk mengetahui kemolalan, kita harus mengetahui jumlah mol NaCl. 10 g NaCl sanggup diubah menjadi mol dengan menggunakan massa molar NaCl (58,44 g/mol). Untuk mengetahui massa air, sanggup dilakukan dengan cara pengurangan 100 g larutan NaCl oleh 10 g NaCl.
massa air = 100 g – 10 g = 90 g
Untuk menentukan kemolalan, sanggup dilakukan konversi sebagai berikut.
Jadi, larutan 10% (w/w) NaCl mempunyai konsentrasi 1,9 m.
2. Fraksi Mol
2. Fraksi Mol
Fraksi mol merupakan satuan konsentrasi yang semua komponen larutannya dinyatakan berdasarkan mol. Fraksi mol komponen i, dilambangkan dengan xi adalah jumlah mol komponen i dibagi dengan jumlah mol semua komponen dalam larutan. Fraksi mol j adalah xj dan seterusnya. Jumlah fraksi mol dari semua komponen larutan yaitu 1.
xi = 
xj =
xj =
Total fraksi mol = xi + xj = 1
Perhatikanlah referensi soal penggunaan fraksi mol berikut.
Contoh Soal Fraksi mol (5) :
Larutan glukosa dibentuk dengan melarutkan 18 g glukosa (Mr = 180 g/mol) ke dalam 250 g air. Hitunglah fraksi mol glukosa.
Jawaban :
Jadi, fraksi mol glukosa yaitu 0,01.
Berapa fraksi mol dan persen mol setiap komponen dari adonan 0,2 mol O2 dan 0,5 mol N2?
Kunci Jawaban :
Fraksi mol N2 bisa juga dihitung dengan cara:
XN2 = 1 – XO2 = 1 – 0,29 = 0,71
% mol O2 = 0,29 × 100% = 29%
% mol N2 = 0,71 × 100% = 71%
Jadi, fraksi mol O2 adalah 0,29 dan fraksi mol N2 adalah 0,71, sedangkan persen mol O2 adalah 29% dan persen mol N2 adalah 71%.
Contoh Soal UMPTN 1998 (7) :
Fraksi mol suatu larutan metanol CH3OH dalam air yaitu 0,50. Konsentrasi metanol dalam larutan ini jikalau dinyatakan dalam persen berat yaitu ....
Kunci Jawaban :
mol metanol = mol air (misalkan 1 mol)
massa metanol = mol x Mr = 1 x 32 = 32
massa air = mol x Mr = 1 x 18 = 18
%w/w =  x 100 % =
x 100 % =  x 100 % = 64 %
x 100 % = 64 %
Jadi, konsentrasi metanol dalam larutan dalam persen berat yaitu 64 % (C)
Jadi, konsentrasi metanol dalam larutan dalam persen berat yaitu 64 % (C)
B. Sifat Koligatif Larutan Non Elektrolit
Meskipun sifat koligatif melibatkan larutan, sifat koligatif tidak bergantung pada interaksi antara molekul pelarut dan zat terlarut, tetapi bergantung pada jumlah zat terlarut yang larut pada suatu larutan. Sifat koligatif terdiri atas penurunan tekanan uap, kenaikan titik didih, penurunan titik beku, dan tekanan osmotik. Apakah perbedaan di antara keempat sifat koligatif tersebut? Perhatikanlah uraian berikut.
1. Penurunan Tekanan Uap
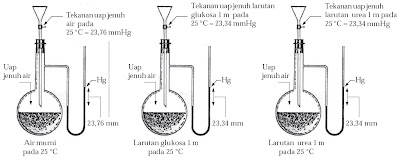
Untuk mengetahui imbas zat terlarut yang sukar menguap terhadap tekanan uap pelarut, lakukanlah kegiatan berikut.
Percobaan / Praktikum Penurunan Tekanan Uap (1) :
Tujuan :
Mengamati imbas zat terlarut terhadap tekanan uap jenuh larutan
Alat dan Bahan :
Data percobaan
Langkah Kerja :
1. Perhatikan gambar hasil eksperimen berikut.
2. Pada buku latihan Anda, isilah tabel berikut.
Jawablah pertanyaan berikut untuk menarik kesimpulan.
Penguapan yaitu kejadian yang terjadi ketika partikel-partikel zat cair meninggalkan kelompoknya. Semakin lemah gaya tarik-menarik antarmolekul zat cair, semakin gampang zat cair tersebut menguap. Semakin gampang zat cair menguap, semakin besar pula tekanan uap jenuhnya. Dalam suatu larutan, partikel-partikel zat terlarut menghalangi gerak molekul pelarut untuk berubah dari bentuk cair menjadi bentuk uap sehingga tekanan uap jenuh larutan menjadi lebih rendah dari tekanan uap jenuh larutan murni.
Percobaan / Praktikum Penurunan Tekanan Uap (1) :
Tujuan :
Mengamati imbas zat terlarut terhadap tekanan uap jenuh larutan
Alat dan Bahan :
Data percobaan
Langkah Kerja :
1. Perhatikan gambar hasil eksperimen berikut.
2. Pada buku latihan Anda, isilah tabel berikut.
Zat | Tekanan Uap Jenuh pada 25 oC (mmHg) |
Air | ... |
Larutan glukosa 1 m | ... |
Larutan urea 1 m | ... |
Jawablah pertanyaan berikut untuk menarik kesimpulan.
- Hitunglah selisih penurunan tekanan uap jenuh larutan glukosa dengan tekanan uap jenuh air.
- Hitunglah selisih penurunan tekanan uap jenuh urea dengan tekanan uap jenuh air.
- Mengapa selisihnya sama antara dua larutan dengan konsentrasi sama?
- Apabila larutan sukrosa 1 m diamati, akankah nilainya sama?
Penguapan yaitu kejadian yang terjadi ketika partikel-partikel zat cair meninggalkan kelompoknya. Semakin lemah gaya tarik-menarik antarmolekul zat cair, semakin gampang zat cair tersebut menguap. Semakin gampang zat cair menguap, semakin besar pula tekanan uap jenuhnya. Dalam suatu larutan, partikel-partikel zat terlarut menghalangi gerak molekul pelarut untuk berubah dari bentuk cair menjadi bentuk uap sehingga tekanan uap jenuh larutan menjadi lebih rendah dari tekanan uap jenuh larutan murni.
Dari eksperimen yang dilakukan Marie Francois Raoult (1878), didapatkan hasil bahwa melarutkan suatu zat terlarut menyebabkan penurunan tekanan uap larutan. Banyaknya penurunan tekanan uap (ΔP) terbukti sama dengan hasil kali fraksi mol zat terlarut ( ) dan tekanan uap pelarut murni (
) dan tekanan uap pelarut murni (  ), yaitu:
), yaitu:
Pada larutan yang terdiri atas dua komponen, pelarut A dan zat terlarut B,  maka
maka  . Apabila tekanan uap pelarut di atas larutan dilambangkan
. Apabila tekanan uap pelarut di atas larutan dilambangkan  ,
, 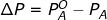 .
.
Persamaan akan menjadi:
Persamaan tersebut dikenal sebagai Hukum Raoult.
Tekanan uap pelarut ( ) sama dengan hasil kali tekanan uap pelarut murni (
) sama dengan hasil kali tekanan uap pelarut murni ( ) dengan fraksi mol pelarut dalam larutan (
) dengan fraksi mol pelarut dalam larutan ( ).
).
Apabila zat terlarut gampang menguap, sanggup pula ditulis:
Tekanan uap total sanggup ditulis:
Contoh Soal Penurunan Tekanan Uap (8) :
Hitunglah tekanan uap larutan 2 mol sukrosa dalam 50 mol air pada 300 °C jika tekanan uap air murni pada 300 °C yaitu 31,80 mmHg.
Pembahasan :
Fraksi mol sukrosa =  =
=  = 0,038
= 0,038
xB = 0,038
xA = 1 – 0,038 = 0,962
PA = xA . PAo = 0,962 × 31,8 mmHg = 30,59 mmHg
xB = 0,038
xA = 1 – 0,038 = 0,962
PA = xA . PAo = 0,962 × 31,8 mmHg = 30,59 mmHg
Jadi, tekanan uap larutan yaitu 30,59 mmHg.
Contoh Soal Penurunan Tekanan Uap (9) :
Berapakah tekanan uap parsial dan tekanan uap total pada suhu 25 °C di atas larutan dengan jumlah fraksi mol benzena (C6H6) sama dengan jumlah fraksi mol toluena (C7H8)? Tekanan uap benzena dan toluena pada suhu 25 °C berturut-turut adalah 95,1 mmHg dan 28,4 mmHg.
Kunci Jawaban :
Jika larutan terdiri atas dua komponen dengan jumlah fraksi mol yang sama, fraksi mol keduanya yaitu 0,5.
Tekanan uap parsial :
Pbenzena = xbenzena × Pbenzena = 0,5 × 95,1 mmHg = 47,6 mmHg
Ptoluena = xtoluena × Ptoluena = 0,5 × 28,4 mmHg = 14,2 mmHg
Tekanan uap total:
Ptotal = Pbenzena + Ptoluena = 47,6 + 14,2 = 61,8 mmHg
Jadi, tekanan uap parsial benzena dan toluena yaitu 47,6 mmHg dan 14,2 mmHg, sedangkan tekanan uap total yaitu 61,8 mmHg.
Contoh Soal UN 2002 (10) :
Sembilan gram zat nonelektrolit dan 360 g air dicampur, ternyata tekanan uap jenuhnya 40 mmHg. Jika tekanan uap jenuh air pada suhu yang sama yaitu 40,1 mmHg, Mr zat tersebut yaitu .....
A. 90 g/mol
B. 126 g/mol
C. 180 g/mol
D. 342 g/mol
E. 360 g/mol
Pembahasan :
Diketahui:
Zat nonelektrolit = 9 gram
pelarut air (p) = 360 gram
P° = 40,1 mmHg
P = 40 mmHg
Ditanyakan: Mr?
Jawaban:
P = xp x P°
40 = xp x 40,1 xP = 0,9975
np = 31/680 = 20 mol
xp =
0,9975 =
19,95 + 0.9975 nt = 20
0,9975 nt = 20 - 19,95
0,05 mol = massa / Mr → 0,05
0,05 mol = 9 g / Mr
Mr = 9 g / 0,05 mol = 180 g/mol
Jadi, massa molar relatif zat tersebut yaitu (C) 180 g/mol.
Contoh Soal UN 2002 (10) :
Sembilan gram zat nonelektrolit dan 360 g air dicampur, ternyata tekanan uap jenuhnya 40 mmHg. Jika tekanan uap jenuh air pada suhu yang sama yaitu 40,1 mmHg, Mr zat tersebut yaitu .....
A. 90 g/mol
B. 126 g/mol
C. 180 g/mol
D. 342 g/mol
E. 360 g/mol
Pembahasan :
Diketahui:
Zat nonelektrolit = 9 gram
pelarut air (p) = 360 gram
P° = 40,1 mmHg
P = 40 mmHg
Ditanyakan: Mr?
Jawaban:
P = xp x P°
40 = xp x 40,1 xP = 0,9975
np = 31/680 = 20 mol
xp =
0,9975 =
19,95 + 0.9975 nt = 20
0,9975 nt = 20 - 19,95
0,05 mol = massa / Mr → 0,05
0,05 mol = 9 g / Mr
Mr = 9 g / 0,05 mol = 180 g/mol
Jadi, massa molar relatif zat tersebut yaitu (C) 180 g/mol.
2. Kenaikan Titik Didih dan Penurunan Titik Beku
Adanya zat terlarut pada suatu larutan tidak hanya memengaruhi tekanan uap saja, tetapi juga memengaruhi titik didih dan titik beku. Pada larutan dengan pelarut air, kita sanggup memahami hal tersebut dengan mempelajari diagram fase air pada Gambar 2. berikut.
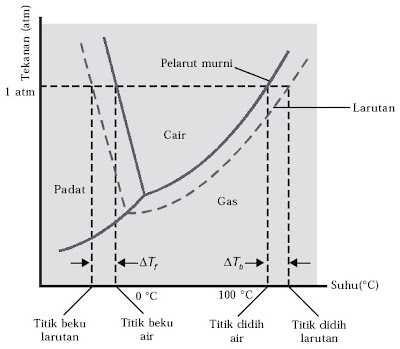 |
| Gambar 2. Diagram fase air |
Adanya zat terlarut pada suatu larutan menimbulkan penurunan tekanan uap yang menimbulkan terjadinya penurunan garis kesetimbangan antarfase sehingga terjadi kenaikan titik didih dan penurunan titik beku.
a. Kenaikan Titik Didih Air (∆Tb)
Titik didih zat cair yaitu suhu tetap pada ketika zat cair mendidih. Pada suhu ini, tekanan uap zat cair sama dengan tekanan udara di sekitarnya. Hal ini menimbulkan terjadinya penguapan di seluruh penggalan zat cair. Titik didih zat cair diukur pada tekanan 1 atmosfer. Contohnya, titik didih air 100 °C, artinya pada tekanan udara 1 atm air mendidih pada suhu 100 °C.
Dari hasil eksperimen yang dilakukan pada penentuan titik didih larutan, ternyata titik didih larutan selalu lebih tinggi dari titik didih pelarut murninya. Hal ini disebabkan adanya partikel-partikel zat terlarut dalam suatu larutan menghalangi kejadian penguapan partikel-partikel pelarut. Oleh lantaran itu, penguapan partikel-partikel pelarut membutuhkan energi yang lebih besar.
Perbedaan titik didih larutan dengan titik didih pelarut murni disebut kenaikan titik didih yang dinyatakan sebagai ∆Tb (b berasal dari kata boil). Titik didih suatu larutan lebih tinggi atau lebih rendah daripada titik didih pelarut, bergantung pada akomodasi zat terlarut itu menguap dibandingkan dengan pelarutnya. Jika zat terlarut tersebut tidak mudah menguap, contohnya larutan gula, larutan tersebut mendidih pada suhu yang lebih tinggi daripada titik didih pelarut air. Sebaliknya, jikalau zat terlarut itu mudah menguap contohnya etanol, larutan akan mendidih pada suhu di bawah titik didih air.
Hukum sifat koligatif sanggup diterapkan dalam meramalkan titik didih larutan yang zat terlarutnya bukan elektrolit dan tidak gampang menguap. Telah ditentukan secara eksperimen bahwa 1,00 mol (6,02 × 1023 molekul) zat apa saja yang bukan elektrolit dan tidak gampang menguap yang dilarutkan dalam (1.000 g) air akan menaikkan titik didih kira-kira 0,51 °C. Perubahan pelarut murni ke larutan, yakni ∆Tb, berbanding lurus dengan molalitas (m) dari larutan tersebut:
∆Tb ¥ m atau ∆Tb = Kb . M
Tabel 1. Tetapan Kenaikan Titik Didih (Kb) Beberapa Pelarut
Pelarut | Titik didih (oC) | Kb (oC /m) |
Aseton | 56,2 | 1,71 |
Benzena | 80,1 | 02,53 |
kamfer | 204,0 | 05,61 |
Karbon tetraklorida | 76,5 | 04,95 |
Sikloheksana | 80,7 | 02,79 |
Naftalena | 217,7 | 05,80 |
Fenol | 182 | 03,04 |
Air | 100,0 | 00,52 |
Kb adalah tetapan kenaikan titik molal dari pelarut (°C/m). Kenaikan titik didih (ΔTb) yaitu titik didih larutan (Tb) dikurangi titik didih pelarut murni (Tbo).
Contoh Soal UN2002 (11) :
Berdasarkan Diagram P-T tersebut yang menggambarkan kenaikan titik didih larutan adalah
Pembahasan :
Berdasarkan Diagram P-T tersebut yang menggambarkan kenaikan titik didih larutan yaitu (C) DD1. Alasannya, semakin tinggi tekanan temperatur awal, contohnya pada suhu 100 °C ditunjukkan oleh grafik F pada larutan temperatur ditunjukkan oleh K1 (fasa gas). Jadi, kenaikan titik didih ditunjukkan oleh (C)
Contoh Soal Kenaikan Titik Didih Air (12) :
Berdasarkan Diagram P-T tersebut yang menggambarkan kenaikan titik didih larutan adalah
A. G1M1
B. F1K1
C. DD1
D. CC1
E. B1D1Pembahasan :
Berdasarkan Diagram P-T tersebut yang menggambarkan kenaikan titik didih larutan yaitu (C) DD1. Alasannya, semakin tinggi tekanan temperatur awal, contohnya pada suhu 100 °C ditunjukkan oleh grafik F pada larutan temperatur ditunjukkan oleh K1 (fasa gas). Jadi, kenaikan titik didih ditunjukkan oleh (C)
Contoh Soal Kenaikan Titik Didih Air (12) :
Hitunglah titik didih larutan yang mengandung 18 g glukosa, C6H12O6. (Ar C = 12 g/mol, Ar H = 1g/mol, dan Ar O = 16 g/mol) dalam 250 g air. (Kb air = 0,52 °C/m)
Kunci Jawaban :
molalitas =  =
=  = 0,4 m
= 0,4 m
ΔTb = Kb m
ΔTb = 0,52 °C/m × 0,4 m
ΔTb = 0,208 °C
Titik didih larutan = 100 + ΔTb
Titik didih larutan = 100 °C + 0,208 °C
Titik didih larutan = 100,208 °C
Jadi, titik didih larutan yaitu 100,208 °C.
Contoh Soal Kenaikan Titik Didih Air (13) :
Titik didih larutan yang mengandung 1,5 g gliserin dalam 30 g air yaitu 100,28 °C. Tentukan massa molekul relatif gliserin. (Kb air = 0,52 °C/m)
Jawaban :
M = 92,8 g/mol
Jadi, larutan tersebut mempunyai titik beku 3,16 °C di bawah 0 °C atau pada –3,16 °C.
Jadi, titik beku larutan yaitu –0,20 °C.
Jadi, titik beku larutan tersebut yaitu 3,71 °C.
0,207 m artinya setiap kg benzena pada larutan mengandung 0,207 mol zat terlarut maka jumlah mol pada 110 g benzena sanggup dihitung.
Proses osmosis sangat penting bagi flora dan binatang lantaran dengan proses osmosis, air dibagikan ke semua sel organisme hidup. Dinding sel merupakan membran semipermeabel, membran sel hidup ini juga sanggup ditembus oleh zat-zat terlarut tertentu sehingga materi makanan dan produk buangan dipertukarkan lewat dinding sel ini. Permeabilitas dinding sel terhadap zat terlarut seringkali bersifat memilih-milih dan hingga batas tertentu tidak bergantung pada ukuran partikel zat terlarut dan konsentrasi mereka. Misalnya, ion magnesium yang terhidrasi simpel tidak menembus dinding terusan pencernaan, sedangkan molekul glukosa sanggup melewati dinding sel.
Desalinasi Air Laut
Banyak daerah di banyak sekali pelosok di dunia yang berdampingan dengan lautan, tetapi penduduknya terancam kekurangan air tawar Untuk itu, negara Arab Saudi menggunakan suatu metode pemisahan air tawar dari garam-garam pekat air laut. Membuang garam-garam yang terlarut dalam air disebut desalinasi. Banyak penelitian dan pengembangan dipusatkan pada lima metode desalinasi, yaitu penyulingan, pembekuan, osmosis terbalik, elektro-dialisis, dan pertukaran ion. Desalinasi osmosis terbalik merupakan metode yang ekonomis. Dalam metode ini, garam terpisah dari airnya oleh tekanan pada membran semipermeabel yang memisahkan sumber air (air maritim dari produknya (air tawar).
C. Sifat Koligatif Larutan Elektrolit
Jika zat terlarut membentuk larutan bersifat asam, basa, dan garam, ternyata rumus-rumus sifat koligatif larutan mempunyai nilai yang tidak sama dengan data percobaan. Harga-harga ΔP, ΔTb , ΔTf , dan π dari larutan-larutan asam, basa, dan garam yang diamati melalui eksperimen selalu lebih besar daripada harga-harga yang dihitung berdasarkan perhitungan ideal.
Bagaimanakah menentukan perbandingan nilai sifat koligatif larutan elektrolit dan nonelektrolit? Untuk mengetahuinya, lakukanlah kegiatan berikut.
Praktikum Sifat Koligatif Larutan Elektrolit (3) :
Tujuan :
Menentukan perbandingan nilai sifat koligatif larutan elektrolit dan non elektrolit
Alat dan Bahan :
Data hasil percobaan
Langkah Kerja :
Amatilah data hasil percobaan berikut. Larutan yang diamati mempunyai konsentrasi yang sama yaitu 0,005 m.
Jawablah pertanyaan berikut untuk menarik kesimpulan.
Menurut Arrhenius, suatu zat elektrolit yang dilarutkan dalam air akan terurai menjadi ion-ion penyusunnya sehingga jumlah partikel zat pada larutan elektrolit akan lebih banyak dibandingkan dengan larutan nonelektrolit yang konsentrasinya sama. Hal ini menimbulkan sifat koligatif pada larutan elektrolit lebih besar daripada larutan nonelektrolit.
Perilaku elektrolit sanggup digambarkan dengan memerhatikan fenomena di atas. Penurunan titik beku ΔTf rutan 0,005 m NaCl 1,96 kali (2 kali) ΔTf glukosa sebagai zat non elektrolit, demikian juga ΔTf ntuk K2SO4 hampir 3 kali dari ΔTf glukosa. Keadaan ini sanggup dinyatakan dengan persamaan berikut.
ΔTf elektrolit = i × ΔTf nonelektrolit
Hubungan sifat koligatif larutan elektrolit dan konsentrasi larutan dirumuskan oleh Van’t Hoff, yaitu dengan mengalikan rumus yang ada dengan bilangan faktor Van’t Hoff yang merupakan faktor penambahan jumlah partikel dalam larutan elektrolit.
i = 1 + (n – 1)α
Keterangan :
i = faktor yang memperlihatkan bagaimana larutan elektrolit dibandingkan dengan larutan nonelektrolit dengan molalitas yang sama. Faktor i inilah yang lebih lanjut disebut faktor Van’t Hoff.
n = jumlah ion dari elektrolit
α = derajat ionisasi elektrolit
Contoh elektrolit biner :
Contoh elektrolit terner :
Contoh elektrolit kuarterner :
Untuk larutan elektrolit berlaku Hukum Van’t Hoff
1. Penurunan Tekanan Uap Jenuh
Rumus penurunan tekanan uap jenuh dengan menggunakan faktor Van’t Hoff hanya berlaku untuk fraksi mol zat terlarutnya saja (zat elektrolit yang mengalami ionisasi), sedangkan pelarut air tidak terionisasi. Oleh lantaran itu, rumus penurunan tekanan uap jenuh untuk zat elektrolit yaitu :
ΔP = XBP° {1 + (n – 1)α }
Perhatikanlah referensi soal penerapan rumus tekanan uap untuk zat elektrolit berikut .
Contoh Soal Penurunan Tekanan Uap Jenuh (23) :
Hitunglah tekanan uap larutan NaOH 0,2 mol dalam 90 gram air jikalau tekanan uap air pada suhu tertentu yaitu 100 mmHg.
Penyelesaian :
X NaOH =
X NaOH = = 0,038
= 0,038
Karena NaOH merupakan elektrolit berpengaruh (α = 1) dan n = 2 maka :
ΔP = P°XB {1 + (n – 1)α }
ΔP = 100 × 0,038 {1 + (2 – 1)1}
ΔP = 7,6 mmHg
Tekanan uap larutan = 100 mmHg – 7,6 mmHg = 92,4 mmHg
Jadi, tekanan uap larutan NaOH yaitu 92,4 mmHg.
2. Kenaikan Titik Didih dan Penurunan Titik Beku
Seperti halnya penurunan tekanan uap jenuh, rumus untuk kenaikan titik didih dan penurunan titik beku untuk larutan elektrolit juga dikalikan dengan faktor Van't Hoff.
∆Tb = Kb m {1 + (n-1) α}
∆Tf = Kf m {1 + (n-1) α}
Perhatikanlah contoh-contoh soal berikut.
Contoh Soal Penurunan Tekanan Uap Jenuh (24) :
Sebanyak 4,8 gram magnesium sulfat, MgSO4 (Mr = 120 g/mol) dilarutkan dalam 250 g air. Larutan ini mendidih pada suhu 100,15 °C. Jika diketahui Kb air 0,52 °C/m, Kf air = 1,8 °C/m, tentukan:
a. derajat ionisasi MgSO4;
b. titik beku larutan.
Kunci Jawaban :
a. Reaksi ionisasi MgSO4 adalah MgSO4(s) → Mg2+(aq) + SO42–(aq)..............(n = 2)
Kenaikan titik didih :
∆Tb = Tb larutan – Tb air
∆Tb = 100,15 °C – 100 °C = 0,15 °C
∆Tb = Kb. m. i
∆Tb = Kb x x {1 + (n – 1)α }
x {1 + (n – 1)α }
0,15 = 0,52 °C/m x x {1 + (2 – 1) α}
x {1 + (2 – 1) α}
α = 0,8
Jadi, derajat ionisasi MgSO4 adalah 0,8.
b. Untuk menghitung titik bekunya, kita cari dulu penurunan titik bekunya dengan rumus:
ΔTf = Kf x x {1 + (n – 1)α}
x {1 + (n – 1)α}
ΔTf = 1,8 °C/m x x {1 + (2 – 1) 0,8}
x {1 + (2 – 1) 0,8}
ΔTf = 0,52 °C
Tf larutan = Tf air – ΔTf = 0 °C – 0,52 °C = – 0,52 °C
Jadi, titik beku larutan tersebut yaitu – 0,52 °C.
Contoh Soal SPMB 2004 (25) :
Agar 10 kg air tidak membeku pada suhu -5 °C perlu ditambahkan garam NaCl. Jika diketahui Kb air = 1,86 °C/m dan Ar H = 1 g/mol, O = 16 g/mol, Na = 23 g/mol, dan Cl = 35,5 g/mol maka pernyataan berikut benar, kecuali ...
A. diharapkan NaCI lebih dari 786 gram
B. larutan NaCI yaitu elektrolit kuat
C. bentuk molekul air tetrahedral
D. NaCI sanggup terionisasi sempurna
E. dalam air terdapat ikatan hidrogen
Pembahasan :
Molekul air berbentuk angular (huruf V). Jadi, pernyataan yang salah yaitu (C) bentuk molekul air tetrahedral.
3. Tekanan Osmotik
Tekanan osmotik untuk larutan elektrolit diturunkan dengan mengalikan faktor van't Hoff.
π = MRT {1 + (n – 1)α}
Perhatikanlah contoh-contoh soal berikut.
Contoh Soal Penurunan Tekanan Osmotik (26) :
Sebanyak 5,85 gram NaCl (Mr = 58,5 g/mol) dilarutkan dalam air hingga volume 500 mL. Hitunglah tekanan osmotik larutan yang terbentuk jikalau diukur pada suhu 27 °C dan R = 0,082 L atm/mol K.
Kunci Jawaban :
Diketahui, NaCl (n = 2) dan α = 1
π = M R T i
π = x RT x {1 + (n – 1)α}
x RT x {1 + (n – 1)α}
π = x 0,082 L atm/mol K x 300 K x {1 + (2 – 1)1}
x 0,082 L atm/mol K x 300 K x {1 + (2 – 1)1}
α = 0,016
Jadi, derajat ionisasi larutan tersebut yaitu 0,016.
Contoh Soal SPMB 2004 (27) :
Jika diketahui tekanan osmotik larutan 10 gram asam benzoat, C6H5COOH, dalam benzena yaitu 2 atm pada suhu tertentu, larutan 20 gram senyawa binernya (C6H5COOH)2 dalam pelarut yang sama mempunyai tekanan osmotik sebesar ...
A. 0,5 atm
B. 1 ,0 atm
C. 2,0 atm
D. 4,0 atm
E. 8,0 atm
Pembahasan :
Oleh lantaran perbandingan massa/Mr, sama, molaritas akan sama dan tekanan osmotik pun sama. Jadi, tekanan osmotiknya sebesar (A) 2 atm.
Rangkuman :
1. Molalitas yaitu besaran yang berkhasiat untuk menghitung jumlah zat terlarut yang dinyatakan dalam mol dan jumlah pelarut dalam kilogram.
2. Fraksi mol merupakan satuan konsentrasi yang semua komponen larutannya dinyatakan berdasarkan mol. Total fraksi mol = 1
xi =
3. Sifat koligatif bergantung pada jumlah zat yang terlarut pada larutan. Sifat koligatif terdiri atas penurunan tekanan uap (ΔP), kenaikan titik didih (ΔTb) dan penurunan titik beku (ΔTf), dan tekanan osmotik.
a. Penurunan tekanan uap (ΔP)





b. Kenaikan titik didih (ΔTb) dan penurunan titik beku (ΔTf)




c. Tekanan osmotik (π )
π =MRT
4. Sifat koligatif larutan elektrolit bergantung pada bilangan faktor Van’t Haff. Jadi, perhitungan penurunan tekanan uap, kenaikan titik didih, dan tekanan osmotik dikalikan dengan faktor Van’t Hoff (i).
i = 1 + (n – 1)α
Anda kini sudah mengetahui Sifat Koligatif Larutan. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Rahayu, Imam. 2009. Mudah Belajar Kimia untuk Kelas XII Sekolah Menengah Atas/Madrasah Aliyah Program Ilmu Pengetahuan Alam. Pusat Perbukuan, Departemen Pendidikan Nasional, p. 194.
Titik didih larutan yang mengandung 1,5 g gliserin dalam 30 g air yaitu 100,28 °C. Tentukan massa molekul relatif gliserin. (Kb air = 0,52 °C/m)
Jawaban :
Titik didih larutan = 100 + ΔTb
100,28 = 100 + ΔTb
ΔTb = 0,28 °C
∆Tb = Kb . M
∆Tb = Kb x 
0,28 °C = 0,52 °C/m x 
M = 92,8 g/mol
Jadi, massa molekul relatif gliserin yaitu 92,8 g/mol.
Contoh Soal SPMB 2004 (14) :
Sebanyak 75 g zat dengan rumus empiris (CH2O) (Ar H = 1 g/mol, C = 12 g/mol, O = 16 g/mol) yang terlarut dalam 500 gram air, mendidih pada suhu 100,52 °C (Kb air = 0,52 °C/m) Zat tersebut termasuk ...
A. triosa
B. tetrosa
C. pentosa
D. heksosa
E. heptosa
Pembahasan :
∆Tb = Kb x
0,52 = 0,52 x
Mr = 150
(CH2O)5 = C5H10O5.
Senyawa karbonat dengan 5 atom C disebut dengan pentosa. Jadi, zat tersebut termasuk (C) pentosa.
Contoh Soal SPMB 2004 (14) :
Sebanyak 75 g zat dengan rumus empiris (CH2O) (Ar H = 1 g/mol, C = 12 g/mol, O = 16 g/mol) yang terlarut dalam 500 gram air, mendidih pada suhu 100,52 °C (Kb air = 0,52 °C/m) Zat tersebut termasuk ...
A. triosa
B. tetrosa
C. pentosa
D. heksosa
E. heptosa
Pembahasan :
∆Tb = Kb x
0,52 = 0,52 x
Mr = 150
Mr (CH2O) = 30
(CH2O)n = 150
30n = 150
n = 5
Senyawa karbonat dengan 5 atom C disebut dengan pentosa. Jadi, zat tersebut termasuk (C) pentosa.
b. Penurunan Titik Beku (ΔTf)
Seperti halnya pada kenaikan titik didih, adanya zat terlarut dalam larutan akan menimbulkan titik beku larutan lebih kecil daripada titik beku pelarutnya. Penurunan titik beku, ΔTf (f berasal dari kata freeze) berbanding lurus dengan molalitas (m) larutan:
ΔTf ∞ m atau ΔTf = Kf m
dengan Kf adalah tetapan penurunan titik beku molal pelarut (°C/m). Penurunan titik beku (Tf) yaitu titik beku pelarut murni (Tfo) dikurangi titik beku larutan (Tf).
ΔTf = ΔTfo - Tf
Berikut ini yaitu beberapa harga tetapan penurunan titik beku (Kf) dari beberapa pelarut.
Tabel 2. Tetapan Penurunan Titik Beku (Kf) Beberapa Pelarut
Pelarut | Titik beku (oC) | Kf(oC/m) |
Aseton | –95,35 | 2,40 |
Benzena | 5,45 | 5,12 |
Kamfer | 179,8 | 39,7 |
Karbon tetraklorida | –23 | 29,8 |
Sikloheksana | 6,5 | 20,1 |
Naftalena | 80,5 | 6,94 |
Fenol | 43 | 7,27 |
Air | 0 | 1,86 |
Contoh Soal Penurunan Titik Beku (15) :
Berapakah titik beku larutan yang terbuat dari 10 g urea CO(NH2)2 dalam 100 g air? (massa molar urea 60 g/mol, Kf air = 1,86 °C/m)
Penyelesaian :
Mol urea = massa urea / Mr urea = 10 g / 60 g/mol = 0,17 mol
Molalitas urea = mol urea / massa air = 0,17mol / 0,1 kg = = 1,7 m
Molalitas urea = mol urea / massa air = 0,17mol / 0,1 kg = = 1,7 m
ΔTf =Kf m
ΔTf = 1,86 °C/m × 1,7 m
ΔTf = 3,16 °C
Jadi, larutan tersebut mempunyai titik beku 3,16 °C di bawah 0 °C atau pada –3,16 °C.
Contoh Soal Penurunan Titik Beku (16) :
Hitunglah titik beku larutan yang terdiri atas 10 gram glukosa (Mr = 180 g/mol) dalam 500 g air (Kf air = 1,86 °C/m).
Kunci Jawaban :
molalitas =  =
=  = 0,11 m
= 0,11 m
ΔTf = Kf m
ΔTf = 1,86 °C/m × 0,11 m
ΔTf = 0,20 °C
Titik beku larutan
ΔTf = Tf air – Tf larutan
0,20 °C = 0 – Tf larutan
Tf larutan = – 0,20 °C
Jadi, titik beku larutan yaitu –0,20 °C.
Contoh Soal Penurunan Titik Beku (17) :
Hitunglah titik beku suatu larutan yang mengandung 2 g kloroform, CHCl3 (Mr = 119 g/mol) yang dilarutkan dalam 50 g benzena (Kf benzena = 5,12 °C/m, Tf benzena = 5,45 °C).
Pembahasan :
Molalitas =  = 0,34 m
= 0,34 m
ΔTf = Kf m = 5,12 °C/m × 0,34 m = 1,74 °C
Titik beku larutan :
ΔTf = Tf benzena – Tf larutan
1,74 = 5,45 – Tf larutan
Tf larutan = 3,71 °C
Jadi, titik beku larutan tersebut yaitu 3,71 °C.
Contoh Soal Penurunan Titik Beku (18) :
Larutan yang dibentuk dengan melarutkan 5,65 g suatu senyawa yang tidak diketahui dalam 110 g benzena membeku pada 4,39 °C. Berapakah massa molar senyawa tersebut?
Kunci Jawaban :
Pada Tabel 2. diketahui titik beku benzena = 5,45 °C dan Kf benzena = 5,12 °C/m
ΔTf = 5,45 °C – 4,39 °C = 1,06 °C
ΔTf = Kf m
m = ΔTf / Kf = 1,06 °C / 5,12 °C/m = 0,207 m
0,207 m artinya setiap kg benzena pada larutan mengandung 0,207 mol zat terlarut maka jumlah mol pada 110 g benzena sanggup dihitung.
0,11 kg benzena x (0,207 mol zat terlarut / 1 kg benzena) = 0,023 mol
massa molar zat terlarut = 5,65 g / 0,023 mol = 245,65 g/mol
Jadi, massa 1 mol zat terlarut tersebut yaitu 245,65 g.
Gejala penurunan titik beku juga mempunyai terapan simpel di antaranya adalah penurunan titik beku air. Zat antibeku (biasanya etilen glikol) yang ditambahkan ke dalam sistem pendingin mesin kendaraan beroda empat mencegah pembekuan air radiator pada animo dingin. Penggunaan CaCl2 dan NaCl untuk menurunkan titik leleh es juga sering diterapkan, contohnya untuk menyiapkan campuran pendingin dalam pembuatan es krim. Contoh penerapan Hukum Raoult dipakai pada alat distilasi untuk memisahkan adonan berdasarkan perbedaan titik didihnya.
 |
| Gambar 3. Alat distilasi dirancang menggunakan prinsip aturan Raoult. |
3. Tekanan Osmotik
Osmosis yaitu merembesnya partikel-partikel pelarut dari larutan yang lebih encer ke larutan yang lebih pekat melalui suatu membran semipermeabel. Membran semipermiabel hanya melewatkan molekul zat tertentu sementara zat yang lainnya tertahan.
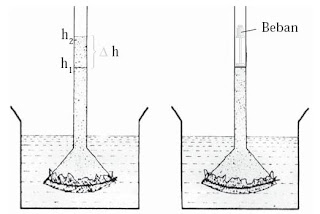
Bagaimanakah kejadian osmosis sanggup terjadi? Untuk menyelidikinya, lakukanlah kegiatan berikut.
Percobaan / Praktikum Tekanan Osmotik (2) :
Tujuan :
Mengamati kejadian osmosis pada larutan elektrolit dan nonelektrolit
Alat dan Bahan :
1. Susunlah 2 buah alat ibarat gambar berikut.
2. Corong yang penggalan bawahnya ditutup dengan kertas perkamen/selaput semipermeabel berisi larutan gula dimasukkan ke dalam kolam (gelas kimia 1 L) yang berisi air.
3. Amatilah naiknya larutan dalam corong dari ketinggian h1 hingga h2.
4. Ulangi langkah kerja 1–3.
Jawablah pertanyaan berikut untuk menarik kesimpulan.
Bagaimanakah kejadian osmosis sanggup terjadi? Untuk menyelidikinya, lakukanlah kegiatan berikut.
Percobaan / Praktikum Tekanan Osmotik (2) :
Tujuan :
Mengamati kejadian osmosis pada larutan elektrolit dan nonelektrolit
Alat dan Bahan :
- Corong
- Kertas perkamen/selopan
- Gelas kimia 1 L
- Larutan gula
- Larutan garam
- Air
1. Susunlah 2 buah alat ibarat gambar berikut.
2. Corong yang penggalan bawahnya ditutup dengan kertas perkamen/selaput semipermeabel berisi larutan gula dimasukkan ke dalam kolam (gelas kimia 1 L) yang berisi air.
3. Amatilah naiknya larutan dalam corong dari ketinggian h1 hingga h2.
4. Ulangi langkah kerja 1–3.
Jawablah pertanyaan berikut untuk menarik kesimpulan.
- Mengapa air di dalam kolam masuk ke dalam corong melalui selaput semipermeabel?
- Mungkinkah larutan gula atau garam yang masuk ke dalam air? Mengapa?
- Apabila corong diganti ukurannya, apakah naiknya zat cair dalam corongsama?
- Samakah beban pada kedua corong yang berbeda?
- Samakah ΔH untuk larutan gula dan garam?
Kesimpulan apakah yang sanggup Anda peroleh dari percobaan di atas? Untuk lebih memahami proses osmosis, pelajarilah uraian berikut.
Perhatikanlah Gambar 4, gambar tersebut memperlihatkan larutan A dan larutan B dengan konsentrasi yang berbeda yang dipisahkan oleh suatu membran semipermeabel yang hanya sanggup ditembus oleh molekul air.
Perhatikanlah Gambar 4, gambar tersebut memperlihatkan larutan A dan larutan B dengan konsentrasi yang berbeda yang dipisahkan oleh suatu membran semipermeabel yang hanya sanggup ditembus oleh molekul air.
 |
| Gambar 4. Proses osmosis dengan membran semi permeabel |
Gambar 4. menggambarkan kejadian osmosis. Pada Gambar 4a, diperlihatkan keadaan awal, kemudian sesudah beberapa saat, tinggi air pada tabung naik (Gambar 4b) hingga kesetimbangan tercapai. Tekanan balik dibutuhkan untuk mencegah terjadinya proses osmosis (Gambar 4c). Jumlah tekanan balik yang dibutuhkan merupakan tekanan osmotik larutan.
Dua larutan yang mempunyai tekanan osmotik sama disebut larutan isotonik. Jika salah satu larutan mempunyai tekanan osmotik lebih tinggi dari larutan yang lainnya, larutan tersebut dinamakan hipertonik. Adapun jika larutan mempunyai tekanan osmotik lebih rendah dari larutan yang lainnya, larutan tersebut dinamakan hipotonik.
Tekanan osmotik termasuk dalam sifat-sifat koligatif lantaran besarnya hanya bergantung pada jumlah partikel zat terlarut persatuan volume larutan. Tekanan osmotik tidak tergantung pada jenis zat terlarut. Persamaan berikut (dikenal sebagai Persamaan Van’t Hoff) dipakai untuk menghitung tekanan osmotik dari larutan encer.
π = MRT
Keterangan:
π = tekanan osmotik (atm)
R = tetapan gas (0,082 L atm/mol K)
M = molaritas larutan
T = suhu (Kelvin)
Contoh Soal Tekanan Osmotik (19) :
Berapakah tekanan osmotik pada 25 °C dari larutan sukrosa (C12H22O11) 0,001 M?
Kunci Jawaban :
Diketahui :
T = 25 °C = (25 + 273) K = 298 K
M = 0,001 mol/L
R = 0,082 L atm/mol K
π = MRT
π = 0,001 mol/L × 0,082 L atm/mol K × 298 K = 0,024 atm
Jadi, tekanan osmotik larutan tersebut yaitu 0,024 atm.
Contoh Soal Tekanan Osmotik (20) :
Dalam larutan encer, 0,001 M gula dalam air dipisahkan dari air murni dengan menggunakan membran osmosis. Berapakah tekanan osmotik dalam torr pada suhu 25 °C?
Penyelesaian :
π = MRT
π = (0,001 mol/L) (0,0821 L atm/mol K) (298 K) = 0,0245 atm
π dalam torr = 0,0245 atm x (760 torr / 1 atm) = 18,6 torr
Jadi, tekanan osmotik 0,001 M gula dalam air yaitu 18,6 torr.
Contoh Soal Tekanan Osmotik (21) :
Suatu larutan dengan volume 100 mL mengandung 0,122 g zat non elektrolit terlarut dan mempunyai tekanan osmotik 16 torr pada suhu 20 °C. Berapakah massa molar zat terlarut tersebut?
Penyelesaian :
T dalam kelvin = (273 + 20) = 293 K
π dalam atm = 16 torr x (1 atm/760 torr) = 0,0211 atm
π = MRT
0,0211 atm = (M) (0,082 L atm/mol K) (298 K)
M = 8,63 × 10–4 x (mol zat terlarut / L larutan)
M = n/V
n = M × V
n = 8,63 x 10–4 x (mol zat terlarut / L larutan) x 0,1 L larutan = 8,63 × 10–5 mol
n = 8,63 x 10–5 mol
massa molar zat terlarut = 0,122 g / 8,63 x 10–5 mol = 1,41 × 103 g/mol
Jadi, massa molar zat terlarut tersebut adalah 1,41 × 103 g/mol.
Contoh Soal Tekanan Osmotik (22) :
Suatu larutan dibentuk dengan melarutkan 1,08 g protein, yaitu serum albumin insan yang diperoleh dari plasma darah (dalam 50 cm3 air). Larutan memperlihatkan tekanan osmotik 5,85 mmHg pada 298 K. Tentukan massa molekul relatif albumin.
Pembahasan :
Tekanan osmotik (π ) dikonversikan terlebih dahulu menjadi atm.
5,85 mmHg = 5,85 / 760 = 7,70 x 10–3 atm

Mr = massa RT / nV = = 6,86 x 104 g/mol
= 6,86 x 104 g/mol
Jadi, massa molekul relatif albumin yaitu 6,86 x 104 g/mol.
Jika tekanan mekanis pada suatu larutan melebihi tekanan osmotik, pelarut murni akan terperas ke luar dari suatu larutan lewat suatu membran semipermeabel (Gambar 6). Proses ini disebut osmosis terbalik (reverse osmosis) dan merupakan suatu cara untuk memulihkan pelarut murni dari dalam suatu larutan. Contoh penerapan osmosis balik yaitu pemulihan air murni dari limbah industri dan memperlihatkan air maritim (desalinasi).
Contoh Soal Tekanan Osmotik (22) :
Suatu larutan dibentuk dengan melarutkan 1,08 g protein, yaitu serum albumin insan yang diperoleh dari plasma darah (dalam 50 cm3 air). Larutan memperlihatkan tekanan osmotik 5,85 mmHg pada 298 K. Tentukan massa molekul relatif albumin.
Pembahasan :
Tekanan osmotik (π ) dikonversikan terlebih dahulu menjadi atm.
5,85 mmHg = 5,85 / 760 = 7,70 x 10–3 atm
Mr = massa RT / nV =
Jadi, massa molekul relatif albumin yaitu 6,86 x 104 g/mol.
 |
| Gambar 6. Osmosis terbalik, memperlihatkan jikalau tekanan mekanis lebih besar daripada tekanan osmotik , pelarut dipaksa melewati membran semipermeabel dari dalam larutan menuju ke pelarut murni. |
Proses osmosis sangat penting bagi flora dan binatang lantaran dengan proses osmosis, air dibagikan ke semua sel organisme hidup. Dinding sel merupakan membran semipermeabel, membran sel hidup ini juga sanggup ditembus oleh zat-zat terlarut tertentu sehingga materi makanan dan produk buangan dipertukarkan lewat dinding sel ini. Permeabilitas dinding sel terhadap zat terlarut seringkali bersifat memilih-milih dan hingga batas tertentu tidak bergantung pada ukuran partikel zat terlarut dan konsentrasi mereka. Misalnya, ion magnesium yang terhidrasi simpel tidak menembus dinding terusan pencernaan, sedangkan molekul glukosa sanggup melewati dinding sel.
Desalinasi Air Laut
Banyak daerah di banyak sekali pelosok di dunia yang berdampingan dengan lautan, tetapi penduduknya terancam kekurangan air tawar Untuk itu, negara Arab Saudi menggunakan suatu metode pemisahan air tawar dari garam-garam pekat air laut. Membuang garam-garam yang terlarut dalam air disebut desalinasi. Banyak penelitian dan pengembangan dipusatkan pada lima metode desalinasi, yaitu penyulingan, pembekuan, osmosis terbalik, elektro-dialisis, dan pertukaran ion. Desalinasi osmosis terbalik merupakan metode yang ekonomis. Dalam metode ini, garam terpisah dari airnya oleh tekanan pada membran semipermeabel yang memisahkan sumber air (air maritim dari produknya (air tawar).
C. Sifat Koligatif Larutan Elektrolit
Jika zat terlarut membentuk larutan bersifat asam, basa, dan garam, ternyata rumus-rumus sifat koligatif larutan mempunyai nilai yang tidak sama dengan data percobaan. Harga-harga ΔP, ΔTb , ΔTf , dan π dari larutan-larutan asam, basa, dan garam yang diamati melalui eksperimen selalu lebih besar daripada harga-harga yang dihitung berdasarkan perhitungan ideal.
Bagaimanakah menentukan perbandingan nilai sifat koligatif larutan elektrolit dan nonelektrolit? Untuk mengetahuinya, lakukanlah kegiatan berikut.
Praktikum Sifat Koligatif Larutan Elektrolit (3) :
Tujuan :
Menentukan perbandingan nilai sifat koligatif larutan elektrolit dan non elektrolit
Alat dan Bahan :
Data hasil percobaan
Langkah Kerja :
Amatilah data hasil percobaan berikut. Larutan yang diamati mempunyai konsentrasi yang sama yaitu 0,005 m.
| Larutan | ΔTf (oC) |
| Glukosa | 0,0093 |
| NaCl | 0,0183 |
| KCl | 0,0180 |
| K2SO4 | 0,0275 |
| H2SO4 | 0,0270 |
Jawablah pertanyaan berikut untuk menarik kesimpulan.
- Hitunglah perbandingan nilai ΔTf NaCl terhadap ΔTf glukosa, ΔTf KCl terhadap ΔTf glukosa, dan seterusnya hingga dengan H2SO4.
- Manakah nilai perbandingan di antara keempat larutan terhadap glukosa yang bernilai hampir sama?
- Bandingkanlah nilai perbandingan itu dengan jumlah ion masing-masing zat yang membentuk larutan elektrolit (NaCl mempunyai ion Na+ dan Cl–).
- Apakah nilai perbandingan tersebut sama dengan jumlah ionnya? Mengapa demikian?
Menurut Arrhenius, suatu zat elektrolit yang dilarutkan dalam air akan terurai menjadi ion-ion penyusunnya sehingga jumlah partikel zat pada larutan elektrolit akan lebih banyak dibandingkan dengan larutan nonelektrolit yang konsentrasinya sama. Hal ini menimbulkan sifat koligatif pada larutan elektrolit lebih besar daripada larutan nonelektrolit.
Perilaku elektrolit sanggup digambarkan dengan memerhatikan fenomena di atas. Penurunan titik beku ΔTf rutan 0,005 m NaCl 1,96 kali (2 kali) ΔTf glukosa sebagai zat non elektrolit, demikian juga ΔTf ntuk K2SO4 hampir 3 kali dari ΔTf glukosa. Keadaan ini sanggup dinyatakan dengan persamaan berikut.
ΔTf elektrolit = i × ΔTf nonelektrolit
Hubungan sifat koligatif larutan elektrolit dan konsentrasi larutan dirumuskan oleh Van’t Hoff, yaitu dengan mengalikan rumus yang ada dengan bilangan faktor Van’t Hoff yang merupakan faktor penambahan jumlah partikel dalam larutan elektrolit.
i = 1 + (n – 1)α
Keterangan :
i = faktor yang memperlihatkan bagaimana larutan elektrolit dibandingkan dengan larutan nonelektrolit dengan molalitas yang sama. Faktor i inilah yang lebih lanjut disebut faktor Van’t Hoff.
n = jumlah ion dari elektrolit
α = derajat ionisasi elektrolit
Contoh elektrolit biner :
NaCl(s) →Na+(aq) + Cl–(aq)................................................(n = 2)
KOH(s) → K+(aq) + OH–(aq)...............................................(n = 2)Contoh elektrolit terner :
H2SO4(l) + 2H2O(l) → 2H3O+(aq) + SO42–(aq)................(n = 3)
Mg(OH)2(s) → Mg2+(aq) + 2OH–(aq)..................................(n = 3)Contoh elektrolit kuarterner :
K3PO4(s) → 3K+(aq) + PO43–(aq).....................................(n = 4)
AlBr3(s) → Al3+(aq) + 3Br–(aq)............................................(n = 4)Untuk larutan elektrolit berlaku Hukum Van’t Hoff
1. Penurunan Tekanan Uap Jenuh
Rumus penurunan tekanan uap jenuh dengan menggunakan faktor Van’t Hoff hanya berlaku untuk fraksi mol zat terlarutnya saja (zat elektrolit yang mengalami ionisasi), sedangkan pelarut air tidak terionisasi. Oleh lantaran itu, rumus penurunan tekanan uap jenuh untuk zat elektrolit yaitu :
ΔP = XBP° {1 + (n – 1)α }
Perhatikanlah referensi soal penerapan rumus tekanan uap untuk zat elektrolit berikut .
Hitunglah tekanan uap larutan NaOH 0,2 mol dalam 90 gram air jikalau tekanan uap air pada suhu tertentu yaitu 100 mmHg.
Penyelesaian :
X NaOH =
X NaOH =
Karena NaOH merupakan elektrolit berpengaruh (α = 1) dan n = 2 maka :
ΔP = P°XB {1 + (n – 1)α }
ΔP = 100 × 0,038 {1 + (2 – 1)1}
ΔP = 7,6 mmHg
Tekanan uap larutan = 100 mmHg – 7,6 mmHg = 92,4 mmHg
Jadi, tekanan uap larutan NaOH yaitu 92,4 mmHg.
2. Kenaikan Titik Didih dan Penurunan Titik Beku
Seperti halnya penurunan tekanan uap jenuh, rumus untuk kenaikan titik didih dan penurunan titik beku untuk larutan elektrolit juga dikalikan dengan faktor Van't Hoff.
∆Tb = Kb m {1 + (n-1) α}
∆Tf = Kf m {1 + (n-1) α}
Perhatikanlah contoh-contoh soal berikut.
Contoh Soal Penurunan Tekanan Uap Jenuh (24) :
Sebanyak 4,8 gram magnesium sulfat, MgSO4 (Mr = 120 g/mol) dilarutkan dalam 250 g air. Larutan ini mendidih pada suhu 100,15 °C. Jika diketahui Kb air 0,52 °C/m, Kf air = 1,8 °C/m, tentukan:
a. derajat ionisasi MgSO4;
b. titik beku larutan.
Kunci Jawaban :
a. Reaksi ionisasi MgSO4 adalah MgSO4(s) → Mg2+(aq) + SO42–(aq)..............(n = 2)
Kenaikan titik didih :
∆Tb = Tb larutan – Tb air
∆Tb = 100,15 °C – 100 °C = 0,15 °C
∆Tb = Kb. m. i
∆Tb = Kb x
0,15 = 0,52 °C/m x
α = 0,8
Jadi, derajat ionisasi MgSO4 adalah 0,8.
b. Untuk menghitung titik bekunya, kita cari dulu penurunan titik bekunya dengan rumus:
ΔTf = Kf x
ΔTf = 1,8 °C/m x
ΔTf = 0,52 °C
Tf larutan = Tf air – ΔTf = 0 °C – 0,52 °C = – 0,52 °C
Jadi, titik beku larutan tersebut yaitu – 0,52 °C.
Contoh Soal SPMB 2004 (25) :
Agar 10 kg air tidak membeku pada suhu -5 °C perlu ditambahkan garam NaCl. Jika diketahui Kb air = 1,86 °C/m dan Ar H = 1 g/mol, O = 16 g/mol, Na = 23 g/mol, dan Cl = 35,5 g/mol maka pernyataan berikut benar, kecuali ...
A. diharapkan NaCI lebih dari 786 gram
B. larutan NaCI yaitu elektrolit kuat
C. bentuk molekul air tetrahedral
D. NaCI sanggup terionisasi sempurna
E. dalam air terdapat ikatan hidrogen
Pembahasan :
Molekul air berbentuk angular (huruf V). Jadi, pernyataan yang salah yaitu (C) bentuk molekul air tetrahedral.
3. Tekanan Osmotik
Tekanan osmotik untuk larutan elektrolit diturunkan dengan mengalikan faktor van't Hoff.
π = MRT {1 + (n – 1)α}
Perhatikanlah contoh-contoh soal berikut.
Contoh Soal Penurunan Tekanan Osmotik (26) :
Sebanyak 5,85 gram NaCl (Mr = 58,5 g/mol) dilarutkan dalam air hingga volume 500 mL. Hitunglah tekanan osmotik larutan yang terbentuk jikalau diukur pada suhu 27 °C dan R = 0,082 L atm/mol K.
Kunci Jawaban :
Diketahui, NaCl (n = 2) dan α = 1
π = M R T i
π =
π =
α = 0,016
Jadi, derajat ionisasi larutan tersebut yaitu 0,016.
Contoh Soal SPMB 2004 (27) :
Jika diketahui tekanan osmotik larutan 10 gram asam benzoat, C6H5COOH, dalam benzena yaitu 2 atm pada suhu tertentu, larutan 20 gram senyawa binernya (C6H5COOH)2 dalam pelarut yang sama mempunyai tekanan osmotik sebesar ...
A. 0,5 atm
B. 1 ,0 atm
C. 2,0 atm
D. 4,0 atm
E. 8,0 atm
Pembahasan :
Oleh lantaran perbandingan massa/Mr, sama, molaritas akan sama dan tekanan osmotik pun sama. Jadi, tekanan osmotiknya sebesar (A) 2 atm.
Rangkuman :
1. Molalitas yaitu besaran yang berkhasiat untuk menghitung jumlah zat terlarut yang dinyatakan dalam mol dan jumlah pelarut dalam kilogram.
Molalitas (m) = 
atau,
m = 
xi =
3. Sifat koligatif bergantung pada jumlah zat yang terlarut pada larutan. Sifat koligatif terdiri atas penurunan tekanan uap (ΔP), kenaikan titik didih (ΔTb) dan penurunan titik beku (ΔTf), dan tekanan osmotik.
a. Penurunan tekanan uap (ΔP)
b. Kenaikan titik didih (ΔTb) dan penurunan titik beku (ΔTf)
c. Tekanan osmotik (π )
π =MRT
4. Sifat koligatif larutan elektrolit bergantung pada bilangan faktor Van’t Haff. Jadi, perhitungan penurunan tekanan uap, kenaikan titik didih, dan tekanan osmotik dikalikan dengan faktor Van’t Hoff (i).
i = 1 + (n – 1)α
Anda kini sudah mengetahui Sifat Koligatif Larutan. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Rahayu, Imam. 2009. Mudah Belajar Kimia untuk Kelas XII Sekolah Menengah Atas/Madrasah Aliyah Program Ilmu Pengetahuan Alam. Pusat Perbukuan, Departemen Pendidikan Nasional, p. 194.
No comments:
Post a Comment