Unsur Kimia : Pengertian, Sifat-sifat, Kelimpahan, Kegunaan, Contoh, Logam, Non Logam - Anda tentu sering mendengar istilah unsur logam dan unsur nonlogam. Unsur-unsur tersebut mempunyai bermacam-macam kegunaan sesuai dengan sifat-sifatnya yang khas. Contohnya, tubuh pesawat terbang harus mempunyai berat yang cukup ringan dan tidak gampang terkorosi oleh udara lembap maka digunakan logam aluminium yang mempunyai massa jenis yang cukup ringan dan tidak mudah terkorosi. Contoh lainnya ialah pemanfaatan nitrogen sebagai bahan pembuatan pupuk. Masih banyak kegunaan dan sifat unsur-unsur kimia yang dapat Anda temukan di dalam potongan ini. Bagaimanakah sifat, kelimpahan di alam, proses pembuatan, dan cara menentukan kadar unsur-unsur tersebut? Temukanlah jawabannya dengan menelusuri isi potongan ini.
A. Kelimpahan Unsur di Alam
Tahukah Anda, apakah kesamaan antara velg ban kendaraan dan badan pesawat terbang? Kedua benda tersebut terbuat dari logam aluminium. Aluminium hanyalah salah satu teladan unsur kimia yang ditemukan dalam kehidupan sehari-hari. Selain aluminium, masih ada sekitar ratusan unsur. Unsur-unsur tersebut tersebar meruah di alam. Indonesia dikenal sebagai negara yang kaya dengan sumber daya alam, salah satunya logam-logam, menyerupai tembaga, nikel, dan emas. Daerah mana sajakah yang merupakan tempat tambang logam?
Percobaan Kimia 1 :
Daerah Penghasil Tambang
Menyelidiki tempat penghasil tambang di Indonesia
Alat dan Bahan
1. Media cetak
2. Internet
Langkah Kerja :
1. Carilah informasi mengenai daerah-daerah di Indonesia yang merupakan daerah tambang. Gunakan kata kunci yang berafiliasi dengan logam, seperti logam, bijih logam, emas, baja, perak, aluminium, timah, besi, tembaga, nikel, hematit, magnetit, pirit, siderit, kriolit, bauksit, dan kasiterit.
2. Lengkapi tabel berikut menurut informasi yang Anda peroleh.
Mineral | Unsur Utama | Daerah Penghasil |
Jawablah pertanyaan berikut untuk menarik kesimpulan.
1. Mineral apa saja yang mengandung logam besi?
2. Daerah mana saja yang merupakan tambang besi?
3. Mineral apa saja yang mengandung logam aluminium?
4. Daerah mana saja yang merupakan tambang aluminium?
5. Mineral apa saja yang mengandung logam timah?
6. Daerah mana saja yang merupakan tambang timah?
7. Mineral apa saja yang mengandung logam nikel?
8. Daerah mana saja yang merupakan tambang nikel?
9. Mineral apa saja yang mengandung logam tembaga?
10. Daerah mana saja yang merupakan tambang tembaga?
11. Mineral apa saja yang mengandung logam emas?
12. Daerah mana saja yang merupakan tambang emas?
13. Mineral apa saja yang mengandung logam perak?
14. Daerah mana saja yang merupakan tambang perak?
Kerjakanlah secara berkelompok dan diskusikan hasil yang diperoleh.
Contoh Soal 1 :
A. bauksit
B. kriolit
C. pirit
D. pirolusit
E. hematit
Kunci Jawaban :
Bauksit dan kriolit merupakan mineral aluminium. Pirit dan hematit merupakan mineral besi. Pirolusit (MnO2) merupakan mineral mangan. Jadi, mineral mangan adalah (D) pirolusit.
Unsur-unsur kimia terdapat melimpah di kulit bumi dan lapisan atmosfer. Unsur-unsur tersebut sanggup dikelompokkan menjadi unsur logam dan nonlogam. Di kulit bumi, unsur-unsur kimia biasanya terdapat dalam bentuk senyawa yang terkandung dalam tanah dan batuan. Tabel berikut menunjukkan komposisi unsur-unsur kimia di kulit bumi.
Tabel 1. Komposisi Unsur-Unsur Kimia di Kulit Bumi
Unsur | Persentase (%) |
Oksigen | 46,60 |
Silikon | 27,72 |
Aluminium | 8,13 |
Besi | 5,00 |
Kalsium | 3,63 |
Natrium | 2,83 |
Kalium | 2,59 |
Magnesium Titanium | 2,09 0,44 |
Hidrogen Fosfor | 0,14 0,12 |
Mangan Unsur-unsur lainnya | 0,10 0,61 |
Sumber: Basic Concept of Chemistry, 1996 | |
1. Besi
Besi merupakan logam yang paling banyak digunakan. Di alam, besi terdapat dalam bentuk bijih besi, contohnya hematit (Fe2O3), magnetit (Fe3O4), siderit (FeCO3), dan pirit (FeS2). Daerah tambang bijih besi di Indonesia terdapat di Cilacap, Jawa Tengah dan beberapa tempat di Jawa Timur. Adapun daerah pengolahan bijih besi dan industri baja terdapat di Cilegon, Banten. Logam besi bereaksi dengan asam klorida menghasilkan gas hidrogen.
Fe(s) + 2 H+(aq) → Fe2+(aq) + H2(g)
Asam sulfat pekat sanggup mengoksidasi logam besi menjadi Fe2+. Besi memiliki bilangan oksidasi +2 dan +3. Contoh senyawa besi(II), menyerupai FeO (hitam), FeSO4.7 H2O (hijau), FeCl2 (kuning), dan FeS (hitam). Dengan adanya oksigen, ion Fe2+ dalam larutan sanggup teroksidasi menjadi ion Fe3+. Besi(III) oksida berwarna cokelat kemerahan dan besi(III) klorida berwarna hitam kecokelatan.
2. Aluminium
Aluminium terdapat melimpah di dalam kulit bumi, jumlahnya sekitar 8%. Dengan kelimpahan sebesar itu, aluminium merupakan unsur ketiga terbanyak sesudah oksigen dan silikon serta merupakan unsur logam yang paling melimpah. Namun, aluminium merupakan logam yang mahal karena pengolahannya yang sulit. Mineral aluminium yang bernilai hemat adalah bauksit (Al2O3.2 H2O). Mineral lainnya yang mengandung aluminium adalah ortoklas (KAlSi3O8), beril (Be3Al2Si6O8), kriolit (Na3AlF6), dan korundum (Al2O3). Di Indonesia, bauksit banyak ditemukan di pulau Bintan dan Tayan (Kalimantan Barat).
Aluminium mempunyai massa jenis rendah (2,7 g/cm3), sanggup diregangkan, mudah ditempa, dan merupakan konduktor listrik yang baik. Aluminium tidak bereaksi dengan air. Aluminium bereaksi dengan asam klorida dan basa kuat, menyerupai persamaan reaksi berikut.
2 Al(s) + 6 HCl(aq) → 2 AlCl3(aq) + 3 H2(g)
2 Al(s) + 2 NaOH(aq) + 2 H2O(l) → 2 NaAlO2(aq) + 3 H2(g)
3. Tembaga
Tembaga merupakan logam yang kuat, sanggup ditempa, tahan korosi, serta penghantar listrik dan panas yang baik. Bijih tembaga yang terpenting adalah berupa sulfida, menyerupai kalkosit (Cu2S) dan kalkopirit (CuFeS2). Penambangan tembaga di Indonesia terdapat di Papua, Sulawesi Utara, Jawa Barat, dan beberapa tempat lain.
Cu(s) + 2 H2SO4(aq) → CuSO4(aq) + SO2(g) + 2 H2O(l)
Tembaga bereaksi dengan asam sulfat panas membentuk senyawa tembaga(II) sulfat yang berwarna biru.
2 Cu+(aq) → Cu(s) + Cu2+(aq)
Tembaga mempunyai bilangan oksidasi +1 dan +2. Tembaga dengan bilangan oksidasi +1 kurang stabil dan mengalami reaksi disproporsionasi dalam larutannya.
Semua senyawa tembaga(I) bersifat diamagnetik dan tidak berwarna, kecuali Cu2O (merah). Senyawa tembaga(II) bersifat paramagnetik dan berwarna, contohnya CuO (hitam), CuSO4.5 H2O (biru), dan CuS (hitam).
4. Emas
Logam emas berwarna kuning dan relatif lunak. Emas merupakan logam yang paling gampang ditempa dan paling gampang memuai. Emas sanggup ditempa sedemikian tipisnya. Sebagai ilustrasi, 120.000 lembar yang ditumpuk memiliki tebal tidak lebih dari 1 cm. Dari 1 g emas sanggup dibentuk kawat sepanjang 2,5 km. Logam emas disebut juga logam mulia lantaran emas tidak bereaksi dengan oksigen dan tidak terkorosi di udara. Emas juga tidak bereaksi dengan asam atau basa. Daerah pertambangan emas di Indonesia ada di Aceh Barat, Lampung Selatan, Lebak (Jawa Barat), Kalimantan Tengah, dan Bengkulu. Selain dari hasil pertambangan, emas juga diperoleh dari hasil samping pemurnian tembaga dan nikel.
5. Perak
Perak ialah logam yang berwarna putih dan sangat mengilap terutama setelah digosok. Perak ditemukan dalam bentuk senyawa yang berupa klorida dan sulfida. Bijih perak yang berupa sulfida sering bercampur dengan sulfida dari tembaga, nikel, arsen, dan antimon. Daerah pertambangan perak di Indonesia terdapat di Cikotok (Banten), Gunung Bijih (Papua), dan Kalimantan Tengah. Cara penambangan yang dipakai ialah dengan pertambangan terbuka dan tertutup. Produksi perak umumnya diperoleh sebagai hasil sampingan pada pengolahan logam lain, menyerupai tembaga dan timbal.
6. Timah
Timah ialah logam yang berwarna putih perak, relatif lunak, tahan karat, dan mempunyai titik leleh yang rendah. Ada dua jenis timah, yaitu timah yaitu timah putih dan timah abu-abu. Bijih timah yang terpenting ialah kasiterit (SnO2). Tempat penambangan bijih timah di Indonesia berada di Bangka, Belitung, dan pulau Kampar (Riau).
7. Nikel
Nikel ialah logam yang berwarna putih mengilap, sangat keras, dan tidak gampang berkarat. Bijih nikel yang utama ialah nikel sulfida. Daerah penambangan nikel ada di Koala (Maluku Utara), Soroako (Sulawesi Selatan), dan Maluku Utara. Anda mungkin telah mengetahui beberapa jenis logam dan mineral yang mengandungnya. Dalam kehidupan sehari-hari, beberapa unsur logam mudah ditemui dalam bentuk produk-produk rumah tangga, materi industri, dan perhiasan. Perhatikanlah gambar berikut.
Emas, perak, nikel, dan besi merupakan unsur logam. Selain unsur logam, terdapat juga unsur nonlogam. Contoh unsur nonlogam, di antaranya nitrogen, oksigen, karbon, dan sulfur. Tahukah Anda, dalam bentuk apakah unsur-unsur nonlogam terdapat di alam? Unsur-unsur nonlogam, seperti oksigen dan nitrogen kebanyakan terdapat di alam dalam bentuk gas, sebagian lagi dalam bentuk senyawa. Udara mengandung 78% gas nitrogen, 21% gas oksigen, dan sisanya ialah gas-gas lain, menyerupai gas hidrogen, karbon dioksida, gas argon, gas helium, dan gas nitrogen dioksida.
B. Sifat-Sifat Unsur
1. Perbedaan Sifat Kimia dan Sifat Fisis
Setiap unsur kimia mempunyai banyak sekali sifat yang membedakannya dengan unsur yang lain. Di Kelas X, Anda telah mempelajari sifat fisis dan sifat kimia unsur. Untuk menyegarkan ingatan Anda perihal sifat-sifat unsur, mari lakukan acara berikut.
Percobaan Kimia Sederhana 2 :
Sifat Kimia dan Sifat Fisis Unsur Kimia
Menyelidiki perbedaaan sifat kimia dan sifat fisis unsur kimia
Alat dan Bahan :
Tabel periodik
Langkah Kerja :
1. Amati tabel periodik unsur, kemudian identifikasi informasi yang terdapat dalam tabel periodik.
2. Tuliskan sifat-sifat yang dimiliki unsur.
3. Kelompokkan sifat-sifat unsur menurut sifat fisis dan kimianya.
Jawablah pertanyaan berikut untuk menarik kesimpulan.
1. Sifat-sifat apa saja yang merupakan sifat fisis?
2. Sifat-sifat apa saja yang merupakan sifat kimia?
Diskusikan hasil yang Anda peroleh dengan teman Anda.
Bandingkanlah hasil penyelidikan Anda dengan klarifikasi berikut.
Sifat suatu unsur bermanfaat untuk menjelaskan, mengidentifikasi, memisahkan, dan mengelompokkan. Menjelaskan suatu unsur berdasarkan sifatnya menyerupai dengan cara Anda ketika menjelaskan seseorang. Ada dua jenis sifat unsur, yaitu sifat fisis dan sifat kimia. Sifat fisis menjelaskan bentuk fisik unsur tersebut, contohnya warna, kerapuhan, kelenturan, konduktivitas listrik, massa jenis, sifat magnet, kekerasan, nomor atom, kalor penguapan, titik leleh, dan titik didih. Adapun sifat kimia suatu zat mencakup bagaimana suatu unsur sanggup bereaksi dengan unsur lainnya, kecepatan reaksi jika bereaksi dengan unsur lain, jumlah panas yang dihasilkan dari suatu reaksi dengan unsur lain, dan suhu ketika terjadi reaksi.
Beberapa sifat unsur, baik fisis maupun kimia, dimuat dalam tabel periodik unsur. Sifat-sifat fisis unsur yang diinformasikan dalam tabel periodik ialah wujud pada suhu kamar, titik didih, titik leleh, dan massa jenis. Sifat kimia unsur sanggup diprediksi dari data pada tabel periodik, antara lain nomor atom, massa atom, struktur elektron, dan tingkat oksidasi. Dari data nomor atom, massa atom, struktur elektron, dan tingkat oksidasi suatu unsur sanggup diketahui bagaimana suatu unsur bereaksi, dengan unsur apa dapat bereaksi, dan senyawa yang dihasilkan dari reaksi tersebut.
2. Sifat Fisis Beberapa Unsur
Dengan melihat tabel periodik, Anda sanggup mengetahui wujud suatu unsur pada suhu kamar. Unsur-unsur kimia pada suhu kamar sanggup berwujud padat, cair, dan gas. Anda juga sanggup mengetahui sifat fisis lainnya, seperti titik didih dan titik leleh. Menurut Anda, adakah korelasi antara wujud suatu unsur dengan titik didih dan titik leleh yang dimiliki unsur tersebut? Mari, menilik hal tersebut dengan melaksanakan acara berikut.
Percobaan Kimia Sederhana 3 :
Tujuan :
Menyelidiki imbas sifat fisis unsur-unsur kimia
Alat dan Bahan :
Tabel periodik
Langkah Kerja :
Gunakanlah informasi dalam Tabel Periodik untuk melengkapi tabel berikut.
Golongan | Unsur | Titik Didih (°C) | Titik Leleh (°C) | Wujud |
IIA | Be | |||
Mg | ||||
Ca | ||||
Sr | ||||
Ba | ||||
Ra | ||||
VIIA | F | |||
Cl | ||||
Br | ||||
I | ||||
At | ||||
VIIIA | He | |||
Ne | ||||
Ar | ||||
Kr | ||||
Xe | ||||
Rn |
Jawablah pertanyaan berikut untuk menarik kesimpulan.
1. Unsur-unsur apa saja yang berwujud padat?
2. Bagaimana titik didih dan titik leleh unsur-unsur yang berwujud padat dibandingkan dengan suhu kamar?
3. Unsur-unsur apa sajakah yang berwujud cair?
4. Bagaimana titik didih dan titik leleh unsur-unsur yang berwujud cair dibandingkan dengan suhu kamar?
5. Unsur-unsur apa sajakah yang berwujud gas?
6. Bagaimana titik didih dan titik leleh unsur-unsur yang berwujud gas dibandingkan dengan suhu kamar?
Diskusikan hasil yang Anda peroleh dengan teman Anda.
Wujud suatu unsur berkaitan dengan titik didih dan titik leleh yang dimiliki unsur tersebut. Jika titik didih dan titik leleh suatu unsur lebih tinggi daripada suhu kamar (25 °C) maka unsur tersebut berwujud padat. Itulah sebabnya semua unsur golongan IIA berwujud padat lantaran titik didih dan titik leleh unsur-unsur golongan IIA di atas 25 °C.
Jika titik didih dan titik leleh suatu unsur lebih rendah daripada suhu kamar (25 °C) maka unsur tersebut berwujud gas. Itulah sebabnya, semua unsur golongan VIIIA berwujud gas lantaran titik didih dan titik leleh unsurunsur golongan VIIIA di bawah 25 °C.
Unsur-unsur golongan VIIA ada yang berwujud padat, cair, dan gas. Unsur-unsur golongan VIIA yang berwujud padat mempunyai titik didih dan titik leleh di atas 25 °C, sedangkan unsur berwujud gas mempunyai titik didih dan titik leleh di bawah 25 °C. Bagaimana dengan bromin? Unsur ini memiliki titik didih di atas 25 °C, tetapi titik lelehnya di bawah 25 °C. Hal inilah yang menyebabkan unsur bromin berwujud cair.
3. Sifat Kimia Beberapa Unsur
Selain mempunyai sifat fisis, unsur-unsur juga mempunyai sifat kimia. Sifat-sifat kimia tersebut, di antaranya daya pengoksidasi, daya pereduksi, dan warna nyala. Bagaimanakah daya pengoksidasi dan daya pereduksi unsur-unsur golongan halogen? Bagaimanakah warna nyala unsur-unsur golongan alkali dan alkali tanah? Ingin mengetahui jawabannya? Temukanlah jawabannya dengan melaksanakan acara berikut.
Percobaan Kimia Sederhana 4 :
Menyelidiki daya pengoksidasi dan daya pereduksi unsur-unsur golongan halogen
Alat dan Bahan :
1. 5 mL larutan KI
2. Cl2
3. Larutan CCl4
4. Tabung reaksi
Langkah Kerja :
1. Tuangkan 5 mL larutan KI ke dalam tabung reaksi. Amati warna larutan KI.
2. Tambahkan Cl2 ke dalam tabung reaksi. Amati warna larutan setelah penambahan Cl2.
3. Tambahkan CCl4 ke dalam tabung reaksi, kemudian kocok. Amati warna larutan pada lapisan bawah.
Jawablah pertanyaan berikut untuk menarik kesimpulan.
1. Bagaimana warna larutan sesudah penambahan Cl2?
2. Mengapa warna larutan sesudah penambahan Cl2 berubah?
3. Bagaimana warna larutan sesudah penambahan CCl4 dan pengocokan?
4. Mengapa warna larutan sesudah penambahan CCl4 dan pengocokan berubah?
5. Manakah potensial reduksi yang paling besar antara Cl2 dan I2?
6. Apakah korelasi antara potensial reduksi dengan daya pengoksidasi dan daya pereduksi?
Kerjakanlah secara berkelompok dan diskusikanlah hasil yang Anda peroleh.
Bandingkanlah hasil penyelidikan Anda dengan klarifikasi berikut.
Larutan KI yang berwarna bening mengandung ion I–. Penambahan larutan Cl2 mengakibatkan warna larutan berkembang menjadi cokelat. Warna cokelat ini merupakan warna larutan KI3. Setelah ditambahkan CCl4 dan dikocok, akan dihasilkan dua lapisan, yaitu lapisan atas (I2 dalam KI3) dan lapisan bawah (I2 dalam CCl4). Lapisan terbagi dua dan tidak bercampur karena larutan KI3 dan CCl4 mempunyai kepolaran dan massa jenis yang berbeda.
Catatan Kimia :
Daya pereduksi halogen: I2 > Br2 > Cl2 > F2
Larutan yang kepolarannya berbeda tidak akan bercampur. Massa jenis CCl4 lebih besar sehingga berada di lapisan bawah. Lapisan bawah mempunyai warna ungu. Mengapa? Hal ini sanggup dijelaskan oleh persamaan reaksi berikut.
Cl2(g) + 2 I–(aq) → Cl–(aq) + I2(s)
Dari persamaan reaksi tersebut sanggup diketahui bahwa Cl2 mengoksidasi I– menjadi I2 yang ditandai dengan perubahan warna dari bening ke ungu. Mengapa Cl2 sanggup mengoksidasi I–? Hal ini berkaitan dengan harga potensial reduksi unsur-unsur golongan halogen. Perhatikanlah tabel berikut.
Tabel 2. Harga Potensial Reduksi Unsur-Unsur Golongan Halogen
Reaksi | Potensial Reduksi (E°) | Nomor Atom |
F2(g) + 2 e– → 2 F–(aq) | +2,87 | 9 |
Cl2(g) + 2 e– → 2 Cl–(aq) | +1,36 | 17 |
Br2(g) + 2 e– → 2 Br–(aq) | +1,06 | 35 |
I2(g) + 2 e– → 2 I–(aq) | +0,54 | 53 |
Berdasarkan data pada tabel, sanggup disimpulkan bahwa dalam satu golongan, semakin besar nomor atom (dari atas ke bawah), harga potensial reduksi semakin kecil. Berarti, semakin ke bawah, sifat pengoksidasi semakin berkurang. Unsur yang potensial reduksinya lebih besar sanggup mengoksidasi unsur yang potensial reduksinya lebih kecil. Cl2 sanggup mengoksidasi I– lantaran potensial reduksi Cl lebih besar daripada I. Dari klarifikasi ini, Anda sanggup meramalkan unsur-unsur mana saja dalam golongan halogen yang sanggup mengoksidasi unsur lainnya. Unsur F sanggup mengoksidasi unsur-unsur halogen lainnya, sedangkan unsur Cl dapat mengoksidasi unsur-unsur halogen lainnya, kecuali F. Kemudian, unsur Br hanya dapat mengoksidasi I, sedangkan unsur I tidak sanggup mengoksidasi unsur lainnya.
Contoh Soal 2 :
A. larutan KI dan gas Br2
B. larutan KI dan gas Cl2
C. larutan KCl dan gas Br2
D. larutan KBr dan gas Cl2
E. larutan KCl dan gas F2
Kunci Jawaban :
Gas Br2 tidak mampu mengoksidasi larutan KCl. Jadi, reaksi yang tidak dapat berlangsung ialah (C) larutan KCl dengan gas Br2.
Lawan dari pengoksidasi ialah pereduksi. Semakin kecil nilai potensial reduksinya, sifat daya pereduksinya semakin besar. Jadi, unsur I memiliki daya pereduksi yang paling besar diikuti Br, Cl, dan F. Sifat kimia unsur yang lainnya ialah warna nyala. Lakukanlah kegiatan berikut untuk mengetahui warna nyala beberapa unsur golongan alkali dan alkali tanah.
Percobaan Kimia Sederhana 5 :
Warna Nyala Unsur-Unsur Golongan Alkali dan Alkali Tanah
Tujuan :
Menyelidiki warna nyala unsur-unsur golongan alkali dan alkali tanah
Alat dan Bahan :
1. Kawat nikrom
2. Spatula
3. Pembakar bunsen
4. Kaca kobalt
5. HCl pekat
6. NaCl
7. KCl
8. CaCl2
9. SrCl2
10. BaCl2
Sebelum memulai percobaan carilah informasi mengenai senyawa yang akan digunakan, mencakup sifat kimia senyawa, cara penggunaan, dan penanganannya.
Langkah Kerja :
1. Siapkan kawat nikrom yang bersih. Untuk memastikan bahwa kawat nikrom telah bersih, celupkan ujung kawat nikrom ke dalam larutan HCl pekat. Setelah itu, bakar memakai pembakar bunsen berkali-kali hingga bersih.
2. Warna nyala setiap unsur sanggup diuji dengan cara mencelupkan ujung kawat nikrom ke dalam larutan HCl pekat, kemudian celupkan ke dalam setiap garam klorida dan bakar memakai pembakar bunsen. Gunakan beling kobalt untuk mengamati warna nyala kalium.
3. Tuliskan hasil pengamatan Anda pada tabel berikut.
Garam | Unsur yang Diamati | Warna Nyala |
NaCl | Na | |
KCl | K | |
CaCl2 | Ca | |
SrCl2 | Sr | |
BaCl2 | Ba |
Jawablah pertanyaan berikut untuk menarik kesimpulan.
1. Bagaimana warna nyala setiap unsur?
2. Mengapa nyala setiap unsur berbeda-beda?
Kerjakanlah secara berkelompok dan diskusikanlah hasil yang Anda peroleh.
Bandingkanlah kesimpulan yang Anda peroleh dengan penjelasan berikut.
Unsur-unsur golongan alkali dan alkali tanah sanggup dibedakan dari warna nyala yang dihasilkannya. Bagaimanakah warna nyala unsur-unsur tersebut? Perhatikanlah gambar berikut.
 |
| Gambar 1. Warna nyala unsur-unsur golongan alkali dan alkali tanah. |
Unsur-unsur tersebut mempunyai warna nyala yang berbeda-beda karena sifat dari atomnya. Jika diberikan energi, kedudukan elektron dalam atom akan mengalami perubahan, yaitu berpindah ke kulit yang lebih tinggi (eksitasi). Setelah itu, elektron akan kembali ke keadaan dasar (stabil) sambil melepaskan energi radiasi elektromagnetik. Pada dikala unsur-unsur alkali dan alkali tanah dipanaskan (diberi energi), elektron dalam atom alkali dan alkali tanah akan mengalami eksitasi, dan pada dikala kembali ke keadaan stabil, setiap elektron akan melepaskan energi radiasi elektromagnetik berupa pancaran nyala cahaya. Nyala setiap atom berbeda-beda dan sangat khas.
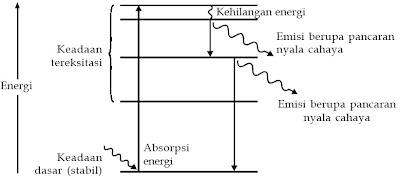 |
| Gambar 2. Diagram tingkat energi pada atom yang mengalami eksitasi. |
Contoh Soal 3 :
A. Mg
B. Be
C. Ra
D. Ca
E. Sr
Kunci Jawaban :
Aluminium ialah logam yang bersifat amfoter, yaitu dapat membentuk asam (HAIO2) dan membentuk basa Al(OH)3. Sama seperti logam Be dapat membentuk asam H2BeO2 dan membentuk basa Be(OH)2. Jadi, unsur alkali tanah yang sifatnya menyerupai dengan aluminium adalah (B) Be.
Catatan Kimia :
Logam alkali dan alkali tanah dapat dibedakan dari warna nyala yang dihasilkannya ketika dibakar. Natrium berwarna kuning, kalium berwarna ungu, kalsium berwarna merah jingga, stronsium berwarna merah bata, dan barium berwarna hijau.
4. Keperiodikan Sifat Unsur Seperiode
Unsur-unsur kimia dalam tabel sanggup juga dikelompokkan berdasarkan periode. Bagaimanakah sifat unsur-unsur yang terletak dalam satu periode? Lakukanlah acara berikut untuk mengetahui keteraturan sifat-sifat unsur periode ketiga.
Percobaan Kimia Sederhana 6 :
Sifat Asam dan Basa Larutan Senyawa Unsur-Unsur Periode Ketiga
Tujuan :
Menyelidiki sifat asam dan basa larutan senyawa unsur-unsur periode ketiga
Alat dan Bahan :
1. Penjepit logam
2. Cawan porselen
3. Pembakar bunsen
4. Pipet tetes
5. Labu erlenmeyer
6. Gabus labu berlubang
7. Sendok bakar
8. Rak dan tabung reaksi
9. Logam magnesium
10. Serbuk belerang
11. Lakmus merah
12. Lakmus biru
13. Larutan Al2(SO4)3 0,1 M
14. Larutan amoniak 1 M
15. Larutan H2SO4 1 M
16. Larutan NaOH 1 M
Sebelum memulai percobaan carilah informasi mengenai senyawa yang akan digunakan, mencakup sifat kimia senyawa, cara penggunaan, dan penanganannya.
Langkah Kerja :
1. Ampelas sekitar 4 cm logam magnesium. Jepit salah satu ujungnya dengan penjepit logam. Bakar ujung lainnya dengan pembakar bunsen. Amati warna abu hasil pembakaran.
2. Kumpulkan bubuk hasil pembakaran ke dalam cawan porselen, kemudian teteskan 5 tetes air ke dalam cawan.
3. Celupkan lakmus merah dan lakmus biru ke dalam larutan. Amati perubahan warna lakmus.
4. Masukkan sedikit sulfur ke dalam sendok bakar yang telah dipasang gabus penyumbat tabung. Bakarlah dengan memakai pembakar bunsen di lemari asam.
5. Celupkan sendok bakar ke dalam labu erlenmeyer yang berisi air dan kertas lakmus merah dan biru. Amati perubahan warna lakmus.
6. Tuangkan 2 mL larutan Al2(SO4)3 0,1 M ke dalam tabung reaksi. Teteskan larutan amoniak hingga terbentuk endapan.
7. Bagi endapan menjadi dua bagian. Masukkan setiap potongan ke dalam tabung reaksi. Teteskan larutan NaOH ke dalam tabung reaksi 1 dan larutan H2SO4 ke dalam tabung reaksi 2. Amati reaksi yang terjadi.
8. Tuliskan hasil pengamatan Anda pada tabel berikut.
| Zat | Perubahan warna | Sifat | |
| Lakmus merah | Lakmus biru | ||
| | | | |
| | | | |
Jawablah pertanyaan berikut untuk menarik kesimpulan.
1. Senyawa apakah yang terbentuk dari hasil reaksi sulfur dan air?
2. Senyawa apakah yang terbentuk dari hasil reaksi magnesium dan air?
3. Senyawa apakah yang terbentuk dari hasil reaksi Al2(SO4)3 dan amoniak?
4. Bagaimanakah sifat senyawa yang terbentuk dari hasil reaksi Al2(SO4)3 dan amoniak?
Kerjakanlah secara berkelompok dan diskusikanlah hasil yang Anda peroleh.
Bandingkanlah hasil penyelidikan Anda dengan klarifikasi berikut.
Unsur-unsur dalam periode ketiga terdiri atas unsur logam dan nonlogam. Jika direaksikan dengan air, unsur-unsur tersebut dapat membentuk senyawa asam atau basa. Unsur-unsur logam cenderung membentuk senyawa basa, sedangkan senyawa nonlogam cenderung membentuk senyawa asam. Sifat asam atau basa senyawa-senyawa tersebut dapat diamati dengan memakai kertas lakmus.
Pembakaran logam Mg akan menghasilkan senyawa oksida MgO. Jika direaksikan dengan air, MgO ini sanggup membentuk senyawa basa Mg(OH)2.
Mg(s) + O2(g) → MgO(s)
MgO(s) + H2O(l) → Mg(OH)2(aq) Hasil pengujian dengan kertas lakmus memperlihatkan bahwa Mg(OH)2 bersifat basa lantaran kertas lakmus merah berkembang menjadi biru, sedangkan kertas lakmus biru tidak berubah warna. Magnesium terbakar di udara membentuk magnesium oksida dan magnesium nitrida memancarkan warna nyala yang terang.
Pembakaran unsur sulfur akan menghasilkan senyawa oksida gas SO2. Sulfur terbakar di udara membentuk sulfur dioksida menghasilkan warna biru.Jika direaksikan dengan air, SO2 ini sanggup membentuk senyawa asam H2SO3. Bagaimanakah sifat senyawa ini? Kertas lakmus merah yang berada dalam labu erlenmeyer tidak berubah, sedangkan kertas lakmus biru justru berubah menjadi merah. Hal ini memperlihatkan bahwa H2SO3 bersifat asam.
S(s) + O2(g) → SO2(g)
SO2(g) + H2O(l) → H2SO3(aq) Reaksi antara Al2(SO4)3 dan amoniak (NH4OH) akan menghasilkan endapan Al(OH)3 dan larutan (NH4)2SO4 dengan reaksi sebagai berikut.
Al2(SO4)3(s) + NH4OH(aq) → Al(OH)3(s) + (NH4)2SO4(l)
Tahukah Anda, bagaimana sifat dari endapan Al(OH)3? Sifat ini sanggup diamati dengan mereaksikan endapan Al(OH)3 dengan senyawa asam atau basa.
Al(OH)3(aq) + H2SO4(aq) → Al2(SO4)3(aq) + H2O(l)
Al(OH)3(aq) + NH4OH(aq) → Al(OH)4–(aq) + NH4+(aq)
Al(OH)4–(aq) → AlO2–(aq) + 2 H2O(l) Al(OH)3 sanggup bereaksi dengan asam dan basa sehingga Al(OH)3 disebut senyawa amfoter.
Berdasarkan klarifikasi di atas, sanggup disimpulkan bahwa:
Dari kiri ke kanan dalam sistem periodik unsur (semakin besar nomor atom), sifat logam semakin lemah, sifat nonlogam semakin kuat, sifat asam semakin kuat, dan sifat basa semakin lemah.
Contoh Soal 4 :
A. Si dan Cl
B. Cl dan Ar
C. P dan S
D. S dan Cl
E. Ar dan S
Kunci Jawaban :
Argon terdapat di udara sebagai gas mulia (bebas) dan sulfur dijumpai di kawah gunung sebagai unsur bebas. Jadi, unsur periode ketiga yang terdapat bebas di alam ialah (E) Ar dan S.
5. Kesadahan
Air sadah (hard water) ialah air yang mengandung ion kalsium dan ion magnesium. Ada dua jenis kesadahan, yaitu kesadahan sementara dan kesadahan tetap. Kesadahan sementara ialah kesadahan yang disebabkan adanya garam bikarbonat dari magnesium dan kalsium, sedangkan kesadahan tetap ialah kesadahan yang disebabkan adanya garam sulfat, klorida, dan nitrat dari magnesium dan kalsium. Air sadah merugikan karena menyebabkan sabun tidak berbusa, bersifat mempercepat korosi, dan membentuk kerak pada peralatan logam. Bagaimanakah cara menghilangkan kesadahan? Untuk mengetahuinya, lakukanlah acara berikut.
Percobaan Kimia Sederhana 7 :
Menghilangkan Kesadahan
Tujuan :
Menyelidiki kesadahan air dan proses penghilangannya
Alat dan Bahan :
1. Gelas kimia 1 L
2. Pembakar spiritus
3. Batang pengaduk
4. Gelas ukur
5. Neraca
6. Air bebas mineral
7. Kalsium bikarbonat
8. Kalsium klorida
9. Larutan natrium karbonat 1 M
Sebelum memulai percobaan carilah informasi mengenai senyawa yang akan digunakan, mencakup sifat kimia senyawa, cara penggunaan, dan penanganannya.
Langkah Kerja :
1. Masukkan 5 gram serbuk kalsium bikarbonat ke dalam gelas kimia berisi 1 L air bebas mineral. Kemudian, aduk hingga semua larut.
2. Cuci tangan Anda memakai sabun dan air yang diperoleh pada langkah 1. Amati busa yang dihasilkan.
3. Panaskan air tersebut sebanyak 500 mL hingga mendidih selama 1 jam.
4. Dinginkan, kemudian pisahkan endapannya.
5. Selanjutnya, basuh tangan Anda memakai sabun dan larutan yang telah dipisahkan dari endapannya. Amati busa yang dihasilkan.
6. Masukkan 5 gram serbuk kalsium klorida ke dalam gelas kimia berisi air bebas mineral 1 L. Kemudian, aduk hingga semua larut. Cuci tangan Anda menggunakan sabun dan air yang diperoleh. Amati busa yang dihasilkan.
7. Tuangkan 50 mL natrium karbonat 1 M ke dalam 500 mL air sadah tetap. Aduk, kemudian biarkan hingga endapan terpisah. Pisahkan endapan dan larutan. Cuci tangan Anda memakai sabun dan larutan yang telah dipisahkan dari endapannya. Amati busa yang dihasilkan.
Jawablah pertanyaan berikut untuk menarik kesimpulan.
1. Apakah perbedaan antara kesadahan sementara dan kesadahan tetap?
2. Apakah tanda bahwa air mengandung air sadah?
3. Bagaimanakah cara menghilangkan kesadahan sementara?
4. Bagaimanakah cara menghilangkan kesadahan tetap?
Kerjakanlah secara berkelompok dan diskusikan hasil yang diperoleh.
Bandingkanlah kesimpulan yang Anda peroleh dengan klarifikasi berikut. Anda niscaya telah mengetahui perbedaan antara kesadahan sementara dan kesadahan tetap. Perbedaannya terletak pada kandungan anionnya. Kesadahan sementara mengandung ion bikarbonat, sedangkan kesadahan tetap mengandung ion sulfat, klorida, dan nitrat. Kesadahan air sanggup diamati dari busa sabun yang dihasilkan. Air yang bersadah busanya sedikit atau bahkan tidak menghasilkan busa. Kesadahan sementara sanggup dihilangkan dengan cara pemanasan. Pemanasan air sadah sementara menimbulkan garam bikarbonat akan terdekomposisi menjadi garam karbonat, gas karbon dioksida, dan air.
Ca(HCO3)2(aq) → CaCO3(s) + CO2(g) + H2O(l)
Mg(HCO3)2(aq) → MgCO3(s) + CO2(g) + H2O(l)
Bagaimana dengan kesadahan tetap? Air yang mengandung kesadahan tetap sanggup dihilangkan dengan beberapa cara, di antaranya pengendapan, kondensasi, dan penukar ion. Penghilangan kesadahan tetap dengan cara pengendapan merupakan cara yang banyak dipakai lantaran murah, mudah, dan praktis. Cara ini menghilangkan garam kalsium klorida atau magnesium klorida dengan cara membentuk endapan garam karbonat.
CaCl2(aq) + Na2CO3(aq) → CaCO3(s) + 2 NaCl(aq)
MgCl2(aq) + Na2CO3(aq) → MgCO3(s) + 2 NaCl(aq)
Cara lain menghilangkan kesadahan tetap ialah cara kondensasi dan resin penukar ion. Pada cara kondensasi, air sadah dididihkan, kemudian uapnya diembunkan. Uap yang dihasilkan telah bebas air sadah. Adapun dengan cara resin penukar ion, ion-ion yang terkandung dalam air sadah dihilangkan dengan cara pengikatan ion-ion penyebab kesadahan oleh resin penukar ion. Ada dua jenis resin penukar ion, yaitu resin penukar ion kasatmata (kation) dan resin penukar ion negatif (anion). Pada bidang industri, air sadah sangat merugikan. Ketika air yang mengandung ion Ca2+ dan HCO3– dipanaskan akan terbentuk endapan :
CaCO3.Ca2+(aq) + 2 HCO3–(aq) → CaCO3(s) + CO2(g) + H2O(l)
Pembentukan CaCO3 akan mengakibatkan terbentuknya lapisan pada dinding potongan dalam pipa boiler yang dikenal dengan nama boiler scale. Lapisan yang terbentuk pada dinding potongan dalam pipa boiler tersebut menyebabkan transfer panas terhambat sehingga sanggup mengurangi efisiensi dan daya tahan boiler. Menurut Anda, adakah laba dari air sadah ini? Bagaimana perilaku Anda kalau air di rumah Anda merupakan air sadah?
Catatan Kimia :
Kesadahan sementara adalah kesadahan yang disebabkan adanya garam bikarbonat dari magnesium dan kalsium, sedangkan kesadahan tetap adalah kesadahan yang disebabkan adanya garam sulfat, klorida, dan nitrat dari magnesium dan kalsium.
C. Kegunaan dan Pembuatan Unsur-Unsur Kimia dan Senyawanya
1. Non Logam
Unsur-unsur yang termasuk nonlogam, di antaranya oksigen, nitrogen, karbon, dan fosfor. Tahukah Anda kegunaan dari unsur-unsur tersebut? Bagaimanakah cara mendapatkannya?
a. Oksigen
Di alam, unsur oksigen terdapat dalam bentuk gas oksigen. Gas oksigen diperlukan dalam pembakaran dan proses metabolisme tubuh. Pada bidang industri, oksigen dipakai sebagai zat pengoksidasi dan materi baku pembuatan banyak sekali senyawa. Gas oksigen dipakai oleh penyelam, antariksawan, dan penderita penyakit tertentu untuk pernapasan. Campuran gas oksigen dan nitrogen cair dipakai sebagai materi bakar roket untuk mendorong pesawat ruang angkasa.
Pembuatan gas oksigen di laboratorium dilakukan dengan cara memanaskan KClO3 dengan memakai katalis MnO2.
 |
| Gambar 3. Pembuatan gas oksigen di laboratorium. |
2 KClO3(s) → 2 KCl(s) + 3 O2(g)
Adapun pembuatan gas oksigen pada skala industri dilakukan dengan cara distilasi bertingkat.
b. Nitrogen
Unsur nitrogen biasa dipakai sebagai pupuk, misalnya:
1. Pupuk urea, CO(NH2)2, mengandung 46 % nitrogen
2. Pupuk ZA (zwafel amonium), (NH4)2SO4, mengandung 21 % nitrogen
3. Pupuk amonia atau NH3
4. Pupuk amonium nitrat atau NH4NO3
5. Pupuk kalium nitrat atau KNO3
Pembuatan gas nitrogen di laboratorium dilakukan dengan cara menguraikan amonium nitrit melalui pemanasan.
NH4NO2(s) → 2 H2O(g) + N2(g)
Pada skala industri, gas nitrogen diperoleh dengan cara distilasi bertingkat udara cair. Mula-mula, udara disaring untuk membersihkan dari debu. Setelah itu, udara higienis dimampatkan sehingga suhu meningkat, kemudian dilakukan pendinginan. Pada tahap ini, air dan karbondioksida sudah mencair dan sanggup dipisahkan dengan cara mengalirkan melalui beberapa menara pendingin. Menara-menara pendingin ini mempunyai ukuran yang berbeda-beda. Mula-mula, udara dialirkan ke menara kecil, kemudian dialirkan ke menara yang lebih besar sehingga udara turun dan sebagian udara akan mencair. Udara yang belum mencair disirkulasikan lagi dengan cara dialirkan kembali ke dalam kompresor.
Selain dipakai sebagai pupuk, nitrogen juga dipakai sebagai bahan baku pembuatan amonia pada skala industri. Amonia dipakai sebagai bahan pengawet dalam masakan kemasan untuk memperpanjang masa penggunaan dan sebagai materi pendingin. Amonia diperoleh melalui proses Haber-Bosch.
N2(g) + 3 H2(g) ↔ 2 NH3(g) ΔH = –92,4 kJ/mol
 |
| Gambar 4. Proses pembuatan amonia melalui proses Haber-Bosch. |
Pembuatan amonia di laboratorium dilakukan dengan cara mereaksikan amonium klorida dengan natrium hidroksida.
NH4Cl(aq) + NaOH(aq) → NaCl(aq) + H2O(l) + NH3(g)
c. Karbon
Pernahkah Anda melihat pensil, intan, dan arang untuk memperabukan sate? Ketiga benda tersebut tersusun atas unsur yang sama, yaitu unsur karbon. Bentuk-bentuk yang berbeda dari unsur yang sama disebut alotrop. Meskipun arang, pensil, dan intan tersusun atas unsur yang sama, tetapi mempunyai sifat yang berbeda.
Intan sanggup dipakai sebagai perhiasan, alat pemotong kaca, mata bor, dan sebagai ampelas benda yang sangat keras, menyerupai baja tahan karat. Intan memiliki kegunaan menyerupai itu lantaran sifat-sifatnya. Intan merupakan zat padat yang bening berkilauan dan merupakan zat yang sangat keras. Selain intan alami, ada juga intan buatan yang dibentuk dari grafit melalui pemanasan pada suhu 3.300 °C dan tekanan 125.000 atm.
Grafit dipakai sebagai anode dalam kerikil baterai dan banyak sekali proses industri yang memakai elektrolisis. Grafit sanggup pula dipakai sebagai bahan baku pembuatan pensil. Penggunaan lain dari grafit ialah sebagai bahan pelumas dan komponen dalam pembuatan paduan material (komposit). Grafit mempunyai kegunaan menyerupai yang telah dituliskan lantaran sifatnya, yaitu berwarna hitam, buram, sanggup menghantarkan listrik, gampang dihancurkan menjadi serbuk, licin, dan tahan panas.
Arang sanggup dipakai sebagai obat sakit perut. Arang mempunyai sifat mengadsorpsi (menjerap) sehingga sanggup dipakai untuk mengadsorpsi zat warna dan materi polutan lain dalam pengolahan air serta mengadsorpsi zat warna yang terdapat dalam air tebu pada pengolahan gula. Tahukah Anda, bagaimana cara memperoleh arang?
d. Fosfor
Ada dua jenis unsur fosfor, yaitu fosfor putih dan fosfor merah. Fosfor putih dibentuk dengan cara memanaskan batuan fosfat, pasir, dan kokas. Adapun fosfor merah dibentuk dengan cara memanaskan fosfor putih pada suhu 240 °C. Sebagian besar fosfor putih dipakai untuk menciptakan asam fosfat. Fosfor merah dipakai untuk menciptakan korek api jenis safety matches, yaitu korek api biasa.
Unsur fosfor juga sanggup dipakai untuk menciptakan senyawa fosfat, misalnya asam fosfat dan natrium trifosfat. Asam fosfat banyak digunakan untuk menciptakan pupuk super fosfat. Selain itu, asam fosfat dipakai sebagai bahan detergen, materi pembersih lantai, insektisida, dan masakan hewan. Senyawa natrium trifosfat dan Ca(H2PO4)2 dipakai dalam detergen dengan tujuan untuk mengikat ion-ion kalsium/magnesium dari air sadah.
Namun, di balik kegunaannya, senyawa fosfat menimbulkan dampak negatif bagi lingkungan. Penggunaan senyawa fosfat akan menyuburkan pertumbuhan eceng gondok dan ganggang. Jika tumbuhan ini mati, reaksi pembusukannya akan menghabiskan oksigen terlarut sehingga mengganggu kehidupan binatang air.
e. Sulfur (Belerang)
Sulfur terdapat di alam berupa mineral, menyerupai gips (CaSO4.2H2O) dan pirit (FeS2). Sulfur juga terdapat di alam berupa gas, menyerupai H2S dan SO2. Sulfur dipakai antara lain dalam pembuatan pupuk, insektisida, fungisida, dan beberapa jenis peledak. Penggunaan sulfur paling banyak adalah pada pembuatan asam sulfat. Asam sulfat diperoleh melalui proses kontak dengan memakai katalis vanadium(V) oksida.Berikut persamaan reaksi pada proses kontak.
S(s) + O2(g) → SO2(g) ΔH = –297 kJ/mol
V2O5
2 SO2(g) + O2(g) ↔ 2 SO3(g) ΔH = –191 kJ/mol
SO3(g) + H2SO4(l) → H2S2O7(l)
H2S2O7(l) +H2O(l) → 2 H2SO4(l)
 |
| Gambar 5. Pembuatan asam sufat melalui proses kontak. |
2. Logam
Sebagian besar unsur-unsur kimia merupakan logam, menyerupai besi, aluminium, dan timah. Apakah kegunaan dari logam? Bagaimanakah cara mendapatkannya?
a. Kegunaan Logam
Besi ialah logam yang paling banyak kegunaannya. Besi banyak digunakan untuk menciptakan baja. Baja yang dihasilkan sering dipakai untuk membuat mainan anak, perkakas dapur, industri kendaraan, konstruksi bangunan, jembatan, dan rel kereta api. Ada juga baja yang dipakai untuk membuat gunting, obeng, kunci, sendok, dan panci. Baja yang digunakan untuk menciptakan perkakas-perkakas tersebut ialah baja tahan karat. Pernah mendengar stainless steel? Stainless steel merupakan paduan antara besi, kromium (14–18 %) dan nikel (7–9 %). Sifatnya yang keras dan liat membuat stainles steel dipakai untuk menciptakan senjata dan kawat.
Aluminium dipakai sebagai materi baku pembuatan kolam truk, komponen kendaraan bermotor, tubuh pesawat terbang, kusen pintu dan jendela. Benda lain yang memanfaatkan aluminium, di antaranya kemasan berbagai jenis produk makanan, kabel listrik, perabotan rumah tangga, dan barang kerajinan.
Selain dalam bentuk logam, aluminium juga banyak dipakai dalam bentuk senyawanya, contohnya tawas dan alumina. Tawas yang memiliki rumus kimia KSO4Al2(SO4)3.24H2O dipakai sebagai penjernih pada pengolahan air minum. Bagaimana dengan alumina? Senyawa yang memiliki rumus kimia Al2O3 ini terdapat dalam dua bentuk, yaitu alfa-alumina dan gama-alumina. Gama-alumina diperoleh dari pemanasan Al(OH)3 pada suhu di bawah 500 °C, sedangkan alfa-alumina diperoleh dari pemanasan Al(OH)3 pada suhu di atas 1.000 °C. Gama-alumina dipakai sebagai materi baku pembuatan aluminium, pasta gigi, keramik, dan gelas. Adapun alfa-alumina yang sanggup ditemukan di alam sebagai korundum dipakai untuk ampelas atau gerinda. Beberapa jenis kerikil mulia, menyerupai rubi, safir, dan topaz merupakan alfa-alumina yang mengandung senyawa unsur logam transisi yang memberi warna pada kerikil tersebut. Rubi berwarna merah karena mengandung senyawa kromium(III), safir berwarna biru karena mengandung senyawa besi(II), besi(III), dan titan(IV), sedangkan topaz berwarna kuning lantaran mengandung besi(III).
Logam-logam lainnya ialah timah, nikel, tembaga, perak, dan emas. Timah dipakai untuk menciptakan kaleng (tin plate) banyak sekali macam produk dan melapisi kaleng yang terbuat dari besi sehingga mencegah besi berkarat.
Kegunaan lain timah ialah untuk menciptakan logam campur, misalnya perunggu (paduan timah, tembaga, seng) dan solder (paduan timah dan timbal). Nikel dipakai untuk melapisi barang yang terbuat dari besi, tembaga, dan baja lantaran nikel mempunyai sifat keras, tahan korosi, dan gampang mengilap jika digosok. Kegunaan lain dari nikel ialah untuk menciptakan paduan dengan tembaga dan beberapa logam lain, contohnya monel (paduan Ni, Cu, Fe), nikrom (paduan Ni, Fe, Cr), dan alniko (paduan Al, Ni, Fe, Co).Tembaga banyak dipakai sebagai kawat listrik dan logam paduan.
Beberapa logam paduan yang mengandung tembaga antara lain kupronikel (75% Cu dan Ni 25%) dipakai untuk menciptakan koin, duralium (Al 96% dan Cu 4%) dipakai untuk komponen pesawat, dan kuningan (Cu 70% dan Zn 30%) dipakai sebagai materi alat musik dan banyak sekali aksesoris.
Istilah emas dan perak tentu sudah tidak gila lagi bagi olahragawan. Emas dan perak biasanya dipakai sebagai materi medali pemenang kejuaraan. Selain untuk medali, perak dipakai juga sebagai perkakas perak, barang kerajinan, dan perhiasan. Senyawa perak, menyerupai perak bromida dan perak iodida dipakai untuk pembuatan film dan kertas foto. Senyawa ini gampang terurai kalau terkena cahaya, menghasilkan perak yang menyebabkan terbentuknya bayangan pada negatif foto. Adapun kegunaan utama emas ialah sebagai perhiasan dan mata uang.
b. Pengolahan Logam
Logam-logam diperoleh atau dibentuk dengan teknik yang dinamakan metalurgi, yaitu proses pengolahan bahan-bahan alam menjadi logam. Bahan-bahan alam tersebut ditemukan di kerak bumi dan dikenal dengan istilah mineral, contohnya pirit, bauksit, dan aluminosilikat. Adapun mineral yang dapat dijadikan sumber untuk memproduksi logam secara komersial disebut bijih logam. Bijih logam biasanya berupa oksida, sulfida, karbonat, silikat, halida, dan sulfat.
Pada industri metalurgi pengolahan bijih terbagi atas tiga tahapan, yaitu pemekatan bijih, peleburan, dan pemurnian. Selain mengandung logam, bijih logam juga mengandung batuan tak berharga yang disebut batureja. Untuk itulah bijih logam dipekatkan untuk menghilangkan sebanyak mungkin batureja. Bijih dihancurkan dan digiling sehingga butiran terlepas dari batureja. Selanjutnya, logam dipisahkan dengan cara fisis, seperti pengapungan (flotasi) dan penarikan dengan magnet.
Peleburan (melting) ialah proses reduksi bijih menjadi unsur logam dengan memakai reduktor maupun elektrolisis. Zat reduktor yang dapat digunakan ialah karbid, hidrogen, logam aktif atau dengan cara elektrolisis. Pemilihan reduktor ini bergantung pada kereaktifan setiap zat. Semakin reaktif logam, semakin sukar direduksi sehingga dibutuhkan reduktor yang lebih kuat. Logam yang kereaktifannya kecil, menyerupai tembaga dan emas dapat direduksi hanya dengan pemanasan. Logam dengan kereaktifan sedang, menyerupai besi, nikel, dan timah, sanggup direduksi dengan menggunakan karbon. adapun logam yang kereaktifannya tinggi, menyerupai magnesium dan aluminium, sanggup direduksi dengan elektrolisis. Untuk mengikat pengotor seringkali ditambahkan fluks. Fluks ialah suatu materi yang sanggup mengikat pengotor dan menghasilkan zat yang gampang mencair (terak).
Tahap terakhir ialah pemurnian (refining) logam. Ada beberapa cara pemurnian, di antaranya elektrolisis, distilasi, peleburan ulang, dan pemurnian zona. Elektrolisis biasanya dipakai untuk memurnikan tembaga dan nikel.
Phytomining (proses penambangan logam dengan menggunakan tanaman) telah dicoba di California, tanaman Streptanthus polygaloides ditanam pada tanah yang banyak mengandung nikel. Tanaman tersebut menyerap nikel hingga 1% dari massa keringnya. Tanaman dibakar menjadi bubuk (bio-ores), lalu dilebur untuk menghasilkan logamnya (nikel). Proses pembakaran tumbuhan menjadi abu menghasilkan energi yang digunakan untuk menjalankan generator listrik pada proses ekstraksi. Para peneliti sedang mengembangkan kemungkinan phytomining untuk logam, seperti talium, timbal, kobalt, dan emas.
Adapun proses distilasi dipakai untuk memurnikan seng dan raksa. Sedangkan proses peleburan ulang dipakai untuk memurnikan besi. Berikut ini akan diuraikan beberapa pengolahan logam, menyerupai besi, aluminium, timah, dan tembaga.
1) Pengolahan besi
Pengolahan besi terdiri atas dua tahap, yaitu peleburan untuk mereduksi bijih besi sehingga menjadi besi dan peleburan ulang untuk menciptakan baja. Peleburan besi dilakukan dalam blast furnance. Blast furnance ialah suatu bangunan yang tingginya sekitar 30 meter dan mempunyai diameter sekitar 8 meter. Blast furnance terbuat dari baja tahan karat yang dilapisi dengan bata tahan panas. Pereduksi yang dipakai ialah karbon.
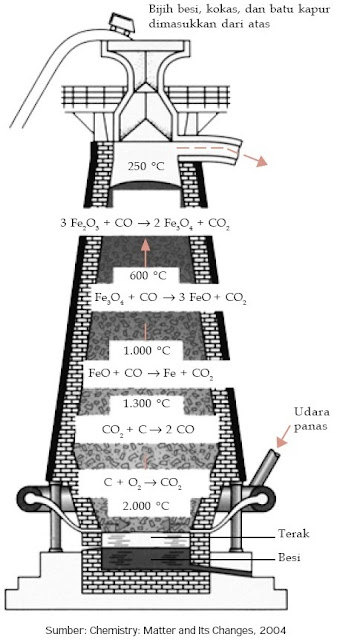 |
| Gambar 6. Pengolahan besi dari bijihnya. |
2 Fe2O3(s) + 3 C(s) → 4 Fe(s) + 3 CO2(g)
Ke dalam blast furnance dimasukkan bijih besi yang terkontaminasi pasir, karbon (kokas) sebagai zat pereduksi, dan kerikil kapur (CaCO3) untuk mengikat kotoran pasir. Suhu reaksi yang tinggi mengakibatkan besi mencair. Besi ini disebut besi cair atau besi gubal (pig iron).
Besi cair dialirkan ke dalam cetakan untuk menciptakan besi tuang (cast iron) yang mengandung 3–4% karbon dan sedikit pengotor lain, menyerupai Mn, Si, P. Besi yang mengandung karbon sangat rendah (0,005–0,2%) disebut besi tempa (wrought iron).
Batu kapur berfungsi untuk mengikat pengotor yang bersifat asam, seperti SiO2 membentuk terak. Mula-mula, kerikil kapur terurai membentuk kalsium oksida (CaO) dan karbon dioksida (CO2).
CaCO3(s) → CaO(s) + CO2(g)
Kemudian, kalsium oksida bereaksi dengan pasir membentuk kalsium silikat yang merupakan komponen utama dalam terak.
CaO(s) + SiO2(s) → CaSiO3(l)
Terak ini mengapung di atas besi cair dan harus dikeluarkan dalam selang waktu tertentu.
Besi lebih anggun kalau dipakai dalam bentuk baja lantaran baja tahan korosi. Baja sanggup dibentuk dengan cara peleburan ulang besi gubal. Mula-mula, kadar karbon dalam besi gubal diturunkan dari 3–4% menjadi 0–1,5%. Caranya, yaitu mengoksidasikannya dengan oksigen. Kemudian, Si, Mn, P, serta pengotor lain dibuang dengan cara menciptakan terak. Terakhir, ke dalam lelehan besi ditambahkan logam, menyerupai Cr, Ni, Mn,V, Mo, dan W sesuai dengan jenis baja yang diinginkan. Penambahan logam ini untuk mencegah pengaratan pada baja. Pencegahan pengaratan baja juga sanggup dilakukan dengan menggunakan lapisan pelindung, memakai logam yang dapat dikorbankan, atau melindunginya secara katodik.
Legenda Kimia :
Sir Henry Bessemer
Sir Henry Bessemer (1813 – 1898) membuat perubahan besar dalam proses mengubah besi cor langsung menjadi baja dengan memperabukan campuran ini dalam alat konservasi baja yang dibuatnya. Proses yang lebih singkat dan biaya produksi yang lebih rendah membuat baja langsung tersedia dalam jumlah besar untuk pertama kalinya. (Sumber: Jendela IPTEK: Kimia, 1993)
2) Pengolahan aluminium
Pengolahan aluminium dilakukan dengan proses Hall-Heroult. Proses ini terdiri atas 2 tahap, yaitu pemurnian bauksit untuk memperoleh alumina murni dan peleburan/reduksi alumina dengan elektrolisis. Dalam pemurnian bauksit, bauksit direaksikan dengan NaOH membentuk NaAl(OH)4.
Kemudian, larutan disaring dan filtrat yang mengandung NaAl(OH)4 diasamkan dengan mengalirkan gas CO2. Aluminium akan mengendap sebagai Al(OH)3. Terakhir, Al(OH)3 disaring, dikeringkan, dan dipanaskan sehingga diperoleh Al2O3 yang tidak berair.
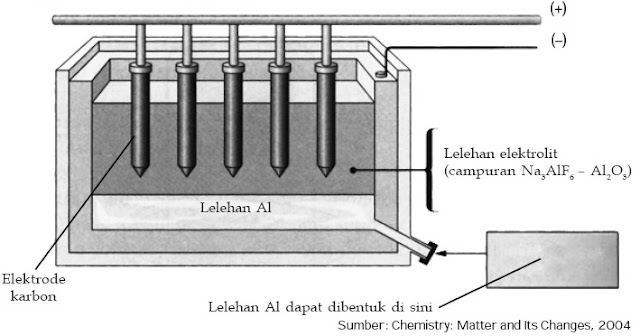 |
| Gambar 7. Elektrolisis aluminium. |
Tahap selanjutnya ialah peleburan alumina memakai sel elektrolisis. Sel ini terdiri atas wadah besi berlapis grafit yang sekaligus berfungsi sebagai katode, sedangkan yang bertindak sebagai anode adalah grafit. Campuran Al2O3 dan kriolit (Na3AlF6) dipanaskan hingga mencair sampai pada suhu 950 °C untuk kemudian dielektrolisis.
2 Al2O3(l) + 3 C(s) → 4 Al(l) + 3 CO2(g)
Aluminium yang dihasilkan berwujud cair dan terkumpul di dasar wadah. Lelehan aluminium kemudian dikeluarkan secara periodik ke dalam cetakan untuk menghasilkan aluminium batangan.
3) Pengolahan timah
Seperti halnya pengolahan logam lainnya, tahap awal pengolahan timah adalah pemekatan. Setelah dipekatkan, bijih timah dipanggang hingga arsenik dan sulfur terpisahkan dalam bentuk oksida-oksida yang mudah menguap. Kemudian, bijih timah yang telah dipisahkan itu direduksi dengan menggunakan karbon. Timah cair yang terkumpul di dasar tanur kemudian dialirkan ke dalam cetakan untuk mendapat timah batangan. Oleh karena timah ini masih tergolong garang maka perlu dimurnikan. Pemurnian timah dapat dilakukan dengan dua teknik, yaitu High Tention Separator dan Magnete Separator.
4) Pengolahan tembaga
Bijih tembaga dihaluskan dengan alat peremuk batuan. Bijih dicampur air sehingga terbentuk slurry (bubur), kemudian dimasukkan ke tangki sel flotasi agar terpisah dari mineral pengotor. Akhirnya, diperoleh konsentrat Cu dalam bentuk logam Cu dengan kadar tinggi.
Proses selanjutnya ialah penghilangan air yang dilakukan dalam pabrik dewatering plant. Tahap karenanya ialah ekstraksi tembaga murni dari konsentrat tembaga dengan cara elektrolisis (dengan arus listrik).
D. Penentuan Kadar Unsur Kimia dalam Suatu Produk
1. Bahan Pemutih
Bahan kimia yang biasa dipakai sebagai pemutih pakaian adalah natrium hipoklorit dan hidrogen peroksida. Kedua materi kimia ini berwujud cair dan bersifat multifungsi. Selain sebagai pemutih, natrium hipoklorit dan hidrogen peroksida sanggup juga dipakai sebagai desinfektan. Natrium hipoklorit lebih banyak dipakai daripada hidrogen peroksida. Kadar natrium hipoklorit sanggup ditentukan dengan cara titrasi. Bagaimana caranya? Lakukanlah acara berikut.
Percobaan Kimia Sederhana 8 :
Penentuan Kadar Natrium Hipoklorit dalam Bahan Pemutih
Tujuan :
Menentukan kadar natrium hipoklorit dalam materi pemutih
Alat dan Bahan :
1. Buret
2. Erlenmeyer
3. Botol semprot
4. Tisu
5. Cairan pemutih pakaian
6. Kalium iodida (KI)
7. Larutan Na2S2O3 0,1 M
8. Larutan amilum 2%
9. Larutan H2SO4 1 M
Sebelum memulai percobaan carilah informasi mengenai senyawa yang akan digunakan, mencakup sifat kimia senyawa, cara penggunaan, dan penanganannya.
Langkah Kerja :
1. Encerkan cairan pemutih pakaian sebanyak 10–15 kali.
2. Isi buret dengan larutan Na2S2O3 0,1 M. Tuangkan sebanyak 25 mL cairan pemutih ke dalam labu erlenmeyer.
3. Tuangkan 5 mL H2SO4 1 M dan masukkan 1 g KI ke dalam labu erlenmeyer, lalu goyang-goyang hingga larut.
4. Titrasi dengan Na2S2O3 0,1 M hingga larutan berwarna kuning.
5. Tambahkan 5 mL amilum 2%. Kocok, kemudian lanjutkan titrasi hingga terjadi perubahan warna larutan dari biru menjadi tidak berwarna.
6. Ulangi langkah kerja nomor 1–4.
7. Catat hasil pengamatan Anda pada tabel berikut.
Titrasi | Volume Na2S2O3 (mL) | Volume Cairan Pemutih (mL) |
8. Gunakan rumus perhitungan berikut untuk memilih konsentrasi natrium hipoklorit.
V Na2S2O3 × N Na2S2O3 = V NaOCl × N NaOCl
9. Tentukan massa NaClO dalam larutan.
10. Tentukan kadar massa per volume NaClO dalam cairan pemutih.
11. Carilah informasi kadar massa per volume NaClO dalam cairan pemutih, lalu bandingkan dengan hasil yang Anda peroleh.
Kerjakanlah secara berkelompok dan diskusikanlah hasil yang Anda peroleh.
2. Pupuk
Tanaman membutuhkan unsur-unsur N, P, dan K untuk pertumbuhannya. Nitrogen dibutuhkan untuk protein pada daun dan batang, fosfor diperlukan untuk mempercepat pertumbuhan akar dan pematangan buah, dan kalium berkhasiat untuk melindungi tumbuhan dari penyakit. Tanaman tidak selalu memperoleh unsur-unsur N, P, dan K dari dalam tanah. Oleh lantaran itu, petani biasanya menaburkan pupuk untuk memperoleh kualitas tumbuhan yang baik.
Amonia cair sanggup dipakai eksklusif sebagai pupuk dengan cara penyuntikan pada tanah. Akan tetapi, cara ini mempunyai beberapa kekurangan. Amonia akan mengakibatkan tanah menjadi bersifat basa dan nitrogen menjadi berkurang lantaran adanya penguapan gas amonia. Akan lebih mudah untuk membuatkan pupuk dalam bentuk padatan. Untuk mendapatkan pupuk nitrogen yang berupa padatan, kita sanggup mereaksikan amonia dan asam. Ingatkah Anda bahwa garam sanggup terbentuk dari reaksi asam dan basa?
Asam sulfat sanggup menetralisasi larutan amonia menghasilkan garam amonia sulfat.
2 NH3(aq) + H2SO4(aq) → (NH4)2SO4(aq)
Unsur nitrogen di dalam pupuk sanggup diperoleh dari pupuk amonium sulfat (NH4)2SO4, amonium nitrat NH4NO3, dan urea CO(NH2)2. Untuk menentukan kadar unsur tersebut dalam pupuk, perhatikanlah teladan berikut.
Contoh Soal 5 :
Tentukan massa nitrogen pada 100 kg pupuk urea (CO(NH2)2).
Kunci Jawaban :
Untuk menghitung massa unsur dalam suatu senyawa, perlu diketahui persentasenya terlebih dahulu.
massa nitrogen = 46,67 kg
Jadi, massa nitrogen pada 100 kg pupuk urea ialah 46,67 kg.
Contoh Soal 6 :
Kunci Jawaban :
= 45 gram
Jadi, Kemurnian pupuk urea (CO(NH2)2) ialah 90%.
Rangkuman :
1. Unsur-unsur kimia di alam terbagi atas unsur logam dan nonlogam.
2. Unsur logam contohnya besi, aluminium, tembaga, emas, dan perak. Unsur-unsur logam didapatkan dari penambangan mineral-mineralnya di kulit bumi. Kegunaan unsur-unsur logam di antaranya:
a. materi baku baja;
b. industri kendaraan;
c. konstruksi bangunan;
d. perabot rumah tangga; dan
e. tubuh pesawat terbang.
3. Unsur nonlogam contohnya nitrogen, oksigen, sulfur, helium, dan fosfor. Unsur nonlogam diperoleh dengan cara pemisahan menyerupai distilasi dan ekstraksi. Kegunaan unsur-unsur nonlogam di antaranya:
a. pembuatan pupuk;
b. industri; dan
c. metabolisme tubuh.
4. Setiap unsur mempunyai sifat fisis dan sifat kimia sendiri yang membedakannya dengan unsur lainnya.
5. Sifat fisis menjelaskan bentuk fisik unsur tersebut, seperti titik leleh, titik didih, warna, kelenturan, konduktivitas listrik, dan kerapuhan.
6. Sifat kimia suatu zat mencakup bagaimana suatu unsur sanggup bereaksi dengan unsur lainnya, kecepatan reaksi kalau bereaksi dengan unsur lain, jumlah panas yang dihasilkan dari suatu reaksi dengan unsur lain, dan suhu ketika terjadi reaksi.
7. Unsur golongan alkali dan alkali tanah dapat diidentifikasi melalui warna nyala api yang dihasilkan ketika unsur tersebut dibakar.
8. Air sadah (hard water) ialah air yang mengandung ion kalsium dan ion magnesium. Ada dua jenis kesadahan, yaitu kesadahan sementara dan kesadahan tetap. Di bidang industri, air sadah menimbulkan kerugian.
Anda kini sudah mengetahui Unsur Kimia. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Rahayu, Imam. 2009. Praktis Belajar Kimia untuk Kelas XII Sekolah Menengah Atas/Madrasah Aliyah Program Ilmu Pengetahuan Alam. Pusat Perbukuan, Departemen Pendidikan Nasional, p. 194.
Anda kini sudah mengetahui Unsur Kimia. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Rahayu, Imam. 2009. Praktis Belajar Kimia untuk Kelas XII Sekolah Menengah Atas/Madrasah Aliyah Program Ilmu Pengetahuan Alam. Pusat Perbukuan, Departemen Pendidikan Nasional, p. 194.

No comments:
Post a Comment