Jurnal Identifikasi Bakteri Penghasil Kitinase - Kitinase yakni enzim yang bisa menghidrolisis kitin (polimer dari ß-1,4 N-asetil-D-glukosamin) yang merupakan suatu polisakarida kedua terbanyak di alam setelah selulosa. Kitin sebagai polimer yang terdapat melimpah di tanah, mempunyai struktur dan karakteristik yang unik.
ISSN 1410-9379, Keputusan Akreditasi No 65a/DIKTI/Kep./2008
*Telp: +628129612170
Email: ceuceu_lipi@yahoo.com
Seleksi, Karakterisasi, dan Identifikasi Bakteri Penghasil Kitinase
yang Diisolasi dari Gunung Bromo Jawa Timur
Yati Sudaryati Soeka*) dan Sulistiani
Bidang Mikrobiologi, Puslit Biologi-LIPI, Jalan Raya Bogor Km 46, Cibinong 16911
Diterima 28-05-2009 Disetujui 18-10-2010
ABSTRACT
Selection, characterization and identification of bacteria that can produce chitinase enzyme were isolated from Bromo Mountain, East Java. The 48 isolates were tested for capability to degrade chitine qualitatively, semi quantitatively and quantitatively. The result showed that 2 isolates, B2-4 and NA S4-1 could degrade chitin, with activities of 4.8. 10-3 and 3.1 . 10-3 U/ml, after 1 and 2 days incubation respectively. By using molecular characterization methods, partial sequences of 16S rDNA and the primers 9F & 1510R were identified as Stenotrophomonas sp.
Keywords: chitinase, Stenotrophomonas sp
PENDAHULUAN
Gunung Bromo merupakan Gunung berapi yang masuk dalam wilayah Taman Nasional Bromo Tengger Semeru. Taman nasional ini merupakan satu-satunya kawasan konservasi di Indonesia yang memiliki keunikan berupa bahari pasir seluas 5,250 hektar, yang berada pada ketinggian ± 2,100 meter dari permukaan laut. Terletak dalam daerah Kabupaten Pasuruan, Kabupaten Probolinggo, Kabupaten Lumajang, dan Kabupaten Malang, Provinsi Jawa Timur (Dephut, 2007).
Keanekaragaman hayati di taman nasional ini diantaranya beberapa jenis tumbuhan antara lain: Jamuju (Dacrycarpus imbricatus), Cemara gunung (Casuarina sp.), Eidelweis (Anaphalis javanica), berbagai jenis anggrek dan jenis rumput langka (Styphelia pungieus). Terdapat sekitar 137 jenis burung, 22 jenis mamalia dan 4 jenis reptilia di taman nasional ini. Namun demikian isu mengenai keanekaragaman hayati mikroba masih sangat kurang. Dalam penelitian ini telah dilakukan isolasi dan identifikasi basil air diwilayah Gunung Bromo dari beberapa tempat dengan ketinggian yang berbeda. Penelitian ini bertujuan untuk mengetahui kemampuan isolat basil tersebut dalam menghasilkan enzim kitinase. Isolat yang positif kemudian dikarakterisasi secara fenotipik dan molekuler, dengan analisis sekuen 16S rDNA (Don & Brenner et al., 2003).
Kitinase yakni enzim yang bisa menghidrolisis kitin (polimer dari ß-1,4 N-asetil-D-glukosamin) yang merupakan suatu polisakarida kedua terbanyak di alam setelah selulosa. Kitin sebagai polimer yang terdapat melimpah di tanah, mempunyai struktur dan karakteristik yang unik.
Banyak binatang dan mikroorganisme menjadi penyumbang ketersediaan kitin di dalam tanah (Yurnaliza, 2008). Hasil hidrolisis kitin berupa senyawa kitooligosakarida bermanfaat dalam dunia kesehatan karena mempunyai acara anti tumor. Dalam bidang pertanian, kitinase dan mikroorganisme penghasilnya berperan sebagai biro pengendali hayati penyakit tanaman yang disebabkan oleh jamur. Kitinase menyebabkan terjadinya lisis pada dinding sel jamur yang umumnya mengandung kitin (Patil et al., 2000).
Kitinase sangat menjanjikan untuk dimanfaatkan sebagai biopestisida yang kondusif dan ramah lingkungan lantaran kitinase sanggup mendegradasi kitin yang merupakan komponen pada eksoskeleton serangga, nematoda dan dinding sel jamur (Terayama et al., 1993). Kitinase juga berperan sebagai biro biokonversi limbah kitin menjadi protein sel tunggal (Kobayashi et al., 1975) atau senyawa turunannya (Rattanakit et al., 2002).
Dengan banyaknya fungsi dari kitinase, penelitian ini bertujuan untuk mendapat isolat unggul penghasil kitinase untuk dikoleksi LIPI-MC.
BAHAN DAN METODE
Pengambilan Sampel. Pengambilan sampel penelitian ini dilakukan di Gunung Bromo. Lokasi, waktu pengambilan sampel dan parameter lingkungan diuraikan dalam Tabel 1.
Tabel 1. Lokasi, waktu pengambilan sampel dan parameter lingkungan
Sumber sampel | Ketinggian (m) | Tekanan (mbar) | Temperatur (°C) | Koordinat | Nama lokasi | Keterangan detail sampel |
Air embun | 2786 | 732 | 11 | 07°54.239S 112°57.081E | Ds. Penanjakan, Kec. Tosari Kab. Pasuruan | Embun yang menggantung diujung daun cemara |
Air tanah | 2757 | 739 | 13 | 07°54. 187S 112°57.018E | Ds. Penanjakan, Kec. Tosari Kab. Pasuruan | Sumber air pegunungan |
Air tanah | 2241 | 781 | 22 | 07°55. 333S 112°57.829E | Dsn. Cemoro Lawang, Ds. Ngadisari, Kec Sukapura Kab. Probolinggo | Air kran Hotel Cemara Indah yang berasal dari sumber air tanah |
Air tanah | 1215 | 879 | 26 | 07°54.740S 113°02.189E | Ds Sapi kerep, Kec. Sukapura, Kab. Probolinggo | Air kran rumah penduduk yang berasal dari sumber air tanah |
Isolasi dan Pengamatan Bakteri. Pembuatan media supaya NA : Nutrient supaya 100% (NA): 23 g NA, akuades 1 liter dan Nutrien supaya 20% (1/10 NA): 2,3 g NA, supaya 12,7g, akuades 1 liter disterilkan menggunakan autoklaf. Isolasi dilakukan dengan metoda cawan sebar. Sample (air embun dan air tanah) diencerkan dengan akuades steril di mikrotube, divortek supaya homogen kemudian ditumbuhkan dengan cara sebar permukaan di 2 macam media, media Nutrient Agar 100% (NA) dan media nutrient supaya 20% (1/10 NA). Diinkubasi selama 3 hari dan dilakukan penghitungan jumlah bakteri. Bakteri yang mempunyai morfologi berbeda diambil dan dilakukan pemurnian lebih lanjut (Pelczar & Chan, 2005).
Preparasi Koloidal Kitin. Ditimbang sebanyak 20 g kitin dari kulit udang ditambah 400 ml HCl pekat, distirer selama 2 jam kemudian diinkubasi di dalam lemari pendingin selama 24 jam. Larutan tersebut disaring dengan glass wool, filtratnya ditambah akuades steril cuek dan dinetralkan dengan 10 N NaOH sampai pH 7,0. Larutan disentrifugasi dengan kecepatan 7,780 g selama 10 menit dan endapannya diambil. Endapan dibilas dengan akuades steril dan disentrifugasi lagi dengan kecepatan 7,780 g selama 10 menit. Endapan yang berupa koloidal kitin disimpan di dalam lemari pendingin (Widhyastuti, 2007).
Media Seleksi. Media kitin supaya (koloidal kitin 1%, pepton 0,1%, KH2PO4 0,1%, MgSO4.7H2O 0,05%, agar 2%) digunakan untuk menyeleksi basil murni yang dapat merombak kitin dituangkan dalam cawan petri. Inkubasi dilakukan pada suhu kamar selama 3 hari. Hasil pengujian secara kualitatif memperlihatkan bahwa isolat yang mempunyai acara kitinase ditandai dengan adanya zona bening disekitar koloni.
Media kultur bakteri. Isolat yang menghasilkan aktivitas kitinase tertinggi dengan waktu inkubasi tertentu yang digunakan untuk perlakuan selanjutnya. Dalam perlakuan selanjutnya menginokulasikan mikroba dalam media kultur basil Luria Bertani (pepton 1%, ekstrak ragi 0,5%, dan NaCl 0,1%) pada pH 7,2 diinkubasi selama 1 hari pada suhu kamar di atas pengocok double shaker NR-150 dengan kecepatan 120 rpm (Mahata et al., 2008). Sebanyak 0,5 ml dipipet masing-masing dimasukkan ke dalam 25 ml media cair kitin 1% dengan variasi pH bufer (pH 3-9). Larutan bufer yang digunakan yakni 0,05 M bufer asetat (pH 3, 4, 5), 0,05 M bufer fosfat (pH 5, 6, 7, 8), pH 7 dalam aquades dan 0,05 M bufer tris- HCl (pH 8, 9).
Produksi Kitinase. Produksi inokulum dilakukan dengan cara basil ditumbuhkan pada media agar miring NA, diinkubasi pada suhu kamar hingga berumur 3 hari. Selanjutnya ditambahkan akuades steril. Suspensi mikroba basil diukur kerapatan optiknya (OD) dengan spektrofotometer pada ë 600 nm sampai OD mencapai 0,5. Produksi kitinase dilakukan dengan menginokulasikan inokulum ke dalam 25 ml media produksi (koloidal kitin 1%, pepton 0,1%, KH2PO4 0,1%, MgSO4.7H2O 0,05%) dengan pH 7 dan diinkubasi pada suhu kamar selama 1-7 hari di atas pengocok dengan kecepatan 120 rpm. Setiap hari dilakukan pengambilan sampel sebanyak 2 ml dan dipisahkan filtrat dan endapannya, disentrifugasi dengan kecepatan 10.160 g selama 5 menit. Filtrat digunakan sebagai larutan enzim dan diuji acara kitinasenya.
Pengujian Aktivitas Kitinase. Aktivitas kitinase diuji dengan mengukur kadar gula amino sebagai produk hidrolisis kitin oleh kitinase. Konsentrasi gula amino diukur memakai Metode Reissig (1955). Senyawa N-asetil glukosamin (GlcNAc) digunakan sebagai standar untuk penghitungan acara kitinase. Satu unit kitinase yakni banyaknya enzim yang dapat menghasilkan 1μmol N-asetil glukosamin dari substrat koloidal kitin per menit pada suhu 500C, pH 7,0. Larutan kitinase yang menghasilkan GlcNAc terlalu tinggi diencerkan terlebih dahulu dan faktor pengenceran digunakan dalam perhitungan aktivitasnya. Sebanyak 0,5 ml larutan enzim direaksikan dengan 0,5 ml substrat koloidal kitin 1% dengan pH 7 dan diinkubasi pada suhu
500C selama 30 menit. Reaksi enzimatis dihentikan dengan memasukkan adonan ke dalam air mendidih selama 5 menit. Selanjutnya disentrifugasi dengan kecepatan 10,160 g selama 5 menit dan filtrat dipisahkan dari endapan. Sebanyak 250 μl filtrat ditambah 50 μl potasium tetraborat, dididihkan selama 3 menit dan didinginkan dengan segera. Ditambahkan 1,25 ml reagen 4-(dimetilamino)benzaldehida (DMAB), diinkubasi pada suhu 370C selama 20 menit dan OD dibaca dengan spektrofotometer pada ë 584 nm.
Media produksi dengan variasi pH substrat koloidal kitin 1%. Produksi kitinase dilakukan dengan menginokulasikan isolat dengan nilai kerapatan optik tertinggi ke dalam 10 ml media produksi (koloidal kitin 1%, pepton 0,1%, KH2PO4 0,1%, MgSO4.7H2O 0,05%) dengan pH 7 dalam aquades dan diinkubasi pada suhu kamar selama 1 hari di atas pengocok dengan kecepatan 120 rpm. Sampel sebanyak 2 ml setelah diinkubasi 1 hari kemudian dipisahkan filtrat dan endapannya, disentrifugasi dengan kecepatan 10.160 g selama 5 menit. Filtrat digunakan sebagai larutan enzim dan diuji acara kitinasenya dengan variasi pH substrat. Sebanyak 0,5 ml larutan enzim direaksikan dengan 0,5 ml substrat koloidal kitin 1% dengan variasi pH substrat bufer (pH 3-9). Larutan bufer yang digunakan adalah 0,05 M bufer asetat (pH 3, 4, 5), 0,05 M bufer fosfat (pH 5, 6, 7, 8), dan 0,05 M bufer tris- HCl (pH 8, 9).
Karakterisasi dan identifikasi isolat penghasil enzim kitinase. Isolat penghasil kitinase dikarakterisasi secara fenotipik dan molekuler. Karakterisasi fenotipik mencakup pengamatan morfologi sel dan koloni, huruf fisiologis huruf fenotipik dilakukan dengan metode profile matching yang mengacu pada Bergey’s Manual of Systematic Bacteriology (Don & Brenner et al., 2003). Karakteristik molekular dilakukan menurut sekuen 16S rDNA dengan primer 9F (5’-GAGTTTGATCCTGGCTCAG-3’) dan 1510R (5’-GGCTACCTTGTTACG ACTT-3’).
Amplifikasi 16S rDNA. DNA isolat basil diisolasi menggunakan Wizard Genomic DNA Purification Kit (Promega). Amplifikasi 16S rDNA memakai metode PCR dengan primer universal yaitu 9F dan 1510R. Reaksi PCR memakai Thermalcycler (Takara, Shuzo, Co. Ltd.) sebagai berikut : denaturasi 950C selama 3 menit, dilanjutkan 30 siklus yang terdiri daridenaturasi 950C selama 30 detik, perekatan 500C selama 30 detik, pemanjangan 720C selama 90 detik. Pemanjangan final 720C selama 7 menit. Hasil produk PCR dipurifikasi, dilanjutkan dengan cyclesekuensing dengan template 9 F dan 1510R. Hasil cyclesekuensing dipurifikasi dan dilanjutkan dengan sekuensing di Genetic analyzer ABI 3130. Hasil sekuensing dicek dan diedit/trimming memakai acara Bioedit. Fasta yang diperoleh disambungkan memakai program Clustal X. Hasil penyambungan (aligment) di Blast di gen Bank NCBI.
HASIL DAN PEMBAHASAN
Dari sampel air embun dan air tanah yang diisolasi, didapat sebanyak 47 isolat basil murni. Hanya dua isolat yang positif sanggup merombak kitin yaitu sampel air tanah dari Kabupaten Pasuruan B2-4 dan air tanah NA S4-1 dari Kabupaten Probolinggo (Tabel 2). Setiap isolat murni dipelihara dalam media miring Nutrient Agar.
No. | Nama sampel | Isolat | Uji Kitinase |
1 | 1. Air embun. Ds. Penanjakan, Kec. Tosari Kab. Pasuruan. 2786 m dpl. | NA S1/1 | - |
2 | NA S1/2 | - | |
3 | NA S1/4 | - | |
4 | 1/10NA S1/1 | - | |
5 | 1/10NA S1/2 | - | |
6 | 1/10NA S1/3 | - | |
7 | 2. Air tanah. Ds. Penanjakan, Kec. Tosari Kab. Pasuruan. 2757 | NA S2/1 | - |
8 | NA S2/2 | - | |
9 | NA S2/3 | - | |
10 | NA S2/4 | - | |
11 | NA S2/5 | - | |
12 | NA S2/6 | - | |
13 | NA S2/7 | - | |
14 | NA S2/8 | - | |
15 | NA S2/10 | - | |
16 | B2-4 | +++ | |
17 | B2-6 | - | |
18 | B2-7 | - | |
19 | 1/10NA S2/4 | - | |
20 | 1/10NA S2/5 | - | |
21 | 1/10NA S2/6 | - | |
22 | 1/10NA S2/9 | - | |
23 | 1/10NA S2/11 | - | |
24 | 3. Air tanah. Dsn. Cemoro Lawang, Ds. Ngadisari, Kec Sukapura Kab. Probolinggo. 2241 m dpl. | NA S3/1 | - |
25 | NA S3/2 | - | |
26 | NA S3/4 | - | |
27 | NA S3/5 | - | |
28 | NA S3/6 | - | |
29 | NA S3/7 | - | |
30 | NA S3/8 | - | |
31 | NA S3/9 | - | |
32 | NA S3/10 | - | |
33 | B3-1 | - | |
34 | B3-5 | - | |
35 | B3-7 | - | |
36 | 1/10NA S3/1 | - | |
37 | 1/10NA S3/2 | - | |
38 | 1/10NA S3/3 | - | |
39 | 1/10NA S3/4 | - | |
40 | 1/10NA S3/5 | - | |
41 | 4. Air tanah. Ds. Sapi kerep, Kec. Sukapura, Kab. Probolinggo. 1215 m dpl. | NA S4-1 | +++ |
42 | NA S4-2 | - | |
43 | 1/10 NA S4/1 | - | |
44 | 1/10 NA S4/2 | - | |
45 | 1/10 NA S4/3 | - | |
46 | 1/10 NA S4/4 | - | |
47 | 1/10 NA S4/5 | - | |
Keterangan: - tidak sanggup mendegradasi kitin, +++ sanggup mendegradasi kitin dengan baik | |||
Hasil pengujian secara kualitatif menunjukkan bahwa sebanyak 2 isolat mempunyai acara kitinase, yang ditandai dengan adanya zona bening disekitar koloni (Gambar 1). Mikroba yang sanggup mensekresikan enzim-enzim kitinolitik ekstraseluler akan membentuk areal bening pada media padat yang mengandung kitin (Priest, 1984). Menurut Faath (1994) perbedaan laju degradasi kitin sanggup ditunjukkan dengan penampakkan areal bening di sekeliling koloni pada supaya yang mengandung kitin. Selanjutnya isolat-isolat yang menunjukkan positif acara kitinase secara kualiatatif diukur secara semi-kuantitatif dengan cara membandingkan diameter zona bening disekitar koloni dengan diameter koloni.
 |
| Gambar 1. Zona bening dari basil B2-4 (kiri) dan NA S4-1 (kanan) perombak kitin |
Hasil penghitungan secara semi-kuantitatif menunjukkan terdapat dua isolat mempunyai diameter zona bening dengan nilai lebih besar dan sama dengan 2. Hasil bagi antara diameter zona bening dan diameter koloni dinyatakan sebagai acara enzim secara nisbi, sedangkan isolat negatif yaitu isolat yang tidak dapat merombak kitin ada 45 isolat.
Kemampuan dari masing-masing isolat bervariasi sesuai dengan isolatnya. Selanjutnya isolat dengan aktivitas nisbi sama dan lebih besar dengan 2 diuji kemampuan kitinasenya secara kuantitatif. Konsentrasi koloidal kitin yang digunakan untuk penapisan isolat dengan memperlihatkan zona bening yang terang di sekitar koloni biasanya mengandung sekitar koloidal kitin 1%. Menurut Hsu, (1975) zona bening paling jelas terlihat pada media supaya kitin yang mengandung koloidal kitin 0,4%, pada konsentrasi koloidal kitin yang lebih rendah (0,1-0,2%) tidak ada penampakan zona bening dan pada konsentrasi yang lebih tinggi atau 1-2% zona bening yang dihasilkan terlihat agak kabur. Monreal (1968) memakai supaya kitin dengan “double layer” untuk penapisan basil penghasil kitinase, dan pada lapisan bawah digunakan media mengandung ekstrak ragi 0,5% dan supaya 2%, dan yang penggalan atas media mengandung koloidal kitin 1%. Secara keseluruhan seleksi secara kualitatif isolat penghasil kitinase yang dilakukan dalam penelitian ini memperlihatkan hasil yang baik dan jelas.
Isolat yang sanggup mendegradasi kitin ditumbuhkan pada media kultur basil Luria Bertani (pepton 1%, ekstrak ragi 0,5%, dan NaCl 0,1%) pada pH 7,2 diinkubasi selama 1 hari pada suhu kamar di atas pengocok dengan kecepatan 120 rpm (Mahata et al., 2008). Pada basil B2-4 lebih cepat dan lebih tinggi kerapatan optiknya diukur pada spektrofotometer dengan ë 584 nm dibandingkan dengan NA S4-1 (Gambar 2 dan Gambar 3).
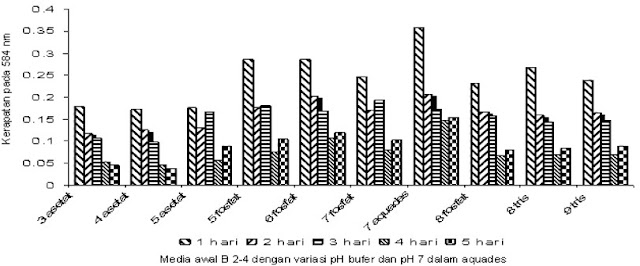 |
| Gambar 2. Kerapatan optik B2-4 pada media awal dengan variasi pH dalam bufer dan pH 7 dalam aquades |
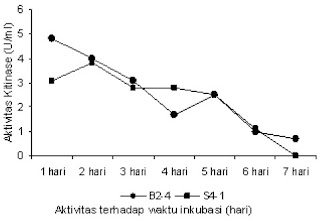 |
| Gambar 3. Aktivitas kitinase B2-4 dan NA S4-1 terhadap waktu inkubasi |
Pada Gambar 2 dapat dilihat kerapatan optik tertinggi B2-4 didapat dari perlakuan media awal pH 7 dalam aquades dengan waktu inkubasi 1 hari yaitu sebesar 0,358. Sedangkan isolat NA S4-1 kerapatan optik tertinggi didapat dari perlakuan media awal pH 7 dalam aquades dengan waktu inkubasi 2 hari yaitu sebesar 0,286, lebih kecil dari isolat B2-4. Derajat keasaman (pH) media berpengaruh terhadap pertumbuhan dan produksi enzim dan enzim mempunyai pH optimum yang khas, yaitu pH yang mengakibatkan acara maksimal. Tetapi pH optimum enzim tidak perlu sama dengan pH lingkungan normalnya, dengan pH yang mungkin sedikit berada di atas atau di bawah pH optimum (Lehninger, 1988).
Menurut Fresht, 1985 bahwa setiap enzim memiliki kisaran pH optimum yaitu kisaran pH dimana enzim menunjukkan acara maksimum dengan stabilitas yang tinggi. Kondisi media awal pH 7 dalam aquades yang dipakai pada penelitian selanjutnya dengan perlakuan berbagai variasi waktu inkubasi dari 1-7 hari (Gambar 3). Metode Reissig (1955) digunakan untuk mendeteksi gula asetilamino. Reaksi antara gula amino dengan potasium tetraborat dalam konsidi alkali dan pemanasan menghasilkan senyawa intermediat asetil heksosamine. Dapat dilihat acara tertinggi didapat dari isolat basil B2-4 dengan waktu inkubasi 1 hari sebesar 4,8 x 10-3 U/ml dan NA S4-1 dengan waktu inkubasi 2 hari sebesar 3,1 x 10-3 U/ml. Hasil ini masih lebih kecil kalau dibandingkan dengan acara hasil dari basil isolat 99 dan Enterobacter sp. G-1 (Mahata et al., 2008) dan dari Aspergillus rugulosus 501 (Widhyastuti, 2007). Kalau melihat dari hasil foto dan penghitungan secara semikuantitatif aktinomisetes BB 3.2 (Soeka, 2009) hampir sama, tetapi aktivitas kitinase B2-4 dan NA S4-1 balasannya sangat kecil. Ada kemungkinan media kultur basil Luria Bertani (Mahata et al., 2008) kurang/tidak cocok, untuk penelitian selanjutnya harus dicoba dengan media lain. Dapat dilihat sehabis hari pertama untuk B2-4 dan sehabis hari kedua untuk NA S4-1 acara kitinasenya terus menurun hal ini dimungkinkan terjadinya kenaikan aktivitas enzim dengan inkubasi dalam waktu jam tidak hari lagi. Jika keadaan baik, hampir semua bakteri mampu berkembang biak dengan amat cepat. Lamanya dapat satu jam hingga beberapa hari. Lama waktu ini tergantung pada macam bakteri, umur biakan, dan nutrien yang terdapat dalam media yang disediakan
Mikroorganisme mempunyai masa pertumbuhan yang bervariasi dimana dalam acara metabolisme tersebut mikroorganisme mempunyai beberapa fase dalam pertumbuhannya. Pada awal pertumbuhan fase yang dilalui yakni fase pertumbuhan kemudian aktivitas metabolisme akan menurun sehabis mikroorganisme melewati fase puncak pertumbuhannya. Fase-fase pertumbuhan tersebut sangat besar lengan berkuasa terhadap enzim yang dihasilkan oleh mikroorganisme untuk membantu pencernaan makanannya (Volk & Wheeler, 1988).
Laju reaksi bergantung pada kondisi larutan dan konsentrasi substrat. Kondisi-kondisi yang menyebabkan denaturasi protein menyerupai temperatur tinggi, konsentrasi garam yang tinggi, dan nilai pH yang terlalu tinggi atau terlalu rendah akan menghilangkan aktivitas enzim. Sedangkan peningkatan konsentrasi substrat cenderung meningkatkan aktivitasnya. Untuk menentukan kelajuan maksimum suatu reaksi enzimatik, konsentrasi substrat ditingkatkan sampai laju pembentukan produk yang terpantau menjadi konstan. Konsentrasi ion hidrogen (yaitu keasaman atau kebasaan) larutan sangat menghipnotis aktivitas suatu enzim. Hal ini disebabkan lantaran asam amino yang merupakan pusat aktif enzim harus berada dalam keadaan ionisasi yang sempurna supaya menjadi aktif.
Kebanyakan enzim memperlihatkan acara maksimum pada kisaran netral, pH 6 hingga 8. Pengaruh pH terhadap suatu enzim bervariasi tergantung jenisnya. Ada enzim yang bekerja secara optimal pada kondisi asam. Ada juga yang bekerja secara optimal pada kondisi basa.Untuk setiap enzim kita dapat memastikan pH minimum, maksimum, dan optimum (Volk & Wheeler, 1988). Hasil penelitian ini sesuai dengan hasil penelitian sebelumnya yang dilakukan oleh Yurnaliza et al., (2008) menyampaikan beberapa penelitian enzim memperlihatkan bahwa pH berada pada kisaran netral sanggup meningkatkan pertumbuhan mikroba dan kemampuannya mensintesis kitinase. Menurut Webb dan Dixon (1979), peningkatan acara enzim pada pH optimum sanggup dihubungkan dengan adanya perubahan ionisasi dalam gugus ionik enzim pada sisi aktif sehingga konformasi sisi aktif menjadi lebih efektif dalam mengikat dan mengubah substrat menjadi produk.
Selanjutnya isolat B2-4 dianalisa aktivitas kitinasenya dengan variasi pH (3-9) substrat kitin 1%, dapat dilihat dalam Gambar 3, didapat acara tertinggi pada pH 8 fosfat sebesar 17,54 x 10-2 U/ml. Hasil ini masih lebih besar dari hasil penelitiannya Nasran, et al., (2003) acara kitinase dari Vibrio harveyi pada pH 8 dengan masa inkubasi 5 hari mencapai 6,0 x 10-5 U/ml. Dan sesuai dengan penelitian dari Rochima (2006) Bacillus papandayan asal Kawah Kamojang mempunyai pH optimum pada pH 8. Dengan pH 8 berarti bersifat alkali. Kebanyakan basil hidup paling baik pada keadaan sekitar netral (pH 7) karena itu sebelum digunakan, kebanyakan medium disesuaikan pada pH sekitar 7. Hanya sedikit bakteri hidup dalam lingkungan ekstrim kisaran pH (misalnya 8-9), oleh lantaran itu pH harus disesuaikan dengan jenis yang ditumbuhkan. Konsentrasi ion hidrogen (yaitu keasaman atau kebasaan) larutan sangat menghipnotis acara suatu enzim. Hal ini disebabkan lantaran asam amino yang merupakan pusat aktif enzim harus berada dalam keadaan ionisasi yang tepat supaya menjadi aktif. Kebanyakan enzim menunjukkan acara maksimum pada kisaran netral, pH 6 hingga 8 (Volk & Wheeler, 1988).
Berdasarkan hasil identifikasi isolat tingkat spesies dengan metode molekuler 16S rDNA diketahui bahwa isolat B2-4 dan NA S4-1 yakni Stenotrophomonas sp. (Tabel 3).
Tabel 3. Kecocokan profil analisa huruf morfologi dan fisiologi isolat B2-4 dan NA S4-1 penghasil kitinase dengan genus acuan berdasarkan Bergey’s Manual of Systematic Bacteriology (Don J. Brenner et al. 2003)
Unit Karakter | Species stenotrophomonas dalam bergey’s manual of systematic bacteriology | NA B2-4 | NA S4-1 |
Gram | negatif | negatif | negatif |
Motilitas | tidak motil | tidak motil | tidak motil |
Bentuk sel | batang | batang | batang |
Ukuran sel (μm) | 1 | 1 | 1 |
Bentuk koloni | bulat | bulat | bulat |
Ukuran koloni (mm) | 1-1,5 | 1-1,5 | 1-1,25 |
Tepi sel | rata | rata | rata |
Elevasi | agak cembung | agak cembung | agak cembung |
Permukaan | berkilap | berkilap | berkilap |
Opasitas | tidak tembus cahaya | tidak tembus cahaya | tidak tembus cahaya |
Warna | kekuning-kuningan | kekuning-kuningan | kekuning-kuningan |
Motilitas | tidak motil | tidak motil | tidak motil |
Kebutuhan O2 | aerob | aerob | aerob |
Tes oksidase | + | + | + |
Tes peroksidase | + | + | + |
Stenotrophomonas yakni spesies termasuk genus Stenotrophomonas, keluarga Xanthomonadaceae, Order Xanthomonadales, kelas Gammaproteobacteria dan phylum Proteobacteria. Hasil ini didukung analisis huruf morfologi dan fisiologi dan ternyata sesuai dengan yang disebutkan dalam Bergey’s Manual of Systematic Bacteriology Second ed. Springer.
KESIMPULAN
Berdasarkan hasil penelitian sanggup disimpulkan bahwa dari 48 isolat yang mempunyai kapasitas dapat merombak kitin menjadi kitinase yakni 2 isolat B2-4 dan NA S4-1. Isolat B2-4 mempunyai acara kitinase tertinggi sebesar 4,8.10-3 U/ml dengan waktu inkubasi 1 hari dan NA S4-1 mempunyai acara kitinase tertinggi sebesar 3,1 x 10-3 U/ml dengan waktu inkubasi 2 hari masing-masing diproduksi pada media tumbuh cair dengan pH 7 dalam aquades. Isolat B2-4 mempunyai acara kitinase tertinggi pada pH 8 fosfat substrat koloidal kitin 1% sebesar 17,54 x 10-2 U/ml. Berdasarkan karakteristik molekular urutan parsial 16S rDNA dengan primer 9F dan 1510R kedua isolat diidentifikasi sebagai anggota Stenotrophomonas sp.
UCAPAN TERIMA KASIH
Diucapkan terima kasih kepada Dra. Elidar Naiola atas bantuannya sehingga penelitian ini dapat terlaksana, serta kritik dan saran dalam penulisan makalah.
DAFTAR PUSTAKA
Dephut. 2007. Taman Nasional Bromo Tengger Semeru. M a l a n g . w w w. d e p h u t . g o . i d / I N F O R M A S I / TN%20INDOENGLISH/tn_bromo.htm (April 2007).
Don, J., Brenner, Krieg, N.R. & Staley, J.T. 2003. The Proteobacteria, Part B The Gammaproteobacteria. Bergey’s Manual of Systematic Bacteriology Second ed. Springer.
Faath, I. 1994. Isolation of Chitin Degrading Bacteria from Various Habitats. Microbial Diversity, Bonn.
Fersht, A. 1985. Enzyme Structure and Metabolism, 2nd ed. Freeman, San Fransisco.
Hsu, S.C. & Lockwood, J.L. 1975. Powdered chitin supaya as a selective medium for enumeration of actinomycetes in water and soil. Applied Microbiology 29: 422-426.
Kobayashi, S., Kiyosada, T. & Shoda, S. 1997. A novel method for síntesis of chitobiose via enzymatic glycosylation using sugar oxazoline as glycosyl donor. Tetrahedron Lett 38: 2111-2112.
Lehninger, A.L. 1988. Dasar-dasar Biokimia. Jilid 1.
Thenawijaya M. penerjemah Penerbit Erlangga, Jakarta. Terjemahan dari: Principles of Biochemistry.
Mahata, M.E., Dharma, A., Ryanto, I. & Yose, R. 2008. Characterization of Extracellular Chitinase from Bacterial Isolate 99 and Enterobacter sp. G-1 from Matsue City, Japan. Journal Mikrobiology Indonesia 2: 34-38.
Monreal, J. & Reese, E.T. 1968. The Chitinase of Serea marcescens. Can. Journal Microbiol 15: 689-696.
Nasran, S., Farida, A. & Ninoek, I. 2003. Produksi Kitinase dan Mitin Deasetilase dari Vibrio harveyi . Journal Penelitian Perikanan Indonesia 9(5): 33-38.
Patil, R.S., Ghormade, V. & Despande, M.V. 2000. Chitinolytic Enzymes: an Exploration. Enzyme and Microbial Technology 26: 473-483.
Pelczar, M.J. & Chan, E.C.S. 2005. Dasar-Dasar Mikrobiologi. Ratna Siri Hadioetomo et al. Penerjemah. Penerbit UI Press 87.
Priest, F.G. 1984. Extracellular Enzymes Van Nostrand Reinhold, England.
Radzicka, A. & Wolfenden, R. 1995. “A proficient enzyme”. id.wikipedia.org/wiki/Enzim-Tembolok. Science 6(267): 90-931.
Rattanakit, N., Plikomol, A., Yano, S., Wakayama, M. & Tachiki, T. 2002. Utilization of Shrim Shellfish Waste a Substrate for Solid-State Cultivation of a Culture Based on Chitinase Formation Which is necessary for Chitin Assimilation. Journal of Bioscience and Bioengineering 93(6): 550-556.
Rochima, E. 2006. Pemurnian dan Karakterisasi Kitin Deasetilase Termostabil dari Bacillus papandayan asal Kawah Kamojang Jawa Barat. Journal Bionatura 8(2): 193-209.
Soeka, Y.S. 2009. Kondisi Optimum Produksi Kitinase dari Aktinomisetes dengan Karakterisasi pH dan Suhu Enzim. Jurnal Berkala Penelitian Hayati. Edisi Khusus 3C: 57-61.
Terayama, H., Takahashi, S. & Kuzuhara, H. 1993. Largescale preparation of N, N-diacetylchitobiose by enzymic degradation of chitin and its chemical modification. Journal Carbohydr. Chem 12: 81-93.
Volk, W.A. & Wheeler, M.F.1988. Mikrobiologi Dasar. Jilid 1. Soenartono Adisoemarto Editor. Penerbit Erlangga Jakarta. Terjemahan dari: Basic Microbiology, fifth edition.
Webb, E.C. & Dixon, M. 1979. Enzymes. Academia Press, New York.
Widhyastuti, N., Handayani R., Hastuti, A., Kasirah, Setianingrum, N., Manalu, J., Gita. & Saskiawan, I. 2006. Studi Potensi Aktinomisetes untuk Produksi Enzim Kitinase Guna Menunjang Industri Farmasi. Laporan Teknik Pusat Penelitian Biologi-LIPI.
Widhyastuti, N. 2007. Produksi Kitinase Ekstraseluler Aspergillus rugulosus 501 secara Optimal pada Media Cair. Jurnal Berita Biologi 8(6): 547-553.
Yurnaliza. 2008. Senyawa Khitin dan Kajian Aktivitas Enzim Mikrobial Pendegradasinya. Digitized by USU digital library. (24 November 2008).
Yurnaliza, Margino, S. & Sembiring, L. 2008. Kondisi Optimum untuk Produksi Kitinase dari Streptomyces Rkt5 dan Karakterisasi pH dan Suhu Enzim. Biota XIII 3: 169-174.
Anda telah mengetahui Identifikasi Bakteri. Terima kasih anda telah berkunjung ke Perpustakaan Cyber.
No comments:
Post a Comment