Cara Menentukan dan Menghitung Perubahan Entalpi ∆H, Rumus, Energi Reaksi, Contoh Soal, Pembahasan, Praktikum Kimia - Perubahan ΔH reaksi sanggup ditentukan dengan beberapa cara, yakni dari hasil eksperimen, dari penerapan Hukum Hess, atau dengan data entalpi pembentukan dan energi ikatan.
1. Berdasarkan eksperimen / percobaan
Salah satu cara yang dipakai untuk mengukur perubahan entalpi reaksi ialah dengan kalorimetri, yaitu proses pengukuran jumlah panas dari sistem reaksi memakai kalorimeter. Berdasarkan fungsinya, kalorimeter dibedakan menjadi :
a. Kalorimeter tipe reaksi (sederhana), ialah kalorimeter untuk memilih kalor reaksi dari semua reaksi, kecuali reaksi pembakaran. Kalorimeter tipe ini mempunyai ember yang terbuat dari Styrofoam, namun ada pula yang terbuat dari aluminium. Kalorimeter tipe reaksi sanggup juga dipakai untuk memilih kalor jenis logam.
b. Kalorimeter tipe Bom, berfungsi untuk memilih jumlah kalori dalam materi makanan berdasarkan reaksi pembakaran (biasanya dioksidasi dengan oksigen).
 |
| Gambar 1. (a) Kalorimeter tipe reaksi (b) Kalorimeter tipe Bom. |
c. Kalorimeter Thiemann, dipakai untuk memilih kalor materi bakar yang berfase cair ibarat metanol atau etanol.
d. Kalorimeter listrik, untuk memilih kalor jenis zat cair
Nah, alasannya ialah yang akan kita ukur ialah banyaknya kalor dari reaksi kimia, maka kalorimeter yang kita pelajari ialah kalorimeter tipe reaksi.
Prinsip kerja dari kalorimeter ini memakai Azas Black, yaitu jumlah kalor yang dilepas suatu benda sama dengan jumlah kalor yang diterima oleh benda lain, atau q dilepas = q diterima. Adapun besarnya transfer kalor tersebut tergantung pada faktor-faktor berikut.
a. jumlah zat
b. kalor jenis zat
c. perubahan suhu
d. kapasitas kalor dari kalorimeter
 |
| Gambar 2. Kalorimeter es sanggup dipakai untuk mengetahui kapasitas kalor spesifik dari air. |
Rumus yang dipakai untuk menghitung jumlah kalor bila kalor dari kalorimeter diabaikan ialah sebagai berikut.
q = m x c x ΔT
Namun, bila kalor dari kalorimeter diperhitungkan, rumusnya menjadi :
q = (m x c x ΔT) + (C x ΔT)
Keterangan :
q = kalor reaksi (J)
m = massa zat( g)
c = kalor jenis zat (J/g oC atau J/gK)
ΔT = perubahan suhu ( oC atau K)
C = kapasitas kalor zat (J/ oC atau J/K)
Perlu diketahui juga, yang dimaksud dengan kalor jenis (c) ialah jumlah kalor yang dibutuhkan untuk menaikkan suhu 1 gram zat sebesar 1 oC sedangkan kapasitas kalor ialah jumlah kalor yang dibutuhkan untuk menaikkan suhu suatu zat sebesar 1 oC atau 1. Untuk mempermudah pemahaman kalian, mari kita lakukan kiprah di rubrik Aktivitas berikut.
Praktikum Kimia Menentukan Perubahan Entalpi Secara Kalorimetris :
Dasar Teori
Perubahan panas yang dihasilkan dad suatu reaksi sering disebut sebagai panas reaksi dan dinyatakan dalam satuan joule atau kalori. Alat yang sanggup dipakai untuk mengukur panas reaksi ini ialah kalorimeter. Salah satu jenis kalorimeter yang sederhana dan sanggup dipakai untuk eksperimen di laboratorium ialah kalorimeter reaksi. Saat ini, kalorimeter reaksi memakai cangkir styrofoam (suatu isolator yang baik), namun masih ada juga kalorimeter buatan usang yang memakai cangkir aluminium. Tahap awal cara pemakaiannya ialah mengukur suhu pereaksi. Sesaat setelah pereaksi dicampurkan, maka reaksi selesai dan suhu hasil adonan diukur. Berdasarkan perbedaan suhu inilah, panas reaksi sanggup diperkirakan. Syukri S., 1999, hlm. 85-86 (dengan pengembangan)
Tujuan
Menentukan jumlah kalor dari reaksi larutan NaOH dan larutan asam klorida.
Alat dan Bahan
Alat :
- Kalorimeter reaksi
- Termometer
- Gelas ukur 100 mL
Bahan :
- 50 mL larutan NaOH 1 M
- 50 mL larutan HCI 1 M
Cara Kerja
- Tuangkan larutan NaOH dalam ember yang terdapat pada kalorimeter.
- Ukur suhu larutan NaOH dengan termometer higienis dan kering.
- Tuangkan 50 mL larutan HCI 1 Mdalam gelas ukur, kemudian ukur suhunya. Hitung rata-rata suhu kedua larutan, catat sebagai suhu awal.
- Tuangkan larutan HCL ke dalam ember kalorimeter, tutup sambil diaduk. Ukur dan catat suhu stabilnya sebagai suhu akhir.
Perhatian : Bila kalian memakai satu termometer untuk mengukur dua macam larutan, cucilah dulu dan keringkan dengan kain lap biar hasilnya akurat.
Hasil Percobaan
Suhu larutan NaOH 1M = ...°C
Suhu larutan HCI 1 M = ...°C
Suhu rata-rata = ...°C (suhu awal)
Suhu simpulan reaksi = ...°C (suhu akhir)
Pembahasan
Reaksi yang terjadi ialah sebagai berikut.
NaOH (aq) + HCI(aq) → NaCI(aq) + H2O(l)
a. Hitunglah perubahan entalpi yang terjadi dengan rumus:
q = m x c x ΔT
atau,
q = (m x c x ΔT) + (C x ΔT) (bila memakai kalorimeter aluminium) Panas yang diserap oleh alumunium kalorimeter diperhitungkan.
Kalor jenis aluminium 9,1 KJ/ oC .
b. Hitung AH reaksi untuk 1 mol NaOH dan 1 mol HCI
c. Tuliskan persamaan termokimia dari reaksi penetralan di atas. Kesimpulan Tariklah kesimpulan dari percobaan yang telah kalian lakukan.
Agar kalian sanggup lebih terperinci memahami perhitungan perubahan entalpi berdasarkan percobaan memakai kalorimeter, berikut diberikan beberapa pola soal.
Contoh Soal (1) :
10 g NaOH dimasukkan ke dalam kalorimeter yang berisi 150 g air. Jika kalor jenis air = 4,2 J/g oC dan selisih suhu sebelum dan setelah reaksi 5 oC , maka hitunglah:
a. Kalor pelarutan NaOH, bila jumlah kalor dari kalorimeter diabaikan.
b. Kalor pelarutan NaOH, bila memakai ember aluminium dan tanpa mengabaikan banyaknya kalor dari kalorimeter (kapasitas kalor dari kalorimeter = 9,1 kJ/ oC)
Penyelesaian :
Diketahui : Massa NaOH = 10 g
Massa H2O = 150 g
Massa larutan = 160 g
c = 4,2 J/g oC
C = 9,1 kJ/ oC
T = 5 C
Ditanyakan : q.
Jawaban :
a. Bila kalor dari kalorimeter diabaikan, maka :
q = m x c x ΔT = 160 g x 4,2 J/g oC x 5 oC = 3360 J
Jadi, kalor pelarutan NaOH ialah 3360 J.
b. q = q larutan NaOH – q kalorimeter.
Karena dalam pelarutan NaOH terjadi kenaikan suhu, maka sistem melepaskan kalor. Oleh alasannya ialah itu, tanda untuk larutan NaOH negatif, sehingga:
q = - (q larutan + q kalorimeter)
q = - (m x c x Δt larutan + C x ΔT kalorimeter)
q = -((160 g 4,2 J/g oC x 5 oC) + (9,1 kJ/ oC x 5 oC))
= 3360 J+ 45500 J
= 48860 J
Jadi, kalor pelartuan NaOH ialah 48860 J.
Contoh Soal (2) :
Berapakah jumlah kalor yang diterima 1 kg air bila dipanaskan dari suhu 20 C menajadi 30 oC? (diketahui kalor jenis air = 4,2 J /g oC)
Pembahasan :
Diketahui :
m = 1 kg = 1000 g
T= (30-20) oC = 10 oC
c = 4,2 J/g oC
Ditanyakan : q.
Jawaban : q = m x c x ΔT = 1000g x 4,2 J/g C x 10 oC = 42 kJ
Jadi, kalor yang diterima 1 kg air sebesar 42 kJ.
Contoh Soal (3) :
50 mL NaOH 0,1 M direaksikan dengan 50 mL CH3COOH 0,1 M dalam kalorimeter yang terbuat dari aluminium (dengan kalor jenis aluminium = 9,0 kJ/ oC) Reaksi ini mengalami kenaikan suhu 4 oC . Bila kalor yang diserap aluminium diabaikan, hitunglah kalor reaksinya (Berat jenis larutan dianggap 1 g/mL, c = 4,18 J/g oC)
Penyelesaian :
Diketahui :
V NaOH = 50 mL
[NaOH] = 0,1 M
V CH3COOH = 50 mL
[CH3COOH] = 0,1 M
C kalorimeter = 9,0 kJ/ oC
ΔT = 4 oC
ρ larutan = 1 g/mL
kalor yang diserap aluminium diabaikan.
Ditanyakan : q.
Jawab :
Vtotal = 50 ml + 50 ml = 100 ml
m = Vtotal = 1 g/mL x 100 mL = 100 g
q = m x c x ΔT
= 100 g x 4,18 J/g oC x 4 oC
= 1672 J
Jadi, kalor reaksinya sebesar 1672 J.
2. Berdasarkan Hukum Hess
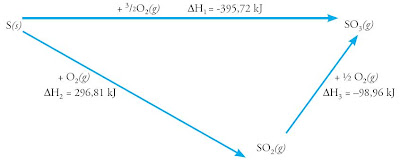
Tidak semua reaksi kimia berlangsung dalam satu tahap, misalnya reaksi pembuatan sulfur (baik melalui proses kontak maupun kamar timbal) dan reaksi pembuatan besi dari biji besi. Namun, berdasarkan Hess (1840) berapa pun tahap reaksinya, jikalau materi awal dan hasil jadinya sama, akan memperlihatkan perubahan entalpi yang sama. Perhatikan pola berikut.
Contoh :
Reaksi langsung:
S(s) + 3/2 O2(g) → SO3(g) ΔH = - 395,72 kJ
Reaksi tak langsung, 2 tahap:
S(s) + O2(g) → SO2(g) ΔH = -296,81 kJ
SO2(g) + ½ O2(g) → SO3(g) ΔH = - 98,96 kJ
Bila dijumlahkan:
S(s) + 3/2 O2(g) → SO3(g) ΔH = -395,72 kJ
Persamaan reaksi tersebut sanggup dinyatakan dalam diagram tingkat energi atau diagram siklus, ibarat pada gambar :
Diagram di atas juga sanggup digambarkan sebagai berikut.
Cara menghitung entalpi berdasarkan Hukum Hess sanggup diperhatikan lagi dari pola soal no. 4.
Contoh Soal (4) :
Tentukan harga entalpi dari reaksi :
C(s) + 2H2(g) + ½ O2(g) → CH3OH(g)
Bila diketahui :
I. CH3OH(g) + 2 O2(g) → CO3(g) + 2H2O(g) ΔH = - 764 kJ
II. C(s) + O2(g) → CO2(g) ΔH = - 393,5 kJ
III. H2(g) + ½ O2(g) → H2O(g) ΔH = - 241,8 kJ
Agar kalian sanggup menjawab dengan mudah, cermati dan ikuti langkah- langkah berikut.
- Sesuaikan reaksi yang diketahui dengan reaksi yang ditanyakan, baik letak senyawa, jumlah mol, maupun besarnya entalpi.
- Apakah letak senyawa atau unsur yang ditanyakan berlawanan arah dengan reaksi yang ditanyakan? Jika iya, maka reaksi dibalik, termasuk harga entalpinya.
- Apakah jumlah mol belum sama? Jika belum sama, samakan dengan mengalikan atau membaginya dengan bilangan tertentu.
- Bagaimana akhirnya? Reaksi dijumlahkan, tapi ingat, unsur yang sama di ruas yang sama dijumlahkan, tapi bila ruasnya berbeda dikurangkan. Anggap saja pereaksi sebagai harta benda kita, hasil reaksi sebagai utang kita.
- Susun ibarat contoh, angka Romawi memperlihatkan asal reaksi.
- Selanjutnya cermati keterangan di belakang reaksi.
Pembahasan :
II. C(s) + O2(g) → CO2(g) ΔH = - 393,5 kJ.
III. 2 H2(g) + O2(g) → 2 H2O(g) ΔH = - 483,6 kJ
I. CO2(g) + 2H2O(g) → CH3OH(g) ΔH = + 764 kJ
C(s) + 2 H2(g) + 2O2(g) → CH3OH(g) ΔH = + 113,1 kJ
Penjelasan:
II. Reaksi tetap, alasannya ialah letak atom C(s) yang diketahui (pereaksi) sama dengan letak atom C (s) reaksi yang ditanyakan (sama-sama ruas kiri).
III. Jumlah mol dan harga entalpi dikali dua karena H2 (g) yang diminta 2 mol, scdangkan yang diketahui dalam soal 1 mol. Reaksi tidak dibalik alasannya ialah letak H2 sama-sama di ruas kiri.
I. Reaksi dibalik, sehingga AH juga harus dibalik, karena CH3OH(g) yang ditanyakan tcrletak di ruas kanan, sedangkan pada reaksi yang diketahui di ruas kiri.
Contoh Soal (5) :
Diketahui entalpi pembentukan NH4NO3(g), N2O(g) dan H2O(g) berturut-turut = - 365,6 kJ; + 81,6 kJ; dan - 241,8 kJ. Hitunglah entalpi rcaksi dari:
NH4NO3(g) → N2O (g) + 2H2O(g)
Petunjuk :
Ubahlah pernyataan dalam kalimat di atas menjadi persamaan termokimia, kemudian kerjakan ibarat pola 4. Zat yang dibuat 1 mol ditulis di ruas kanan, dibcntuk dari unsur-unsurnya.
Penyelesaian :
Diketahui :
Pembentukan NH4NO3(g)
Reaksi : N2(g) + 2H2(g) + 3/2 O2(g) → NH4NO3(g) AH= - 365,6 kJ (I)
Pembentukan N2O(g)
Reaksi : N2(g) + 1/2 O2(g) → N2O(g) AH= +81,6 kJ (II)
Pcmbentukan H2O(g)
Reaksi : H2(g) + 1/2 O2(g) → H2O(g) AH =-241,8 kJ (III)
Ditanyakan :
ΔH dari NH4NO3(g) → N2O(g) + H2O(g)
Jawaban :
I. NH4NO3(g) → N2(g) + 2H2(g) + 3/2 O2(g) ΔH =- 365,6 kJ
(reaksi dibalik)
II. N2 (g) + ½ O2(g) → N2O(g) ΔH = + 81,6 kJ
(reaksi tetap).
III. 2H2(g) + O2(g) → 2H2O (g) ΔH = - 483,6 kJ
(reaksi dikalikan 2)
NH4NO3(g → N2O(g) + 2H2O(g) ΔH= - 767,6 kJ.
3. Berdasarkan Entalpi Pembentukan Standar
Data dari entalpi pembentukan standar sanggup juga dipakai untuk menghitung H reaksi (ΔHR). Zat-zat pereaksi mengurai membentuk unsur-unsurnya, kemudian unsur-unsur hasil uraian tersebut membentuk zat baru. Rumus yang dipakai ialah :
ΔHR = Σ ΔHf hasil reaksi – Σ ΔHf pereaksi
Perhatikan pola perhitungan berikut.
Contoh Soal (6) :
CH4(g) + 2O2(g) → CO2(g) + 2 H2O(l) ΔH = - 802 kJ.
Berdasarkan entalpi pembentukan standar, hitunglah ΔHf CH4(g).
Jawaban :
ΔHR = [1 ΔHf CO2 + 2 ΔHf H2O] – [ ΔHf CH4 + 3 ΔHf O2)
- 802 kJ = [1(- 393,51) + 2 (-285,83)] – [ ΔHf CH4 + 3 . 0] kJ
- 802 kJ = [- 393,51 + (-571,66)] kJ – [ ΔHf CH4] kJ
ΔHf CH4 = - 163,17 kJ
Jadi, entalpi pembentukannya ialah - 163,17 kJ.
Contoh Soal (7) :
Tentukan entalpi pembakaran dari H2S(g), bila entalpi pembentukan H2S, H2O, dan SO2, berturut-turut = 20,6 kJ/mol; - 241,81 kJ/mol; dan – 296,81 kJ/mol.
Pembahasan :
Reaksi pembakaran H2S adalah :
H2S(g) + ½ O2(g) → H2O(g) + SO2(g)
ΔHR = [ΔHf H2O(g) + ΔHf SO2(g)] – [ΔHf H2S + ΔHf O2] = [- 241,81 + (- 296,81)] kJ – [(-20,6) + 0] kJ
= 518,02 kJ
Jadi, entalpi pembakarannya ialah 518,02 kJ
4. Berdasarkan Energi Ikatan
Energi ikatan ialah energi yang dipakai untuk memutuskan ikatan kimia dari 1 mol senyawa yang berbentuk gas menjadi atom-atom gas pada keadaan standar. Misalnya untuk memutuskan ikatan 1 mol oksigen diharapkan energi sebesar 498,3 kJ/mol. Artinya, energi ikatan 0= 0 dalam molekul O2 = 498,3 kJ. Reaksi penguraiannya ialah sebagai berikut.
O2(g) → O(g) + O(g) ΔH= 498,3 kJ
Energi ikatan juga disebut sebagai energi disosiasi, yang dilambangkan dengan D. Semakin banyak jumlah ikatan antar atom atau jumlah pasangan terikat dari suatu atom, maka nilai energi ikatan semakin besar dan ikatan antar atom juga semakin kuat. Sebagai pola ikatan dari atom-atom berikut.
C - C = 345
C = C 611 kJ/mol,
C º C = 837 kJ/mol
Tabel 1. memperlihatkan citra perihal besarnya energi ikatan dari beberapa atom.
Tabel 1. Energi Ikatan Beberapa Atom
Ikatan | Energi Ikatan (kj/mol) | Ikatan | Energi Ikatan (kj/mol) |
H-H | 436 | C–O | 350 |
H–C | 415 | C=O | 741 |
H-N | 390 | C-Cl | 330 |
H–F | 569 | NºN | 946 |
H–Cl | 432 | O = O | 498 |
H–Br | 370 | F–F | 160 |
C–C | 345 | Cl–Cl | 243 |
C=C | 611 | I–I | 150 |
C–Br | 275 | Br–Br | 190 |
CºC | 837 | CºN | 891 |
O-H | 464 | ||
Sumber : Bredy, 1999, Lamp. C. hlm. 36 | |||
Perhitungan H reaksi berdasarkan energi ikatan dan reaksi kimia antar molekul (bukan antar unsur) merupakan reaksi yang berlangsung dua tahap, yaitu:
- Tahap pemutusan ikatan dari zat-zat pereaksi. Dalam hal ini diharapkan kalor (ingat definisi dari Energi Ikatan).
- Tahap pembentukan ikatan, merupakan pelepasan kalor dan terdapat pada zat hasil reaksi.
Adapun proses pemutusan dan pembentukan ikatan sanggup digambarkan sebagai berikut.
Secara umum, perhitungan entalpinya dirumuskan dengan:
H reaksi = Σ energi ikatan pereaksi yang putus - Σ energi ikatan zat hasil reaksi yang terbentuk.
Dari rumus ini sanggup ditentukan:
a. H dari reaksi yang bersangkutan
b. energi ikatan rata-rata dari suatu molekul
c. energi disosiasi ikatan
Agar lebih jelas, perhatikan pola soal perhitungan berdasarkan energi ikatan berikut.
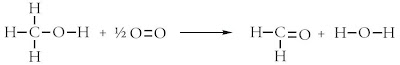
Contoh Soal (8) :
Hitunglah entalpi pembakaran metanol menjadi formaldehid dengan reaksi berikut.
CH3OH(g) + ½ O2(g) → HCHO(g) + H2O(g)
Diketahui energi ikatan rata-rata dari C–H = 415 kJ; C–O = 356 kJ; O–H = 463 kJ; O=O = 498, 3 kJ; dan C=O = 724 kJ.
Pembahasan :
Untuk mempermudah menghitungnya, tuliskan dulu rumus strukturnya, menjadi:
ΔH reaksi = E energi yang diputuskan - E energi ikat yang dibentuk.
Energi ikatan yang diputuskan (kJ) | Energi ikatan yang dibuat (kJ) |
3 C-H = 3 x 415 =1.245 | 2 C-H = 2 x 415 = 830 |
1 C-O = 1 x 356 = 356 | 1 C=O = 1 x 724 = 724 |
1 O- H= 1 x 463 = 463 | 2 O-H = 2 x 463 = 926 |
½ O-O = ½ x 498 = 249 | |
Jumlah = 2.313 | Jumlah = 2.480 |
ΔH = 2313 - 2480 kJ = - 167 kJ
Kaprikornus entalpi pembakaran metanol ialah - 167 kJ.
Contoh Soal (9) :
Hitunglah besamya energi ikatan rata-rata (energi disosiasi) dari N-H dalam molekul NH3 bila ΔHd = 46,11 kJ; lkatan energi H-H = 436 kJ; dan NºN = 945,9 kJ.
Jawaban :
ΔHd NH3 = 46,11 kJ
Reaksi desosiasi NH3 adalah:
NH3(g) → ½ N2(g) + 3/2 H2(g) ΔHd = 46,11 kJ
NH3(g) → ½ N2(g) + 3/2 H2(g) ΔHd = 46,11 kJ
ΔHd NH3 = Energi ikatan yang putus dari NH3 - Energi yang terbentuk dari ½ NºN + 3/2 H-H
46,11 kJ = DNH3 - ( ½ x 945,3 + 3/2 (436) kJ
46,11 kJ = (DNH3 - 1126,6) kJ
DNH3 = (1116,6 + 46,11) kJ = 1172,71 kJ
Energi ikat rata-rata N-H = 1/3 x 1172,71 kJ = 390,9 kJ
Jadi, energi ikatan rata-rata dari N-H ialah 390,9 kJ.
Anda kini sudah mengetahui Cara Menghitung Perubahan Entalpi. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Premono, S. A. Wardani, dan N. Hidayati. 2009. Kimia : SMA/ MA Kelas XI. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 282.

No comments:
Post a Comment