Pengertian Fraksi Mol, x, Rumus, Contoh Soal, Kemolalan, Larutan, Kimia - Fraksi mol (x) menyatakan perbandingan mol salah satu komponen dengan jumlah mol semua komponen-komponen. Perhatikan pola berikut. Misalkan 2 mol garam (NaCl) yang dinotasikan dengan A dilarutkan dalam 8 mol air yang dinotasikan dengan B, maka fraksi mol garam (xA) = 0,2 dan fraksi mol air (xB) = 0,8.
Perhatikan gambar di bawah ini !
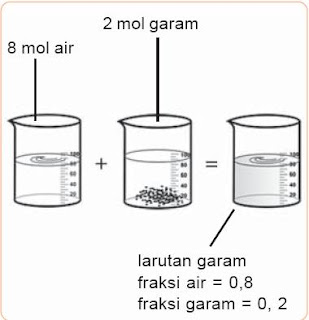 |
| Gambar 1. Larutan Garam dengan Fraksi Mol Garam 0,2. |
Jadi, fraksi mol masing-masing komponen dalam suatu larutan sanggup ditentukan sebagai berikut.
xA =  dan xB =
dan xB = 
Keterangan :
xA = fraksi mol zat A
nA = mol zat A
xB = fraksi mol zat B
nB = mol zat B
Jumlah fraksi mol seluruh zat dalam larutan yaitu 1.
xA + xB = 1
atau,
xA = mol A / total mol semua komponen = mol A / mol A + mol B + ... + mol A ke-n
xA + xB + xC + ... = 1
Fraksi mol zat A (xA) menyatakan perbandingan jumlah mol zat A terhadap jumlah mol total zat-zat yang terdapat dalam larutan.
Contoh Soal fraksi mol 1 :
Hitunglah fraksi mol zat terlarut jikalau 117 gram NaCl dilarutkan dalam 360 air! (Mr NaCl = 58,7)
Penyelesaian :
Mol NaCl = massaNaCl / MrNaCl = 117 / 58,7 = 2 mol
Mol H2O = massa H2O / Mr H2O = 360 / 18 = 20 mol
Fraksi Mol NaCl =  = 0,091
= 0,091
Jadi, fraksi mol NaCl yaitu 0,091.
atau
Contoh Soal fraksi mol 2 : [1]
Sebanyak 27,6 gram etanol C2H5OH dilarutkan dalam 54 gram air (Ar C = 12, H = 1, O = 16). Hitunglah:
a. fraksi mol etanol,
b. fraksi mol air!
Jawaban :
mol C2H5OH = massa / Mr = 27,6 g / 46 gmol-1 = 0,6 mol
mol H2O = massa / Mr = 54 g / 18 gmol-1 = 3 mol
a. xC2H5OH = mol C2H5OH / (mol C2H5OH + mol H2O) = 0,6 mol / (0,6 + 3 mol) = 0,6 mol / 3,6 mol = 0,167
b. xH2O = mol H2O / (mol C2H5OH + mol H2O) = 3 mol / (0,6 + 3 mol) = 3 mol / 3,6 mol = 0,833
Perhatikan bahwa jumlah fraksi mol = 1
xC2H5OH + xH2O = 0,167 + 0,833 = 1
Anda kini sudah mengetahui Fraksi Mol. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Sukmanawati, W. 2009. Kimia 3 : Untuk SMA/ MA Kelas XII. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 266.
Referensi Lainnya :
[1] Pangajuanto, T. 2009. Kimia 3 : Untuk SMA/ MA Kelas XII. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 282.
No comments:
Post a Comment