Penurunan Tekanan Uap Jenuh (ΔP) Larutan, Rumus, Contoh Soal, Pembahasan, Praktikum, Kimia - Menguap yaitu tanda-tanda yang terjadi pada molekul-molekul zat cair meninggalkan permukaan cairan membentuk fasa gas. Gejala ini disebabkan oleh molekul-molekul pada pecahan permukaan cairan mempunyai energi yang sanggup mengatasi gaya antar agresi di antara molekul-molekul cairan. Gaya antar agresi antarmolekul pada permukaan cairan dinamakan tegangan permukaan. Jadi, molekul-molekul yang menguap mempunyai energi lebih besar daripada tegangan permukaan.
1. Tekanan Uap
Kemudahan suatu zat menguap ditentukan oleh kekuatan gaya antarmolekul (tegangan permukaan). Semakin lemah gaya antarmolekul semakin gampang senyawa itu menguap.
Pada suhu rendah, molekul-molekul zat sanggup meninggalkan permukaan cairan membentuk kesetimbangan dengan cairan yang berada di permukaanya Gambar 1). Molekul-molekul fasa uap menjadikan tekanan yang disebut tekanan uap.
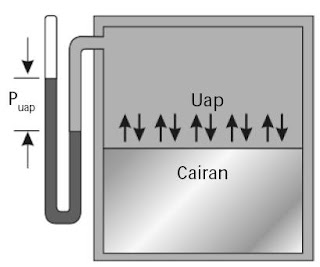 |
| Gambar 1. Uap dan cairan membentuk kesetimbangan dinamis. |
Faktor-faktor yang menghipnotis tekanan uap salah satunya yaitu suhu. Semakin tinggi suhu zat cair, semakin besar tekanan uapnya. Contohnya yaitu tekanan uap air berbeda pada setiap temperatur ibarat ditunjukan pada Tabel 1.
Tabel 1. Tekanan Uap Air Jenuh
Suhu (°C) | Tekanan (mmHg) |
0 | 4,60 |
5 | 6,50 |
10 | 9,20 |
15 | 12,80 |
20 | 17,50 |
22 | 19,80 |
24 | 22,40 |
25 | 23,80 |
27 | 26,70 |
28 | 28,30 |
29 | 30,00 |
30 | 31,80 |
35 | 42,20 |
40 | 55,30 |
45 | 71,90 |
50 | 92,50 |
55 | 118,00 |
60 | 149,40 |
65 | 187,50 |
70 | 233,70 |
75 | 289,10 |
80 | 355,10 |
90 | 525,80 |
100 | 760,00 |
Sumber:General Chemistry, 1990 | |
Bila kita memanaskan air (atau zat yang sanggup menguap lainnya) dalam ketel yang tertutup, maka dikala air mendidih tutup ketel sanggup terangkat, mengapa hal ini terjadi? Apa tolong-menolong yang menekan tutup ketel tersebut, air atau uap airnya? Dalam ruang tertutup air akan menguap hingga ruangan tersebut jenuh, yang disertai dengan pengembunan sehingga terjadi kesetimbangan air dengan uap air. [1]
H2O(l) D H2O(g)
Terjadinya uap air ini akan menjadikan tekanan sehingga menekan ketel. Ketika air mendidih (suhu 100°C) banyak air yang menguap sehingga tekanan yang ditimbulkan lebih besar hingga tutup ketel terangkat. Tekanan yang ditimbulkan oleh uap jenuh air ini disebut tekanan uap jenuh air. [1]
Besarnya tekanan uap jenuh untuk setiap zat tidak sama, bergantung pada jenis zat dan suhu. Zat yang lebih sukar menguap, contohnya glukosa, garam, gliserol mempunyai uap yang lebih kecil dibanding zat yang lebih gampang menguap, contohnya eter. Bila suhu dinaikkan, energi kinetik molekul-molekul zat bertambah sehingga semakin banyak molekul-molekul yang menjelma gas kesannya tekanan uap semakin besar. [1]
Tekanan uap suatu larutan sanggup diukur dengan alat manometer merkurium.
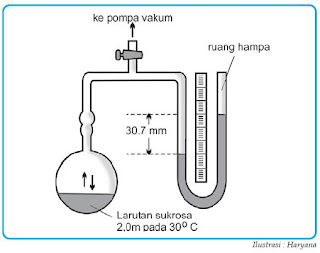 |
| Gambar 2. Penggunaan sebuah manometer merkurium untuk mengukur tekanan uap suatu larutan dalam air. |
2. Penurunan Tekanan Uap Larutan (ΔP)
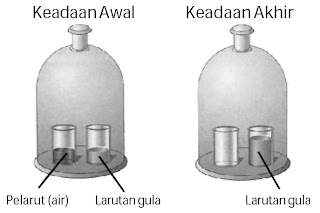
Apa yang terjadi dengan tekanan uap jikalau ke dalam suatu cairan (misalnya, air) dimasukkan zat yang tidak gampang menguap (misalnya, gula pasir)?
 |
| Gambar 3. Zat terlarut non volatil menurunkan penguapan pelarut. |
Adanya zat terlarut non volatile (tidak gampang menguap) di dalam suatu pelarut sanggup menurunkan tekanan uap pelarut. Akibatnya, tekanan uap larutan lebih rendah dari tekanan uap pelarut murninya. Mengapa? Untuk memahami bagaimana pelarutan zat yang tidak gampang menguap besar lengan berkuasa terhadap tekanan uap pelarut, lakukan oleh Anda eksperimen berikut.
Percobaan / Praktikum Aktivitas Kimia 1 :
Pelarutan Zat yang Tidak Menguap
Tujuan :
Menjelaskan pelarutan zat yang tidak menguap.
Alat :
- Gelas
- Wadah tertutup
Bahan :
- Aquades
- Larutan gula 60% b/b
Langkah Kerja :
- Sediakan dua buah gelas. Gelas pertama diisi dengan aquades dan gelas kedua diisi dengan larutan gula 60% b/b. Usahakan volume cairan dalam kedua gelas sama.
- Simpan kedua gelas itu dalam wadah yang tertutup rapat, contohnya desikator selama satu hari.
- Setelah satu hari, amati yang terjadi dalam kedua cairan itu.
Pertanyaan :
- Apa yang terjadi dengan cairan dalam kedua wadah itu?
- Mengapa air murni berpindah ke gelas yang berisi larutan gula?
- Apakah yang sanggup Anda simpulkan dari percobaan ini. Diskusikan dengan teman sekelompok Anda.
Setelah dibiarkan beberapa waktu, volume larutan gula bertambah, sedangkan volume air murni berkurang. Mengapa? Fakta tersebut sanggup dijelaskan jikalau tekanan uap air murni lebih besar dari tekanan larutan yang mengandung zat nonvolatil, dan adanya kesetimbangan dinamis antara fasa uap dan cairannya. Oleh lantaran tekanan uap air murni lebih besar dari tekanan uap larutan gula maka untuk mencapai keadaan kesetimbangan, uap air murni akan diserap oleh larutan gula hingga tekanan uap di atas permukaan kedua cairan itu sama dan setimbang. Proses tersebut menghasilkan perpindahan molekul-molekul air dari pelarut murni melalui fasa uap ke dalam larutan gula hingga tekanan uap pada kedua permukaan cairan mencapai kesetimbangan.
3. Hukum Raoult
Baca rumus penurunan tekanan uap air jenuh di Hukum Raoult.
Anda kini sudah mengetahui Penurunan Tekanan Uap Jenuh. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Sunarya, Y. dan A. Setiabudi. 2009. Praktis dan Aktif Belajar Kimia 3 : Untuk Kelas XII Sekolah Menengah Atas / Madrasah Aliyah. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 298.
Referensi Lainnya :
[1] Pangajuanto, T. 2009. Kimia 3 : Untuk SMA/ MA Kelas XII. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 282.
No comments:
Post a Comment