Pengertian Rumus Stoikiometri Larutan dan Titrasi Asam Basa, Reaksi, Kimia, Contoh Soal, Pembahasan, Persamaan, Praktikum, Perhitungan - Hampir semua reaksi kimia ialah reaksi penetralan asam basa. Reaksi ini menghasilkan air dan suatu garam. Misalnya, bila Anda sakit maag akhir asam lambung berlebih, Anda membutuhkan antasid yang sanggup menetralkannya. Sama halnya dengan pH darah insan yang harus tetap netral (pH = 7). Hal ini dikendalikan oleh adanya reaksi kesetimbangan yang terlibat antara asam basa konjugat (H2CO3 dan HCO3–). Bagaimanakah menghitung pH adonan asam basa? Bagaimanakah memilih suatu reaksi telah mencapai titik setara? Untuk menjawab pertanyaan itu, Anda harus mengetahui berapa konsentrasi ion-ion dari masing-masing pereaksi.
Perhitungan kimia dalam larutan melibatkan konsentrasi molar ion-ion dalam larutan sanggup ditentukan melalui teknik titrasi. Titrasi asam basa merupakan salah satu jenis dari titrasi. Bagaimanakah metode pengukurannya? Kemudian, bagaimanakah penerapannya? Anda akan menemukan jawabannya setelah mempelajari potongan ini.
 |
| Peta konsep stoikiometri. |
A. Reaksi dalam Larutan
Hampir sebagian besar reaksi-reaksi kimia berlangsung dalam larutan. Ada tiga ciri reaksi yang berlangsung dalam larutan, yaitu terbentuk endapan, gas, dan penetralan muatan listrik. Ketiga reaksi tersebut umumnya tergolong reaksi metatesis yang melibatkan ion-ion dalam larutan. Oleh lantaran itu, Anda perlu mengetahui lebih jauh perihal ion-ion dalam larutan.
1.1. Persamaan Ion dan Molekul
Selama ini, Anda menuliskan reaksi-reaksi kimia di dalam larutan dalam bentuk molekuler. Contoh, reaksi antara natrium karbonat dan kalsium hidroksida. Persamaan reaksinya:
Na2CO3(aq) + Ca(OH)2(aq) → 2NaOH(aq) + CaCO3(s)
Persamaan reaksi ini disebut persamaan molekuler alasannya ialah zat-zat yang bereaksi ditulis dalam bentuk molekul. Persamaan molekul tidak menawarkan petunjuk bahwa reaksi itu melibatkan ion-ion dalam larutan, padahal Ca(OH)2 dan Na2CO3 di dalam air berupa ion-ion. Ion-ion yang terlibat dalam reaksi tersebut ialah ion Ca2+ dan ion OH– yang berasal dari Ca(OH)2 , serta ion Na+ dan ion CO32– yang berasal dari Na2CO3(aq) . Persamaan reaksi dalam bentuk ion ditulis sebagai berikut.
2Na+(aq) + CO32–(aq) + Ca2+(aq) + 2OH–(aq) → 2Na+(aq ) + 2OH–(aq) + CaCO3(s)
Persamaan ini dinamakan persamaan ion, yaitu suatu persamaan reaksi yang melibatkan ion-ion dalam larutan. Petunjuk pengubahan persamaan molekuler menjadi persamaan ion ialah sebagai berikut.
- Zat-zat ionik, ibarat NaCl umumnya ditulis sebagai ion-ion. Ciri-ciri zat ionik dalam persamaan reaksi memakai fasa (aq) .
- Zat-zat yang tidak larut (endapan) ditulis sebagai rumus senyawa. Ciri dalam persamaan reaksi dinyatakan dengan fasa (s).
Dalam persamaan ionik, ion-ion yang muncul di kedua ruas disebut ion spektator (ion penonton), yaitu ion-ion yang tidak turut terlibat dalam reaksi kimia. Ion-ion spektator sanggup dihilangkan dari persamaan ion. Contohnya, sebagai berikut.
Sehingga persamaan sanggup ditulis menjadi:
Ca2+(aq) + CO32–(aq) → CaCO3(s)
Persamaan ini dinamakan persamaan ion bersih. Dalam hal ini, ion OH– dan ion Na+ tergolong ion-ion spektator.
Contoh Penulisan Persamaan Ion Bersih (1) :
Tuliskan persamaan ion higienis dari persamaan molekuler berikut.
Na2CO3(aq) + 2HCl(aq) → 2NaCl(aq) + H2O(l) + CO2(g)
Pembahasan :
Natrium karbonat dalam air terurai membentuk ion-ion Na+ dan CO32–. HCl juga terurai dalam air menjadi ion H+ dan Cl–. Setelah terjadi reaksi, hanya NaCl yang tetap berada dalam bentuk ion-ion, yaitu Na+ dan Cl–, sedangkan yang lainnya berupa cairan murni dan gas. Karena Na+ dan Cl– tetap sebagai ion, ion-ion ini disebut ion spektator.
Dengan demikian, persamaan ion bersihnya sebagai berikut.
H+(aq) + CO32–(aq) → H2O(l) + CO2(g)
Contoh Soal UMPTN 2001 :
Reaksi antara reaksi Pb(NO3)2 dan H2SO4 dalam larutan paling tepat diberikan oleh persamaan ....
A. Pb(NO3)2(aq) + SO42–(aq) → PbSO4(aq) + 2NO3–(aq)
B. Pb(NO3)2(aq) + H2SO4(aq) → PbSO4(s) + 2HNO3(aq)
C. Pb2+(aq) + SO42- (aq) → PbSO4(s)
D. Pb2+(aq) + H2SO4(aq )→ PbSO4(s) + 2H+(aq)
E. Pb(NO3)2(aq) + SO42–(aq) → PbSO4(s) + 2NO3–(aq)
Pembahasan :
Pb(NO3)2(aq) + H2SO4(aq) → PbSO4(s) + 2HNO3(aq)
Reaksi ionnya ialah :
Pb2+(aq) + 2NO3–(aq) + 2H+(aq) + SO42–(aq) → PbSO4(s) + 2H+(aq) + 2NO3–(aq)
atau,
Pb2+(aq) + SO42–(aq) → PbSO4(s)
Jadi, jawabannya (C).
1.1.1. Reaksi Pengendapan
Reaksi dalam larutan tergolong reaksi pengendapan bila salah satu produk reaksi tidak larut di dalam air. Contoh zat yang tidak larut di dalam air, yaitu CaCO3 dan BaCO3. Untuk mengetahui kelarutan suatu zat dibutuhkan pengetahuan empirik sebagai hasil pengukuran terhadap banyak sekali zat.
MgCl2 akan mengendap jika Mg(NO3)2 direaksikan dengan HCl.
Perhatikanlah reaksi antara kalsium klorida dan natrium fosfat berikut.
MgCl2 akan mengendap jika Mg(NO3)2 direaksikan dengan HCl.
Perhatikanlah reaksi antara kalsium klorida dan natrium fosfat berikut.
3CaCl2 + 2Na3PO4 → Ca3(PO4)2 + 6NaCl
NaCl akan larut di dalam air, sedangkan Ca3(PO4)2 tidak larut. Senyawa-senyawa fosfat sebagian besar larut dalam air, kecuali senyawa fosfat dari natrium, kalium, dan amonium. Oleh lantaran itu, persamaan reaksi sanggup ditulis sebagai berikut.
3CaCl2(aq) + 2Na3PO4(aq) → Ca3(PO4)2(s) + 6NaCl(aq)
Dengan menghilangkan ion-ion spektator dalam persamaan reaksi itu, perasamaan ion higienis dari reaksi sanggup diperoleh.
3Ca2+(aq) + 2PO43–(aq) → Ca3(PO4)2(s)
Contoh Soal Meramalkan Reaksi Pembentukan Endapan (2) :
Tuliskan persamaan molekuler dan persamaan ion higienis dari reaksi berikut.
Al2(SO4)3 + 6NaOH → 2Al(OH)3 + 3Na2SO4
Penyelesaian :
Menurut data empirik diketahui aluminium sulfat larut, sedangkan aluminium hidroksida tidak larut. Oleh lantaran itu, reaksi pengendapan akan terjadi.
Al2(SO4)3(aq) + 6NaOH(aq) → 2Al(OH)3(s) + 3Na2SO4(aq)
Untuk memperoleh persamaan ion bersih, tuliskan zat yang larut sebagai ion-ion dan ion-ion spektator diabaikan.
2Al3+(a ) + 3SO42–(aq) + 6Na+(aq) + 6OH–(aq) → 2Al(OH)3(s) + 6Na+(aq) +3SO42–(aq)
Jadi, persamaan ion bersihnya sebagai berikut.
Al3+(aq) + 3OH–(aq) → Al(OH)3(s)
1.1.2. Reaksi Pembentukan Gas
Reaksi Mg dengan asam sulfat merupakan reaksi kimia yang menghasilkan gas.
Reaksi kimia dalam larutan, selain sanggup membentuk endapan juga ada yang menghasilkan gas. Misalnya, reaksi antara natrium dan asam klorida membentuk gas hidrogen. Persamaan reaksinya:
Reaksi kimia dalam larutan, selain sanggup membentuk endapan juga ada yang menghasilkan gas. Misalnya, reaksi antara natrium dan asam klorida membentuk gas hidrogen. Persamaan reaksinya:
Na(s) + 2HCl(aq) → 2NaCl(aq) + H2(g)
Beberapa reaksi yang menghasilkan gas disajikan pada tabel berikut.
Tabel 1. Beberapa Contoh Reaksi yang Menghasilkan Gas
Jenis Gas | Contoh Reaksi |
CO2 | Na2CO3(aq) + 2HCl(aq) → 2NaCl(aq) + H2O(l) + CO2(g) |
H2S | Na2S(aq) + 2HCl(aq) → 2NaCl(aq) + H2S(g) |
SO2 | Na2SO3(aq) + 2HCl(aq) → 2NaCl(aq) + H2O(l) + SO2(g) |
Contoh Soal Reaksi Kimia yang Menghasilkan Gas (3) :
Tuliskan persamaan molekuler dan persamaan ionik untuk reaksi seng sulfida dan asam klorida.
Jawaban :
Reaksi metatesisnya sebagai berikut.
ZnS(s) + 2HCl(aq) → ZnCl2(aq) + H2S(g)
Dari data kelarutan diketahui bahwa ZnS tidak larut dalam air, sedangkan ZnCl2 larut. Dengan demikian, persamaan ionnya sebagai berikut.
ZnS(s) + 2H+(aq) → Zn2+(aq) + H2S(g)
Untuk mengetahui reaksi kimia yang terjadi dalam larutan, Anda sanggup melaksanakan acara berikut.
Praktikum Kimia Reaksi Kimia dalam Larutan (1) :
Tujuan :
Mengamati perubahan reaksi dalam larutan.
Alat :
- Tabung reaksi
- Pipet tetes
Bahan :
- Larutan CuSO4 0,1 M 5. Serbuk Na2CO3
- Larutan NaOH 0,1 M 6. Metanol
- Larutan NH3 0,5 M 7. H2SO4 pekat
- Larutan HCl 0,5 M 8. KMnO4
Langkah Kerja :
- Masukkan larutan CuSO4 0,1 M ke dalam tabung reaksi yang berisi larutan NaOH 0,1 M. Amati perubahan yang terjadi.
- Masukkan larutan NH3 0,1 M tetes demi tetes ke dalam larutan yang berisi larutan CuSO4 0,1 M. Amati perubahan yang terjadi.
- Masukkan serbuk Na2CO3 ke dalam tabung reaksi yang berisi larutan HCl 0,5 M. Amati perubahan yang terjadi.
- Masukkan H2SO4 pekat dengan cara mengalirkan tetesannya melalui dinding tabung reaksi yang berisi metanol secara hati-hati hingga terbentuk dua lapisan (jangan dikocok), kemudian tambahkan beberapa butir KMnO4. Amati perubahan yang terjadi.
Pertanyaan :
- Tuliskan persamaan reaksi yang terjadi dalam bentuk molekuler dan persamaan ion bersihnya.
- Apakah yang sanggup Anda simpulkan dari percobaan tersebut. Diskusikan dengan teman-teman Anda?
1.2. Reaksi Penetralan Asam Basa
Apa yang terjadi bila asam direaksikan dengan basa? Untuk mengetahui hal ini, lakukanlah percobaan berikut.
Praktikum Kimia Reaksi Penetralan Asam Basa (2) :
Tujuan :
Mengamati reaksi penetralan asam basa.
Alat :
- Indikator universal
- Gelas kimia
Bahan :
- 25 mL HCl 0,1 M
- 25 mL NaOH 0,1 M
Langkah Kerja :
- Tentukan pH 25 mL HCl 0,1 M yang disimpan dalam gelas kimia 1 dengan memakai indikator universal.
- Tentukan pH 25 mL NaOH 0,1 M yang disimpan dalam gelas kimia 2 dengan memakai indikator universal.
- Campurkan kedua larutan tersebut dan kocok. Ukurlah kembali pH larutan yang telah dicampurkan.
Pertanyaan :
- Tuliskan persamaan reaksi yang terjadi dalam bentuk molekuler dan persamaan ion bersihnya.
- Berapakah pH larutan masing-masing larutan?
- Apakah pH adonan mendekati nilai 7 (pH netral)?
Di dalam air, asam besar lengan berkuasa terurai membentuk ion H+ dan ion sisa asam. Keberadaan ion H+ dalam larutan asam ditunjukkan oleh nilai pH yang rendah (pH = –log [H+] < 7).
Dalam larutan basa akan terbentuk ion OH– dan ion sisa basa. Keberadaan ion OH– dalam larutan basa ditunjukkan oleh nilai pH yang tinggi (pH = 14 – pOH > 7).
Jika larutan asam dan basa dicampurkan akan terjadi reaksi penetralan ion H+ dan OH– . Bukti terjadinya reaksi penetralan ini ditunjukkan oleh nilai H mendekati 7 (pH ≈ 7). Nilai pH ≈ 7 memperlihatkan tidak ada lagi ion H+ dari asam dan ion OH– dari basa selain ion H+ dan OH– hasil ionisasi air. Dengan demikian, intinya reaksi asam basa ialah reaksi penetralan ion H+ dan OH– . Persamaan reaksi molekulernya:
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l)
Persamaan reaksi ionnya :
H+(aq) + Cl–(aq) + Na+(aq) + OH–(aq) → Na+(aq) + Cl(aq) + H2O(l)
Persamaan ion bersihnya :
H+(aq) + OH–(aq) → H2O(l)
Reaksi asam basa disebut juga reaksi penggaraman alasannya ialah dalam reaksi asam basa selalu dihasilkan garam. Pada reaksi HCl dan NaOH dihasilkan garam dapur (NaCl).
Beberapa tumpuan reaksi penetralan asam basa atau reaksi pembentukan garam sebagai berikut.
a. H2SO4(aq) + Mg(OH)2(aq) → MgSO4(aq) + 2H2O(l)
b. HNO3(aq) + Ca(OH)2(aq) → Ca(NO3)2(aq) + H2O(l)
c. HCl(aq) + NH4OH(aq) → NH4Cl(aq) + H2O(l)
1.3. Perhitungan Kuantitatif Reaksi dalam Larutan
Perhitungan kuantitatif reaksi-reaksi kimia dalam larutan umumnya melibatkan konsentrasi molar dan pH. Hal-hal yang perlu diketahui dalam mempelajari stoikiometri larutan ialah apa yang diketahui dan yang ditanyakan, kemudian diselesaikan dengan empat langkah berikut.
- Tuliskan persamaan reaksi setara.
- Ubah besaran yang diketahui ke satuan mol.
- Gunakan perbandingan koefisien dari persamaan kimia setara untuk memilih besaran yang tidak diketahui dalam mol.
- Ubah satuan mol ke dalam besaran yang ditanyakan.
Contoh Soal Menentukan Volume Pereaksi (4) :
Berapa mililiter NaOH 0,25 M harus ditambahkan supaya bereaksi tepat dengan 25 mL H2SO4 0,1 M.
Jawaban :
Tahap 1: Tuliskan persamaan kimia.
H2SO4(aq) + 2NaOH(aq) → Na2SO4(aq) + 2H2O(l)
Tahap 2: Ubah besaran yang diketahui ke dalam satuan mol.
Tahap 3:Tentukan rasio stoikiometri (RS) reaksi untuk memilih jumlah mol yang dicari.
Tahap 4: Ubah satuan mol ke dalam satuan yang ditanyakan.
Volume NaOH =  x 1.000 mL larutan = 20 mL
x 1.000 mL larutan = 20 mL
Jadi, volume NaOH 0,25 M yang harus ditambahkan ialah 20 mL.
Contoh Soal Menentukan Berat Hasil Reaksi (5) :
Jika 25 mL larutan BaCl2 0,1 M direaksikan dengan 25 mL larutan Na2SO4 0,25 M, berapakah massa BaSO4 yang diendapkan?
Penyelesaian :
Tahap 1: Tuliskan persamaan kimia.
BaCl2(aq) + Na2SO4(aq) → BaSO4(s) + 2NaCl(aq)
Tahap 2–3: Ubah konsentrasi masing-masing pereaksi ke dalam satuan mol, tentukan pereaksi pembatas, tentukan nilai RS, dan hitung jumlah mol BaSO4.
Jumlah mol BaCl2 :
Jumlah mol Na2SO4 :
Jumlah mol pereaksi paling sedikit menjadi pereaksi pembatas. Dalam reaksi ini adalah BaCl2 . Oleh lantaran itu, jumlah mol BaSO4 ditentukan oleh BaCl2 .
Jumlah mol BaSO4 = RS × mol BaCl2
Tahap 4: Hitung massa BaSO4 yang terbentuk.
Massa molar BaSO4 = 233 g mol–1
Massa BaSO4 = 233 g mol–1 × 2,5 × 10–3 mol = 0,58 g
Jadi, massa BaSO4 yang terbentuk ialah 0,58 g.
Contoh Soal SPMB 2005 :
Berapakah pH larutan yang diperoleh dengan mencampurkan 50 mL HNO3 0,2 M dan 50 mL KOH 0,4 M?
A. 2
B. 5
C. 7
D. 10
E. 13
Pembahasan :
Persamaan reaksi :
HNO3 + KOH→ KNO3 + H2O
Zat tersisa basa besar lengan berkuasa = = 0,1 M (pOH = 1)
= 0,1 M (pOH = 1)
maka pH basa besar lengan berkuasa ialah ...
pH = 14 – pOH = 14 – 1 = 13
Jadi, jawabannya (E).
1.4. Perhitungan pH Campuran
Berapakah pH larutan yang diperoleh dengan mencampurkan 50 mL HNO3 0,2 M dan 50 mL KOH 0,4 M?
A. 2
B. 5
C. 7
D. 10
E. 13
Pembahasan :
Persamaan reaksi :
HNO3 + KOH→ KNO3 + H2O
| mmol awal | 10 | 20 | |
| mmol bereaksi | 10 | 10 | 10 |
| mmol sisa | 0 | 10 | 10 |
Zat tersisa basa besar lengan berkuasa =
maka pH basa besar lengan berkuasa ialah ...
pH = 14 – pOH = 14 – 1 = 13
Jadi, jawabannya (E).
1.4. Perhitungan pH Campuran
Jika larutan asam atau basa dicampurkan dengan larutan asam atau basa yang sejenis atau berbeda jenis maka konsentrasi asam atau basa dalam larutan itu akan berubah. Perubahan konsentrasi ini tentu akan mengubah pH larutan hasil pencampuran. Perhatikan contoh-contoh berikut.
Contoh Soal Menghitung pH Campuran Asam yang Sama (6) :
Sebanyak 50 mL larutan HCl 0,1 M dicampurkan dengan 100 mL larutan HCl 0,5 M. Berapakah pH larutan sebelum dan setelah dicampurkan?
Jawaban :
pH 50 mL larutan HCl 0,1 M = –log [H+] = 1,0
pH 100 mL larutan HCl 0,5 M = –log (0,5) = 0,3
Setelah dicampurkan, volume adonan menjadi 150 mL. Jumlah mol HCl dalam adonan sebagai berikut.
50 mL × 0,1 mmol mL–1 HCl = 5 mmol
100mL × 0,5 mmol mL–1 HCl = 50 mmol
Konsentrasi molar HCl dalam adonan =  = 0,367 M
= 0,367 M
Jadi, pH adonan = –log [0,367] = 0,44
Pencampuran larutan asam dan basa akan membentuk reaksi penetralan. Jika jumlah mol asam dan basa dalam adonan itu sama, terjadilah penetralan tepat sehingga pH larutan sama dengan 7. Tetapi, bila terdapat salah satu pereaksi berlebih, kelebihannya akan memilih pH larutan hasil pencampuran.
Contoh Soal Menghitung pH Campuran Asam dan Basa (7) :
Jika 25 mL HCl 0,5 M dicampurkan dengan 50 mL NaOH 0,1 M, bagaimanakah pH hasil pencampuran?
Pembahasan :
Untuk mengetahui nilai pH adonan asam basa, perlu ditentukan jumlah mol asam atau basa yang berlebih setelah terjadi reaksi penetralan.
H+(aq) + OH–(aq) → H2O(l)
Jumlah mol ion H+ dalam HCl = 25 mL × 0,5 mmol mL–1 = 12,5 mmol
Jumlah mol ion OH– dalam NaOH = 50 mL × 0,1 mmol mL–1 = 5 mmol
Seluruh ion OH– dinetralkan oleh ion H+ sehingga sisa ion H+ dalam larutan sebanyak 7,5 mmol. Karena volume adonan 75 mL maka konsentrasi molar ion H+ sisa :
[H+] =  = 0,1 M
= 0,1 M
Dengan demikian, pH adonan = –log (0,1) = 1.
Reaksi Penetralan di Lambung
Pernahkah Anda sakit maag? Maag terjadi lantaran kelebihan asam lambung (HCl) sehingga lambung terasa sakit. Mengapa? Hal ini terjadi lantaran dinding lambung mengalami peradangan. Untuk menetralkan kelebihan asam lambung tersebut digunakan suatu basa yang dinamakan antasida sehingga rasa nyeri pada lambung akan berkurang. Contoh suatu antasida di antaranya adalah Al(OH)3, Mg(OH)2, dan CaCO3.(Sumber: Introductory Chemistry, 1997)
B. Titrasi Asam Basa
Titrasi ialah suatu metode untuk memilih konsentrasi zat di dalam larutan. Titrasi dilakukan dengan cara mereaksikan larutan tersebut dengan larutan yang sudah diketahui konsentrasinya. Reaksi dilakukan secara sedikit demi sedikit (tetes demi tetes) hingga tepat mencapai titik stoikiometri atau titik setara. Ada beberapa macam titrasi bergantung pada jenis reaksinya, ibarat titrasi asam basa, titrasi permanganometri, titrasi argentometri, dan titrasi iodometri. Pada topik berikut akan diuraikan mengenai titrasi asam basa.
2.1. Indikator Asam Basa
Dalam titrasi asam basa, zat-zat yang bereaksi umumnya tidak berwarna sehingga Anda tidak tahu kapan titik stoikiometri tercapai. Misalnya, larutan HCl dan larutan NaOH, keduanya tidak berwarna dan setelah bereaksi, larutan NaCl yang terbentuk juga tidak berwarna.
Untuk menandai bahwa titik setara pada titrasi telah dicapai digunakan indikator atau penunjuk. Indikator ini harus berubah warna pada dikala titik setara tercapai. Apakah indikator asam basa itu? Indikator asam basa ialah petunjuk perihal perubahan pH dari suatu larutan asam atau basa. Indikator bekerja menurut perubahan warna indikator pada rentang pH tertentu. Anda tentu mengenal kertas lakmus, yaitu salah satu indikator asam basa. Lakmus merah berubah warna menjadi biru bila dicelupkan ke dalam larutan basa. Lakmus biru bermetamorfosis merah bila dicelupkan ke dalam larutan asam.
 |
| Trayek pH beberapa larutan. |
Terdapat beberapa indikator yang mempunyai trayek perubahan warna cukup akurat akhir pH larutan berubah, ibarat indikator metil jingga, metil merah, fenolftalein, alizarin kuning, dan brom timol biru.
Kertas lakmus mempunyai trayek pH kurang akurat dibandingkan indikator lain. Trayek pH dari kertas lakmus sekitar pH 5 - 9.
Untuk mengetahui pada pH berapa suatu indikator berubah warna (trayek pH indikator), Anda sanggup melaksanakan percobaan berikut.
Praktikum Kimia Perubahan Warna Indikator (3) :
Tujuan :
Mengamati pH suatu indikator berubah warna.
Alat :
Tabung reaksi
Bahan :
- Indikator
- Larutan asam
- Larutan basa
- Larutan netral
Langkah Kerja :
- Isilah 14 tabung reaksi dengan larutan pH = 1 hingga pH = 14.
- Tambahkan 1 tetes indikator (setiap kelompok kerja memakai indikator yang berbeda).
- Amatilah perubahan warna pada larutan dan catatlah pada pH berapa indikator tersebut berubah warna.
Pertanyaan :
- Pada pH berapakah indikator yang Anda gunakan berubah warna?
- Mengapa suatu indikator akan berubah warna pada pH yang tertentu saja?
Data hasil percobaan ditabulasikan ke dalam bentuk tabel ibarat berikut.
Tabel 2. Warna pH Hasil Percobaan dengan Beberapa Indikator
Indikator | Warna pada pH Rendah | Trayek pH | Warna pada pH Tinggi |
Brom fenol biru | Kuning | 4 – 5,5 | Biru |
Brom timol biru | Kuning | 6 – 8 | Biru |
Fenolftalein | Takberwarna | 8,5 – 10 | Merah jambu |
Alizarin kuning | Kuning | 10 – 12 | Merah |
Sumber : General Chemistry, 1990 | |||
Indikator asam basa umumnya berupa molekul organik yang bersifat asam lemah dengan rumus HIn. Indikator menawarkan warna tertentu ketika ion H+ dari larutan asam terikat pada molekul HIn dan berbeda warna ketika ion H+ dilepaskan dari molekul HIn menjadi In– . Salah satu indikator asam basa ialah fenolftalein (PP), indikator ini banyak digunakan lantaran harganya murah. Indikator PP tidak berwarna dalam bentuk HIn (asam) dan berwarna merah jambu dalam bentuk In– (basa). Perhatikan struktur fenolftalein berikut.
 |
| Bentuk asam (HIn), tidak berwarna. |
 |
| Bentuk basa (In–), merah jambu. |
Jika ke dalam larutan ditetesi indikator pada pH = 3 atau [H+] = 1,0 × 10–3 M, dihasilkan perbandingan :
Perbandingan tersebut memperlihatkan bahwa struktur yang lebih lebih banyak didominasi ialah bentuk HIn (tidak berwarna).
Jika ion OH– (basa) ditambahkan ke dalam larutan, [H+] berkurang dan posisi kesetimbangan bergeser ke arah pembentukan In– . Ini berarti mengubah HIn menjadi In– . Jika ion OH– ditambahkan terus, bentuk In– dominan dan larutan berwarna merah jambu.
2.2. Titrasi Asam Basa
Dalam melaksanakan titrasi, larutan yang dititrasi, disebut titrat dimasukkan ke dalam labu erlenmeyer (biasanya larutan asam), sedangkan larutan pentitrasi, disebut titran (biasanya larutan basa) dimasukkan ke dalam buret. Titran dituangkan dari buret tetes demi tetes ke dalam larutan titrat hingga titik stoikiometri tercapai (lihat Gambar 1). Oleh lantaran kemampuan mata kita terbatas dalam mengamati warna larutan maka penggunaan indikator dalam titrasi asam basa selalu mengandung risiko kesalahan. Jika indikator PP digunakan pada titrasi HCl–NaOH maka pada dikala titik setara tercapai (pH = 7) indikator PP belum berubah warna dan akan berubah warna ketika pH 8.
Cara melaksanakan titrasi (tangan kanan menggoyangkan labu, tangan kiri memegang kran buret).
Cara melaksanakan titrasi (tangan kanan menggoyangkan labu, tangan kiri memegang kran buret).
 |
| Gambar 1. Set alat untuk titrasi asam basa. |
Jadi, ada kesalahan titrasi yang tidak sanggup dihindari sehingga pada waktu Anda menghentikan titrasi (titik final titrasi) ditandai dengan warna larutan agak merah jambu, adapun titik setara sudah dilampaui. Dengan kata lain, titik final titrasi tidak sama dengan titik stoikiometri. Jika dalam titrasi HCl–NaOH memakai indikator brom timol biru (BTB), dimana trayek pH indikator ini ialah 6 (kuning) dan 8 (biru) maka pada dikala titik setara tercapai (pH =7) warna larutan adonan menjadi hijau. Kekurangan yang utama dari indikator BTB ialah mengamati warna hijau tepat pada pH = 7 sangat sukar, mungkin lebih atau kurang dari 7.
Alat yang dibutuhkan untuk titrasi, di antaranya buret, labu erlenmeyer, statif, dan pipet volume. Lakukanlah acara berikut.
Praktikum Kimia Titrasi Asam Basa (4) :
Tujuan :
Menentukan konsentrasi asam (HCl) dengan cara titrasi asam basa.
Alat :
Praktikum Kimia Titrasi Asam Basa (4) :
Tujuan :
Menentukan konsentrasi asam (HCl) dengan cara titrasi asam basa.
Alat :
- Buret
- Statif
- Erlenmeyer
- Pipet volume
- Larutan HCl
- Larutan NaOH 0,1 M
- Indikator fenoftalein
- Masukkan larutan NaOH 0,1 M ke dalam buret hingga volumenya terukur.
- Pipet 10 mL larutan HCl, kemudian masukkan ke dalam labu erlenmeyer. Tambahkan 2 tetes indikator fenolftalein.
- Lakukan tirasi dengan cara memasukkan larutan NaOH dari buret ke dalam labu erlenmeyer setetes demi setetes.
- Hentikan titrasi ketika adonan dalam labu erlenmeyer akan berubah warna (hampir merah muda).
- Lakukan percobaan tiga kali (triplo). Hitung rata-rata volume NaOH yang dibutuhkan untuk menetralkan larutan HCl.
- Mengapa titrasi harus dilarang ketika adonan berubah warna?
- Jika volume NaOH yang dibutuhkan 10 mL, berapakah konsentrasi HCl yang dititrasi?
- Diskusikan hasil pengamatan percobaan ini dengan teman-teman Anda.
Titrasi asam basa intinya ialah reaksi penetralan asam oleh basa atau sebaliknya. Persamaan ion bersihnya :
H+(aq) + OH–(aq) → H2O(l)
Ketika adonan berubah warna, itu memperlihatkan ion H+ dalam larutan HCl telah dinetralkan seluruhnya oleh ion OH– dari NaOH. Jika larutan NaOH ditambahkan terus, dalam adonan akan kelebihan ion OH– (ditunjukkan oleh warna larutan merah jambu).
Berikut akan dibahas cara perhitungan titrasi asam besar lengan berkuasa oleh basa kuat, contohnya 50 mL larutan HCl 0,1 M oleh NaOH 0,1 M. Kemudian, menghitung pH larutan pada titik-titik tertentu selama titrasi.
a. Sebelum NaOH Ditambahkan
HCl ialah asam besar lengan berkuasa dan di dalam air terionisasi tepat sehingga larutan mengandung spesi utama : H+ , Cl– , dan H2O . Nilai pH ditentukan oleh jumlah H+ dari HCl. Karena konsentrasi awal HCl 0,1 M, larutan HCl tersebut mengandung 0,1 M H+ dengan nilai pH = 1 (Gambar 2).
b. Penambahan 10 mL NaOH 0,1 M
Dengan penambahan NaOH, berarti menetralkan ion H+ oleh ion OH– sehingga konsentrasi ion H+ berkurang. Dalam adonan reaksi, sebanyak (10 mL × 0,1 M = 1 mmol) OH– yang ditambahkan bereaksi dengan 1 mmol H+ membentuk H2O .
Tabel 3. Pengaruh Penambahan OH– terhadap Konsentrasi H+ .
Setelah terjadi reaksi, larutan mengandung: H+, Cl– , Na+ , dan H2O . Nilai pH ditentukan oleh [H+] sisa :
[H+] = =
=  = 0,07 M
= 0,07 M
pH = – log (0,07) = 1,18.
c. Penambahan 10 mL NaOH 0,1 M Berikutnya
Pada penambahan 10 mL NaOH 0,1 M berikutnya akan terjadi perubahan konsentrasi pada H+ (Gambar 3).
Perhatikan tabel berikut.
Tabel 4. Pengaruh Penambahan OH– Berikutnya terhadap Konsentrasi H+ .
Setelah terjadi reaksi, nilai pH ditentukan oleh [H+] sisa :
[H+] = = 0,04 M
= 0,04 M
pH = –log (0,04) = 1,37.
d. Penambahan NaOH 0,1 M Sampai 50 mL
Pada titik ini, jumlah NaOH yang ditambahkan ialah 50 mL × 0,1 M = 5 mmol dan jumlah HCl total ialah 50 mL × 0,1 M = 5 mmol. Jadi, pada titik ini ion H+ tepat dinetralkan oleh ion OH– . Titik dimana terjadi netralisasi secara tepat dinamakan titik stoikiometri atau titik ekui alen. Pada titik ini, spesi utama yang terdapat dalam larutan adalah Na+, Cl–, dan H2O. Karena Na+ dan Cl– tidak mempunyai sifat asam atau basa, larutan bersifat netral atau mempunyai nilai pH = 7 (Gambar 3).
e. Penambahan NaOH 0,1 M Berlebih (sampai 75 mL)
Penambahan NaOH 0,1 M berlebih mengakibatkan pH pada larutan menjadi basa lantaran lebih banyak konsentrasi OH– dibandingkan H+ .
Perhatikan tabel berikut.
Tabel 5. Pengaruh Penambahan OH– Berlebih terhadap Konsentrasi Larutan
Setelah bereaksi, ion OH– yang ditambahkan berlebih sehingga sanggup memilih pH larutan.
[OH–] = =
=  = 0,02 M
= 0,02 M
pOH = – log (0,02) = 1,7
pH larutan = 14 – pOH = 12,3
H+(aq) + OH–(aq) → H2O(l)
Ketika adonan berubah warna, itu memperlihatkan ion H+ dalam larutan HCl telah dinetralkan seluruhnya oleh ion OH– dari NaOH. Jika larutan NaOH ditambahkan terus, dalam adonan akan kelebihan ion OH– (ditunjukkan oleh warna larutan merah jambu).
Berikut akan dibahas cara perhitungan titrasi asam besar lengan berkuasa oleh basa kuat, contohnya 50 mL larutan HCl 0,1 M oleh NaOH 0,1 M. Kemudian, menghitung pH larutan pada titik-titik tertentu selama titrasi.
a. Sebelum NaOH Ditambahkan
HCl ialah asam besar lengan berkuasa dan di dalam air terionisasi tepat sehingga larutan mengandung spesi utama : H+ , Cl– , dan H2O . Nilai pH ditentukan oleh jumlah H+ dari HCl. Karena konsentrasi awal HCl 0,1 M, larutan HCl tersebut mengandung 0,1 M H+ dengan nilai pH = 1 (Gambar 2).
 |
| Sebelum NaOH ditambahkan, dalam larutan hanya ada ion H+ dan Cl–. |
Dengan penambahan NaOH, berarti menetralkan ion H+ oleh ion OH– sehingga konsentrasi ion H+ berkurang. Dalam adonan reaksi, sebanyak (10 mL × 0,1 M = 1 mmol) OH– yang ditambahkan bereaksi dengan 1 mmol H+ membentuk H2O .
Tabel 3. Pengaruh Penambahan OH– terhadap Konsentrasi H+ .
Konsentrasi (M) | H(aq) | Penambahan OH– (aq) |
Sebelum reaksi | 50 mL × 0,1 M = 5 mmol | 10 mL × 0,1 M = 1 mmol |
Setelah reaksi | (5 – 1) mmol = 4 mmol | (1 – 1) mmol = 0 |
Setelah terjadi reaksi, larutan mengandung: H+, Cl– , Na+ , dan H2O . Nilai pH ditentukan oleh [H+] sisa :
[H+] =
pH = – log (0,07) = 1,18.
c. Penambahan 10 mL NaOH 0,1 M Berikutnya
Pada penambahan 10 mL NaOH 0,1 M berikutnya akan terjadi perubahan konsentrasi pada H+ (Gambar 3).
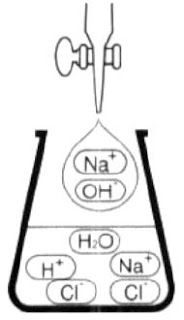 |
| Gambar 3. Penambahan NaOH belum sanggup menetralkan semua ion ion H+ dalam larutan HCl. |
Tabel 4. Pengaruh Penambahan OH– Berikutnya terhadap Konsentrasi H+ .
Konsentrasi (M) | H(aq) | Penambahan OH– (aq) |
Sebelum reaksi | 4 mmol (sisa sebelumnya) | 10 mL × 0,1 M = 1 mmol |
Setelah reaksi | (4 – 1) mmol = 3 mmol | (1 – 1) mmol = 0 |
Setelah terjadi reaksi, nilai pH ditentukan oleh [H+] sisa :
[H+] =
pH = –log (0,04) = 1,37.
d. Penambahan NaOH 0,1 M Sampai 50 mL
Pada titik ini, jumlah NaOH yang ditambahkan ialah 50 mL × 0,1 M = 5 mmol dan jumlah HCl total ialah 50 mL × 0,1 M = 5 mmol. Jadi, pada titik ini ion H+ tepat dinetralkan oleh ion OH– . Titik dimana terjadi netralisasi secara tepat dinamakan titik stoikiometri atau titik ekui alen. Pada titik ini, spesi utama yang terdapat dalam larutan adalah Na+, Cl–, dan H2O. Karena Na+ dan Cl– tidak mempunyai sifat asam atau basa, larutan bersifat netral atau mempunyai nilai pH = 7 (Gambar 3).
 |
| Gambar 4. Semua ion H+ dapat dinetralkan oleh ion OH–(titik ekuivalen). |
Penambahan NaOH 0,1 M berlebih mengakibatkan pH pada larutan menjadi basa lantaran lebih banyak konsentrasi OH– dibandingkan H+ .
 |
| Gambar 5. Penambahan NaOH setelah titik setara mengubah pH sangat drastis. |
Tabel 5. Pengaruh Penambahan OH– Berlebih terhadap Konsentrasi Larutan
Konsentrasi (M) | H(aq) | Penambahan OH– (aq) |
Sebelum reaksi | 5 mmol (jumlah awal) | 75 mL × 0,1 M = 7,5 mmol |
Setelah reaksi | 0 | (7,5 – 5) mmol = 2,5 mmol |
Setelah bereaksi, ion OH– yang ditambahkan berlebih sehingga sanggup memilih pH larutan.
[OH–] =
pOH = – log (0,02) = 1,7
pH larutan = 14 – pOH = 12,3
Hasil perhitungan selanjutnya disusun ke dalam bentuk kurva yang menyatakan penambahan konsentrasi NaOH terhadap pH larutan ibarat ditunjukkan pada Gambar 6.
 |
| Gambar 6. Tabel dan kurva penambahan konsentrasi NaOH terhadap pH larutan. |
Kurva pH titrasi asam-basa mempunyai ciri :
(1) Bentuk kurva selalu berupa sigmoid
(2) Pada titik setara, pH sama dengan 7.
(3) Ketika mendekati titik ekuivalen, bentuk kurva tajam.
Titik final titrasi sanggup sama atau berbeda dengan titik ekuivalen bergantung pada indikator yang digunakan. Jika indikator yang digunakan mempunyai trayek pH 6–8 (indikator BTB), mungkin titik final titrasi sama dengan titik ekuivalen.
Titik final titrasi ialah dikala titrasi dilarang ketika adonan tepat berubah warna. Pada umumnya, pH pada titik final titrasi lebih besar dari pH titik ekuivalen alasannya ialah pada dikala titik ekuivalen tercapai, larutan belum berubah warna apabila indikator yang digunakan ialah fenolftalein.
Contoh Soal Menghitung pH Titrasi Asam Basa (6) :
Sebanyak 25 mL larutan HCl 0,1 M dititrasi dengan NaOH 0,1 M. Hitung pH larutan:
a. sebelum penambahan NaOH
b. setelah penambahan NaOH 25 mL
Jawaban :
a. Nilai pH ditentukan oleh jumlah H+ dari HCl. Konsentrasi awal HCl = 0,1 M maka larutan akan mengandung 0,1 M H+.
[H+] = 0,1 M dan pH = 1.
b. Jumlah NaOH yang ditambahkan ialah :
25 mL × 0,1 M = 2,5 mmol.
Jumlah asam klorida mula-mula ialah :
25 mL × 0,1 M = 2,5 mmol.
Ion OH– yang ditambahkan bereaksi tepat dengan H+, dikala [H+] = [OH–]. Pada titik ini dinamakan titik ekuivalen titrasi. Pada titik ekuivalen, konsentrasi H+ yang terdapat dalam larutan hanya berasal dari ionisasi air. Jadi, pH = 7.
Rangkuman :
- Stoikiometri larutan melibatkan konsep mol dalam memilih konsentrasi zat-zat di dalam larutan.
- Reaksi asam dan basa merupakan reaksi penetralan ion H+ oleh OH– . Reaksi asam basa juga dinamakan reaksi penggaraman.
- Indikator asam basa ialah asam-asam lemah organik yang sanggup berubah warna pada rentang pH tertentu.
- Rentang pH pada dikala indikator berubah warna dinamakan trayek pH indikator.
- Titrasi asam basa ialah suatu teknik untuk memilih konsentrasi asam atau basa dengan cara titrasi.
- Titik setara atau titik stoikiometri ialah titik pada dikala titrasi, asam dan basa tepat ternetralkan. Titik final titrasi sanggup sama atau berbeda dengan titik setara.
Referensi :
Sunarya, Y. dan A. Setiabudi. 2009. Praktis dan Aktif Belajar Kimia 2 : Untuk Kelas XI Sekolah Menengah Atas/Madrasah Aliyah Program Ilmu Pengetahuan Alam. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta. p. 250.

No comments:
Post a Comment