Tetapan Kesetimbangan Kimia, Bunyi Hukum Kesetimbangan, Rumus Kc, Contoh Soal, Pembahasan - Dalam keadaan setimbang, perbandingan konsentrasi pereaksi dan hasil reaksi tergantung pada suhu dan jenis reaksi kesetimbangan. Cato Maximilian Guldberg dan Peter Waage, dua andal kimia dari Norwegia, menyatakan bahwa dalam reaksi kesetimbangan berlaku hukum kesetimbangan. (Baca juga : Kesetimbangan Kimia)
Bunyi Hukum Kesetimbangan :
"Dalam keadaan setimbang pada suhu tertentu, hasil perkalian konsentrasi hasil reaksi dibagi perkalian konsentrasi pereaksi yang masing-masing dipangkatkan koefisiennya memiliki nilai konstan."
Sementara itu, tetapan kesetimbangan menurut konsentrasi (Kc) ialah hasil perkalian konsentrasi hasil reaksi dibagi perkalian konsentrasi pereaksi yang masing-masing dipangkatkan koefisiennya.
Dalam kesetimbangan homogen, rumusan Kc dihitung dari konsentrasi semua zat yang terlibat dalam reaksi. Perhatikan reaksi berikut.
pA(g) + qB(g) D rC(g) + sD(g)
Untuk menghitung besar Kc pada kesetimbangan homogen, dipergunakan rumus berikut.
Kc adalah konstanta atau tetapan kesetimbangan konsentrasi yang harganya tetap selama suhu tetap. [P], [Q], [R], dan [S] ialah konsentrasi zat P, Q, R, dan S (satuan M (molaritas) atau mol/liter).
Sedangkan untuk kesetimbangan heterogen, rumusan Kc dihitung dari:
- Untuk adonan gas dengan padat, yang diperhitungkan hanya zat yang berfasa gas.
- Untuk adonan larutan dengan padat, yang diperhitungkan hanya larutan saja.
Zat-zat yang terdapat dalam kesetimbangan berbentuk padat (s), larutan (aq), gas (g), dan cair (l). Tetapi yang dimasukkan dalam tetapan kesetimbangan konsentrasi hanya zat-zat yang berbentuk gas (g) dan larutan (aq) saja. Hal ini disebabkan konsentrasi zat padat ialah tetap dan nilainya telah terhitung dalam harga Kc itu. [1]
Contoh Tetapan Kesetimbangan : [1]
1. C(s) + CO2(g) D 2CO(g)
2. Zn(s) + Cu2+(aq) D Zn2+(aq) + Cu(s)
3. CH3COO–(aq) + H2O(l) D CH3COOH(aq) + OH–(aq)
4. 2HI(g) D H2(g) + I2(g)
Berdasarkan uraian di atas, kalian tentu sudah sanggup memilih harga Kc, bukan? Agar kalian sanggup menghitung harga Kc dengan tepat, perhatikan teladan berikut.
Contoh Soal Tetapan Kesetimbangan (1) :
a. 5CO(g) + I2O5(s) D I2(g) + 5CO2(g)
b. 2NaHCO3(s) D Na2CO3(s) + CO2(g) + H2O(g)
Kc = [CO2] [H2O]
c. H2O(l) D H2O(g)
Kc = [H2O]
d. Pada suhu 200 °C, dalam ruang yang bervolume 1 liter terdapat sistem kesetimbangan berikut.
2HI(g) D H2(g) + I2(g)
Jika pada kesetimbangan terdapat 0,01 mol H2 dan 0,01 mol I2, tentukan harga Kc dari reaksi tersebut.
Penyelesaian :
Diketahui :
Mol H2 = 0,01 mol
Mol I2 = 0,01 mol
Ditanyakan: Harga Kc.
Pembahasan :
Kc = 0,25
Jadi, harga Kc reaksi di atas ialah 0,25.
Anda kini sudah mengetahui Tetapan Kesetimbangan. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Premono, S. A. Wardani, dan N. Hidayati. 2009. Kimia : SMA/ MA Kelas XI. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 282.
Referensi Lainnya :
[1] Utami, B. A. Nugroho C. Saputro, L. Mahardiani, S. Yamtinah, dan B. Mulyani. 2009. Kimia 2 : Untuk SMA/MA Kelas XI, Program Ilmu Alam. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 274.
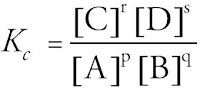
No comments:
Post a Comment