Kenaikan Titik Didih (∆Tb) dan Penurunan Titik Beku (∆Tf) Larutan, Contoh Soal, Praktikum, Kimia - Suatu zat cair dikatakan mendidih kalau tekanan uapnya sama dengan tekanan atmosfer (tekanan udara luar) di atas permukaan cairan. Adapun suatu zat dikatakan membeku kalau partikel-partikel zat itu berada dalam kisi-kisi kesetimbangan sehingga tidak terjadi gerakan partikel, selain getaran di tempatnya.
1. Kenaikan Titik Didih Larutan (ΔTd / ∆Tb)
Tahukah kau bagaimana terjadinya pendidihan? Pendidihan terjadi lantaran panas meningkatkan gerakan atau energi kinetik, dari molekul yang mengakibatkan cairan berada pada titik di mana cairan itu menguap, tidak peduli berada di permukaan teratas atau di cuilan terdalam cairan tersebut. [1]
Titik didih cairan bekerjasama dengan tekanan uap. Bagaimana hubungannya?
Coba perhatikan klarifikasi berikut ini.
Apabila sebuah larutan mempunyai tekanan uap yang tinggi pada suhu tertentu, maka molekul-molekul yang berada dalam larutan tersebut gampang untuk melepaskan diri dari permukaan larutan. Atau sanggup dikatakan pada suhu yang sama sebuah larutan mempunyai tekanan uap yang rendah, maka molekul-molekul dalam larutan tersebut tidak sanggup dengan gampang melepaskan diri dari larutan. Makara larutan dengan tekanan uap yang lebih tinggi pada suhu tertentu akan mempunyai titik didih yang lebih rendah. [1]
Cairan akan mendidih ketika tekanan uapnya menjadi sama dengan tekanan udara luar. Titik didih cairan pada tekanan udara 760 mmHg disebut titik didih standar atau titik didih normal. Makara yang dimaksud dengan titik didih yaitu suhu pada ketika tekanan uap jenuh cairan itu sama dengan tekanan udara luar (tekanan pada permukaan cairan).
Telah dijelaskan di depan bahwa tekanan uap larutan lebih rendah dari tekanan uap pelarutnya. Hal ini disebabkan lantaran zat terlarut itu mengurangi cuilan atau fraksi dari pelarut sehingga kecepatan penguapan berkurang. [1]
Hubungan antara tekanan uap jenuh dan suhu air dalam larutan basah ditunjukkan pada Gambar 1. berikut.
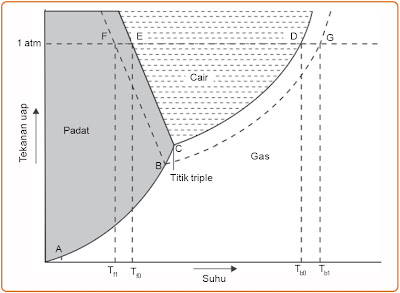 |
| Gambar 1. Diagram P – T air dan suatu larutan berair. (Sumber: Kimia untuk Universitas) |
Garis mendidih air digambarkan oleh garis CD, sedangkan garis mendidih larutan digambarkan oleh garis BG. Titik didih larutan dinyatakan dengan Tb1, dan titik didih pelarut dinyatakan dengan Tb0. Larutan mendidih pada tekanan 1 atm. Dari gambar di atas sanggup dilihat bahwa titik didih larutan (titik G) lebih tinggi daripada titik didih air (titik D). [1]
Oleh lantaran tekanan uap larutan zat non volatil lebih rendah dari pelarut murninya maka untuk mendidihkan larutan perlu energi lebih dibandingkan mendidihkan pelarut murninya. Akibatnya, titik didih larutan akan lebih tinggi daripada pelarut murninya.
Besarnya kenaikan titik didih larutan, ΔTd (relatif terhadap titik didih pelarut murni) berbanding lurus dengan kemolalan larutan. Dalam bentuk persamaan dinyatakan dengan: ΔTd / ∆Tb ≈ m, atau ;
ΔTd = Kd x m
Kd adalah tetapan kesetaraan titik didih molal. Harga Kd bergantung pada jenis pelarut (Tabel 1).
Tabel 1. Tetapan Kenaikan Titik Didih Molal (Kd) Beberapa Pelarut
Pelarut | Titik Didih (°C) | Kd (°C m–1) |
Air (H2O) Benzena (C6H6) Karbon tetraklorida (CCl4) Etanol (C2H6O) Kloroform (CHCl3) Karbon disulfida (CS2) | 100 80,1 76,8 78,4 61,2 46,2 | 0,52 2,53 5,02 1,22 3,63 2,34 |
Sumber: General Chemistry, 1990 | ||
Pada Tabel 1. tampak bahwa Kd air = 0,52 °C m–1. Artinya, suatu larutan dalam air dengan konsentrasi satu molal akan mendidih pada suhu lebih tinggi sebesar 0,52 °C dari titik didih air. Dengan kata lain, titik didih larutan sebesar 100,52 °C.
Contoh Soal Menghitung Titik Didih Larutan (1) :
Suatu larutan dibentuk dengan melarutkan 5 g gliserol (C3H8O3, Mr = 92) ke dalam 150 g air. Berapakah titik didih larutan, kalau titik didih air 100 °C? (Kd air = 0,52 °C m–1)
Jawaban :
molalitas larutan =  = 0,36 m
= 0,36 m
ΔTd = Kd x m = 0,52 °C m–1 x 0,36 m = 0,19 °C
Jadi, titik didih larutan yaitu 100,19 °C.
Data kenaikan titik didih larutan sanggup digunakan untuk memilih massa molekul relatif zat terlarut. Oleh lantaran kenaikan titik didih berbanding lurus dengan molalitas larutan maka massa molekul relatif zat terlarut sanggup ditentukan dengan mengubah persamaan molalitasnya.
ΔTd = Kd 
Mr zat terlarut = Kd x 
Contoh Soal Menghitung Mr Berdasarkan Data Td Larutan (2) :
Zat X sebanyak 7,4 g dilarutkan dalam 74 g benzena menghasilkan titik didih larutan sebesar 82,6 °C. Tentukan massa molekul relatif zat X. (Titik didih benzena 80,2 °C dan tetapan titik didih molal benzena 2,53 °C m–1)
Pembahasan :
Mr X = 2, 36 °C m–1 x 
Mr X = 105,42
Jadi, massa molekul relatif zat X yaitu 105,42.
Untuk menunjukan kenaikan titik didih larutan, Anda sanggup melaksanakan percobaan berikut.
Praktikum Kenaikan Titik Didih Larutan 1 : [1]
A. Tujuan
Mengamati titik didih larutan.
B. Alat dan Bahan
- Tabung reaksi
- Air suling
- Gelas kimia 400 mL
- Aquades
- Termometer (0 °C – 13 °C)
- Larutan urea 0,1 m dan 0,5 m
- Pemanas spiritus
- Larutan NaCl 0,1 m dan 0,5 m
- Kawat kasa
- Kaki tiga
C. Cara Kerja
1. Masukkan air suling ke dalam gelas kimia 400 mL dan panaskan dengan pemanas spiritus hingga mendidih.
2. Masukkan 10 mL aquades ke dalam tabung reaksi.
3. Masukkan tabung reaksi ke dalam air mendidih dalam gelas kimia di atas. Perhatikan gambar di bawah ini!
4. Amati dan catat perubahan suhu aquades dalam tabung reaksi setiap 15 detik hingga diperoleh suhu tetap.
5. Ulangi langkah 1 – 4 di atas untuk larutan urea 0,1 m dan 0,5 m, serta pada larutan NaCl 0,1 m dan 0,5 m.
6. Hitung selisih titik didih dari titik didih aquades dengan titik didih larutan.
D. Hasil Percobaan
No. | Larutan | Titik Didih (°C) | Selisih Titik Didih (°C) |
1. | Aquades | ||
2. | Urea 0,1 m | ||
3. | Urea 0,5 m | ||
4. | NaCl 0,1 m | ||
5. | NaCl 0,1 m |
E. Analisa Data
- Bagaimana imbas besarnya molalitas terhadap kenaikan titik didih untuk larutan yang sama?
- Bagaimana imbas jenis zat (elektrolit atau non elektrolit) terhadap titik didih larutan dengan molalitas yang sama?
- Apakah kesimpulan dari acara di atas?
Dari percobaan di atas sanggup diketahui bahwa titik didih suatu larutan sanggup lebih tinggi ataupun lebih rendah dari titik didih pelarut, bergantung pada fasilitas zat terlarut tersebut menguap.
Menurut aturan Raoult, besarnya kenaikan titik didih larutan sebanding dengan hasil kali dari molalitas larutan (m) dengan kenaikan titik didih molal (Kb).
Contoh Soal 3 : [1]
Natrium hidroksida 1,6 gram dilarutkan dalam 500 gram air. Hitung titik didih larutan tersebut! (Kb air = 0,52 °C m–1, Ar Na = 23, Ar O = 16, Ar H = 1)
Penyelesaian:
Diketahui :
m = 1,6 gram
p = 500 gram
Kb = 0,52 °C m–1
Ditanya : Tb ...?
Jawaban : ΔTb = m x Kb
ΔTb =  x Kb
x Kb
ΔTb =  x 0,52 °C m–1
x 0,52 °C m–1
ΔTb = 0,04 x 2 x 0,52 °C
ΔTb = 0,0416 °C
Tb = 100 °C + b ΔT
Tb = 100 °C + 0,0416 °C
Tb = 100,0416 °C
Jadi, titik didih larutan NaOH yaitu 100,0416 °C.
Zat anti didih yang ditambahkan ke dalam radiator berfungsi mengurangi penguapan air dalam radiator.
2. Penurunan Titik Beku Larutan (ΔTf)
Penambahan zat terlarut non volatil juga sanggup mengakibatkan penurunan titik beku larutan. Gejala ini terjadi lantaran zat terlarut tidak larut dalam fasa padat pelarutnya. Contohnya, kalau sirup dimasukkan ke dalam freezer maka gula pasirnya akan terpisah dari es lantaran gula pasir tidak larut dalam es.
Agar tidak terjadi pemisahan zat terlarut dan pelarutnya ketika larutan membeku, dibutuhkan suhu lebih rendah lagi untuk mengubah seluruh larutan menjadi fasa padatnya. Seperti halnya titik didih, penurunan titik beku (ΔTf) berbanding lurus dengan kemolalan larutan :
ΔTf ≈ m,
atau
ΔTf = Kf x m
Kf disebut tetapan penurunan titik beku molal. Harga Kf untuk beberapa pelarut sanggup dilihat pada Tabel 1.3.
Tabel 1. Tetapan Penurunan Titik Beku Molal (Kf) Beberapa Pelarut
Nilai Kf untuk benzena 5,12 °C m–1. Suatu larutan dari zat terlarut non volatil dalam pelarut benzena sebanyak 1 molal akan membeku pada suhu lebih rendah sebesar 5,12 °C dari titik beku benzena. Dengan kata lain, titik beku larutan zat non volatil dalam pelarut benzena sebanyak 1 molal akan mulai membeku pada suhu (5,5 – 5,12) °C atau 0,38 °C.
Penerapan dari penurunan titik beku digunakan di negara yang mempunyai demam isu dingin. Suhu udara pada demam isu hambar sanggup mencapai suhu di bawah titik beku air. Oleh lantaran itu, dalam air radiator kendaraan beroda empat dibutuhkan zat antibeku yang sanggup menurunkan titik beku air. Zat antibeku yang banyak digunakan dalam radiator yaitu etilen glikol (C2H6O2).
Selain pada radiator, penerapan dari penurunan titik beku juga digunakan untuk mencairkan es di jalan-jalan dan trotoar pada demam isu dingin. Hal ini dilakukan dengan cara menaburkan garam-garam, seperti CaCl2 dan NaCl sebagai penurun titik beku air sehingga es sanggup mencair.
Contoh Soal Menghitung Penurunan Titik Beku Larutan (4) :
Hitunglah titik beku larutan yang dibentuk dari 6,2 g etilen glikol dalam 100 g air.
Jawaban :
molalitas larutan =  = 1 m
= 1 m
Penurunan titik beku larutan :
ΔTf = Kf x m = (1,86 °C m–1) ( 1 m) = 1,86 °C
Titik beku larutan = Titik beku normal air – ΔTf = (0,0 – 1,86) °C = –1,86 °C
Jadi, titik beku larutan etilen glikol yaitu –1,86 °C
Sama ibarat kenaikan titik didih, penurunan titik beku larutan sanggup digunakan untuk memilih massa molekul relatif zat terlarut.
Mr zat terlarut = Kf 
Contoh Soal Menghitung Mr dari Data ΔTf (5) :
Suatu larutan dibentuk dengan cara melarutkan 3 g zat X ke dalam 100 mL air. Jika titik beku larutan – 0,45 °C, berapakah massa molekul relatif zat X?
Penyelesaian :
Nilai Kf air = 1,86 °C m–1.
ΔTf = {0 – (– 0,45)}°C = 0,45°C
Mr X = 1,86 °C m–1 x  = 124
= 124
Jadi, Mr zat X yaitu 124.
Percobaan / Praktikum Penurunan Titik Beku Larutan (2) : [1]
A. Tujuan
Mengamati penurunan titik beku larutan.
B. Alat dan Bahan
- Tabung reaksi
- Aquades
- Gelas kimia 400 mL
- Larutan glukosa 0,1 m dan 0,5 m
- Termometer (-10 °C – 50 °C)
- Garam dapur (NaCl)
- Spatula
- Es batu
C. Cara Kerja
1. Masukkan potongan-potongan kecil es kerikil ke dalam gelas kimia hingga 3/4 tinggi gelas kimia. Kemudian tambahkan 10 sendok teh garam dapur. Campur es kerikil dan garam dapur tersebut. Campuran ini kita sebut adonan pendingin.
2. Isilah tabung reaksi dengan aquades hingga setinggi 2 – 3 cm.
3. Masukkan tabung reaksi tersebut ke dalam adonan pendingin tadi. Ukur suhu aquades dengan termometer sambil sesekali diaduk hingga aquades tersebut membeku. Perhatikan gambar!
4. Setelah suhu tidak turun lagi, angkat tabung reaksi dari adonan pendingin.
5. Ukur kembali suhu aquades yang telah membeku setiap 15 detik hingga mencair lagi. Tulis hasil pengamatan dalam bentuk tabel.
6. Ulangi langkah 2 hingga 5 di atas untuk larutan glukosa 0,1 m dan 0,5 m serta pada larutan NaCl 0,1 m dan 0,5 m.
D. Hasil Percobaan
No. | Larutan | Titik Beku (°C) | Selisih Titik Beku (°C) |
1. | Aquades | ||
2. | Urea 0,1 m | ||
3. | Urea 0,5 m | ||
4. | NaCl 0,1 m | ||
5. | NaCl 0,1 m |
E. Analisa Data
- Bagaimana imbas besarnya molalitas terhadap penurunan titik beku untuk larutan yang sama?
- Bagaimana imbas jenis zat (elektrolit atau non elektrolit) terhadap titik didih larutan dengan molalitas yang sama?
- Apakah kesimpulan dari percobaan ini?
Dari percobaan di atas sanggup diketahui bahwa makin tinggi konsentrasi zat terlarut makin rendah titik beku larutan.
Anda kini sudah mengetahui Kenaikan Titik Didih (∆Tb) dan Penurunan Titik Beku (∆Tf). Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Sunarya, Y. dan A. Setiabudi. 2009. Praktis dan Aktif Belajar Kimia 3 : Untuk Kelas XII Sekolah Menengah Atas / Madrasah Aliyah. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 298.
Referensi Lainnya :
[1] Sukmanawati, W. 2009. Kimia 3 : Untuk SMA/ MA Kelas XII. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 266.


No comments:
Post a Comment