Kesetimbangan Kimia, Dinamis, Tetapan, Contoh Soal, Aplikasi, Penerapan, Faktor, Pengaruh, Hubungan Kualitatif Pereaksi dan Hasil Reaksi, Industri - Selama ini, reaksi-reaksi kimia yang Anda pelajari ialah reaksi satu arah. Artinya, semua pereaksi dinyatakan habis bereaksi dan tidak pernah kembali. Sesungguhnya, banyak reaksi kimia yang terjadi tidak satu arah, melainkan membentuk keadaan setimbang. Dalam hal ini, pereaksi tidak habis bereaksi dan hasil-hasil reaksi sanggup kembali lagi membentuk pereaksi. Hal ini berlangsung hingga terbentuk keadaan kesetimbangan antara pereaksi dan hasil reaksi.
Apakah reaksi kesetimbangan itu? Faktor-faktor apa sajakah yang menghipnotis pergeseran arah kesetimbangan? Bagaimanakah memilih kekerabatan kuantitatif antara pereaksi dan hasil reaksi dari suatu reaksi kesetimbangan? Anda sanggup menjawab pertanyaan-pertanyaan tersebut jikalau Anda pelajari pecahan ini dengan baik.
A. Kesetimbangan Dinamis dan Tetapan Kesetimbangan
Ilmuwan pertama yang mengajukan gagasan kesetimbangan dalam ilmu Kimia ialah Berthollt, ketika menjadi penasihat Napoleon di Mesir (reaksi kesetimbangan sanggup diselidiki dalam dua arah). Temuan secara laboratorium dilakukan oleh Guldberg dan Waage, sedangkan rumusan secara matematika diajukan oleh Van't Hoff (konsentrasi pereaksi dalam reaksi kesetimbangan sebanding dengan pangkat dari koefisien reaksinya).
1.1. Pengertian Kesetimbangan Dinamis
Ada beberapa istilah yang harus Anda pahami sebelum melangkah lebih jauh mempelajari kesetimbangan kimia. Istilah tersebut ialah reaksi satu arah (one way reaction), reaksi sanggup balik (two way reaction), dan reaksi kesetimbangan (equilibrium reaction). Jika dalam suatu reaksi, zat-zat hasil reaksi tidak sanggup bereaksi kembali menjadi pereaksi maka disebut reaksi satu arah.
Contoh reaksi satu arah :
Pembakaran metana berlangsung dalam satu arah. Persamaan reaksinya:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
Jika hasil reaksi (CO2 + H2O) direaksikan lagi, tidak akan membentuk pereaksi kembali (CH4 + O2, tetapi menjadi H2CO3. Kenyataan ini memperlihatkan bahwa reaksi di atas ialah reaksi satu arah atau reaksi yang tidak sanggup balik (irreversible).
Jika dalam suatu reaksi hasil-hasil reaksi sanggup membentuk pereaksi lagi maka disebut reaksi sanggup balik (reversible) atau reaksi bolak-balik.
Contoh reaksi bolak balik :
Jika gas N2 dan gas H2 direaksikan dalam reaktor tertutup akan terbentuk gas NH3. Persamaannya:
N2(g) + 3H2(g) → 2NH3(g)
Gas NH3 yang terbentuk sanggup diuraikan kembali membentuk pereaksi.
Persamaannya :
2NH3(g) → N2(g) + 3H2(g)
Reaksi semacam ini memperlihatkan bahwa reaksi sanggup balik (reversible) atau reaksi dua arah.
Suatu reaksi sanggup digolongkan ke dalam reaksi kesetimbangan dinamis (equilibrium reaction) jikalau reaksi yang sanggup balik (reversible) berlangsung dengan kecepatan yang sama, baik kecepatan ke arah hasil reaksi maupun kecepatan ke arah pereaksi dan reaksinya tidak bergantung pada waktu (contoh analogi Gambar 1).
 |
| Gambar 1. Reaksi kesetimbangan menyerupai jalan dua arah yang dilalui kendaraan beroda empat dengan kecepatan yang sama. |
Dalam sistem kesetimbangan dinamis, reaksi yang menuju hasil reaksi dan reaksi yang menuju pereaksi berlangsung secara bersamaan dengan laju yang sama sehingga konsentrasi masing-masing zat dalam sistem kesetimbangan tidak berubah.
Jika Anda sanggup melihat sistem kesetimbangan dinamis secara molekuler, akan tampak partikel-partikel dalam sistem kesetimbangan tidak tetap sebagai pereaksi atau hasil reaksi, melainkan bereaksi terus dalam dua arah secara dinamis. Pereaksi akan bermetamorfosis hasil reaksi diimbangi oleh hasil reaksi bermetamorfosis pereaksi. Jadi, kesetimbangan kimia dikatakan dinamis lantaran secara molekuler (mikroskopik) zat-zat tersebut berubah setiap saat, tetapi secara keseluruhan (makroskopik) tidak ada perubahan sifat fisik, baik wujud maupun konsentrasi masing-masing zat.
Keadaan kesetimbangan dinamis sanggup dianalogikan sebagai seseorang yang berjalan di eskalator, tetapi arahnya berlawanan dengan arah eskalator. Eskalator bergerak ke bawah dan orang tersebut bergerak ke atas dengan kecepatan yang sama. Akibatnya, orang tersebut menyerupai berjalan di tempat. Secara makrokospik, kedudukan orang tersebut tidak berubah lantaran tidak bergeser dari posisinya, tetapi secara mikroskopik terjadi perubahan terus menerus, menyerupai ditunjukkan oleh gerakan eskalator yang diimbangi oleh gerakan orang tersebut dengan kecepatan yang sama (perhatikan Gambar 2).
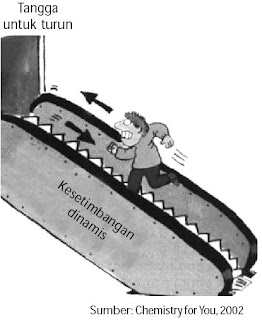 |
| Gambar 2. Seseorang yang naik eskalator dengan arah berlawanan akan terlihat menyerupai berjalan di tempat. |
Persamaan kimia untuk reaksi kesetimbangan dinyatakan dengan dua arah anak panah, contohnya pada reaksi pembentukan amonia, persamaan kimianya ditulis sebagai berikut.
N2(g) + 3H2(g) ↔ 2NH3(g) atau 2NH3(g) ↔ N2(g) + 3H2(g)
Tinjau reaksi pembentukan sulfur trioksida berikut.
2SO2(g) + O2(g) ↔ 2SO3(g)
Jika konsentrasi masing-masing zat dalam sistem kesetimbangan itu diukur. Kemudian hasilnya dituangkan ke dalam bentuk grafik kekerabatan antara konsentrasi zat dan waktu reaksi maka kurva yang terbentuk menyerupai pada Gambar 3.
Bagaimanakah cara memahami makna kurva pada Gambar 3?
 |
| Gambar 3. Sistem reaksi kesetimbangan : 2SO2(g) + O2(g) ↔ 2SO3(g). |
Simak dengan seksama. Pada t = 0 detik, hanya terdapat pereaksi (SO2 dan O2) dengan konsentrasi awal tertentu. Dengan mengendalikan suhu dan tekanan, pereaksi mulai bermetamorfosis hasil reaksi (SO3). Pada saat SO3 mulai terbentuk, sebagian SO3 terurai kembali menjadi pereaksi. Akan tetapi, lantaran jumlah molekul pereaksi lebih banyak, laju penguraian SO3 relatif lebih lambat dibandingkan laju pembentukan SO3 sehingga pembentukan SO3 masih dominan. Reaksi dalam dua arah berlangsung terus hingga mendekati waktu t1, laju ke dua arah ini hampir sama. Setelah mencapai waktu t1, laju pembentukan dan laju penguraian SO3 sama sehingga konsentrasi pereaksi dan hasil reaksi tidak berubah lagi terhadap waktu. Hal ini ditunjukkan oleh bentuk kurva yang mendatar.
Semua reaksi kesetimbangan sanggup dinyatakan dalam bentuk grafik dengan bentuk yang berbeda bergantung pada sifat reaksinya, menyerupai ditunjukkan pada Gambar 4.
Pada Gambar 4.(a), proses untuk mencapai kesetimbangan sama dengan proses pada pembentukan SO3 (g), tetapi konsentrasi pada final reaksi berbeda. Dalam hal ini, sesudah keadaan kesetimbangan tercapai, konsentrasi pereaksi sama dengan konsentrasi produk, atau [A] = [B].
1.2. Hukum Kesetimbangan Kimia
Dalam reaksi kesetimbangan spesi kiri dan kanan sanggup bertindak sebagai pereaksi sekaligus hasil reaksi. Oleh lantaran itu, dibentuk akad ketika dinyatakan pereaksi maksudnya spesi kiri sedangkan hasil reaksi maksudnya spesi kanan.
A + B ↔ C + D
Pereaksi Hasil reaksi
Dalam reaksi satu arah, konsentrasi molar hasil reaksi ditentukan oleh konsentrasi molar pereaksi dan mengikuti kaidah stoikiometri (koefisien reaksinya). Contohnya 2A → B, jumlah mol B bergantung pada jumlah mol A dan perbandingan koefisien reaksinya. Dalam sistem reaksi kesetimbangan tidak demikian, mengapa? Andaikan sistem reaksi: N2 + O2 ↔ 2NO membentuk kesetimbangan.
Ketika kesetimbangan tercapai, konsentrasi NO tidak bergantung pada konsentrasi awal N2 dan O2, tetapi mengikuti aturan kesetimbangan kimia atau aturan agresi massa.
Jika ke dalam suatu reaktor tertutup dicampurkan gas N2, O2, dan NO (reaksinya sanggup balik) maka Anda tidak sanggup memilih mana yang bertindak sebagai pereaksi maupun hasil reaksi. Arah reaksi pun tidak sanggup ditentukan secara niscaya lantaran reaksi sanggup balik (reversible), sanggup berlangsung dalam dua arah. Untuk mengetahui arah reaksi dalam reaksi sanggup balik (re ersible) maka didefinisikan perbandingan reaksi (quotient of reaction), dilambangkan dengan Q, yaitu perbandingan konsentrasi zat-zat yang bereaksi.
Andaikan persamaan reaksi untuk gabungan gas N2, O2, dan NO Anda tuliskan sebagai N2(g) + O2(g) ↔ 2NO(g) maka perbandingan reaksinya ialah :
Pada ketika reaksi mencapai kesetimbangan, harga Q tidak lagi bergantung pada konsentrasi awal, tetapi hanya bergantung pada suhu sistem reaksi.
Agar lebih memahami dan meningkatkan keyakinan Anda, simak Tabel 1. berikut yang menyajikan data hasil pengukuran konsentrasi molar dan harga Q sesudah kesetimbangan tercapai (QKstb) pada suhu T.
Tabel 1. Data Hasil Pengukuran Konsentrasi dan QKstb pada Suhu T untuk Reaksi N2(g) + O2(g) ↔ 2NO(g).
Percobaan | Konsentrasi Awal (M) | |||
N2 | O2 | NO | QKstb | |
1 | 0,127 | 0,134 | 0,966 | 55,68 |
2 | 0,027 | 0,027 | 0,202 | 55,21 |
3 | 0,164 | 0,098 | 0,945 | 55,46 |
4 | 0,064 | 0,065 | 0,482 | 55,16 |
5 | 0,103 | 0,179 | 0,013 | 55,31 |
Apakah yang sanggup Anda simpulkan dari data pada Tabel 1? Konsentrasi awal masing-masing zat untuk kelima percobaan tidak sama, tetapi sesudah kesetimbangan tercapai kelima percobaan mempunyai nilai Q yang relatif sama. Besaran Q mempunyai makna penting lantaran memperlihatkan nilai yang tidak bergantung pada konsentrasi awal pereaksi. Pada ketika harga Q tetap, dinamakan tetapan kesetimbangan (dilambangkan dengan Kc).
Kc = QKstb
Tetapan kesetimbangan untuk referensi reaksi N2(g) + O2(g) ↔ 2NO(g) sanggup ditulis:

Berdasarkan uraian tersebut maka sanggup dikatakan sebagai berikut.
- Jika nilai Q lebih besar daripada nilai Kc, reaksi sedang berlangsung ke arah kiri persamaan reaksi.
- Jika nilai Q lebih kecil daripada nilai Kc, reaksi sedang menuju ke arah kanan.
- Jika nilai Q sama dengan nilai Kc, reaksi dikatakan telah mencapai keadaan setimbang.
Secara umum, tetapan kesetimbangan untuk reaksi hipotetik:
aA + bB ↔ cC + dD, sanggup dinyatakan dengan :
Hubungan antara K dan Q dari ke-3 poin di atas sanggup dianalogikan menyerupai Gambar 5.
 |
| Gambar 5. Hubungan perbandingan K dan Q dengan arah reaksi. |
Nilai Kc selalu tetap walaupun konsentrasi awal zat-zat dalam sistem kesetimbangan diubah-ubah. Nilai Kc akan berubah jikalau suhu sistem reaksi berubah. Oleh lantaran itu, nilai Kc hanya dipengaruhi oleh suhu sistem reaksi.
Contoh Soal Menentukan Tetapan Kesetimbangan :
Tuliskan tetapan kesetimbangan reaksi berikut dalam bentuk konsentrasi molar:
PCl3(g) + Cl2(g) ↔ PCl5(g)
Jika Q > Kc, ke arah mana reaksi sedang berjalan?
Pembahasan :
Dalam tetapan kesetimbangan:
- Pereaksi dituliskan sebagai penyebut.
- Hasil reaksi dituliskan sebagai pembilang.
- Setiap zat dipangkatkan koefisien reaksinya.
Persamaan tetapan kesetimbangan untuk reaksi:

Jika Q > Kc, artinya [PCl5] lebih banyak dari [PCl3][Cl2]. Oleh lantaran itu, reaksi sedang berlangsung ke arah penguraian PCl5 (ke arah kiri).
1.3. Kesetimbangan Sistem Homogen dan Heterogen
Apakah yang dimaksud dengan reaksi kesetimbangan homogen dan heterogen? Istilah ini merujuk kepada fasa zat-zat yang terlibat dalam sistem reaksi kesetimbangan.
Suatu reaksi kesetimbangan dikatakan homogen jikalau pereaksi dan hasil reaksi mempunyai fasa yang sama, sedangkan reaksi dikatakan heterogen jikalau salah satu zat atau lebih berbeda fasa.
Contoh reaksi kesetimbangan homogen, yaitu:
a. N2(g) + 2O2(g) ↔ 2NO2(g)
b. H2CO3(aq) ↔ HCO3–(aq) + H3O+(aq) Contoh reaksi kesetimbangan heterogen, yaitu:
a. AgCl(s) ↔ Ag+(aq) + Cl–(aq)
b. H2O2(aq) ↔ H2O(l)+ ½ O2(g)
c. CaCO3(s) ↔ CaO(s) + CO2(g) Apakah tetapan kesetimbangan sistem heterogen sama dengan uraian sebelumnya? Berdasarkan penelitian, memperlihatkan bahwa tetapan kesetimbangan reaksi heterogen mempunyai aksara tertentu. Tinjau reaksi kesetimbangan heterogen pada penguraian termal CaCO3 berikut.
CaCO3(s) ↔ CaO(s) + CO2(g)
Bagaimanakah bentuk persamaan tetapan kesetimbangan untuk sistem reaksi heterogen ini? Andaikan tetapan kesetimbangan untuk penguraian termal CaCO3 dituliskan sama menyerupai untuk reaksi homogen:

Konsentrasi zat dalam sistem kesetimbangan ialah mol per liter.
Untuk zat murni, baik padatan maupun zat cair, konsentrasi molar zat tidak berubah walaupun jumlahnya berkurang akhir bereaksi. Mengapa tidak berubah? Untuk zat murni, contohnya air, jikalau massa air dikurangi maka volume air juga berkurang (perhatikan Gambar 7). Akibatnya, konsentrasi molar air tidak berubah. Dengan kata lain, massa jenis zat murni selalu tetap. Berbeda dengan zat murni, untuk larutan, jikalau jumlah zat terlarut atau volume pelarut berkurang maka konsentrasi molarnya berubah. Sedangkan zat berupa gas kemolarannya bergantung pada volume wadahnya sepeti ditunjukkan pada Gambar 6.
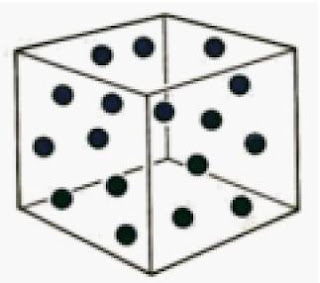 |
| Gambar 6. Kemolaran gas bergantung pada volume wadahnya (kemolaran gas = mol gas per volume wadahnya) |
Oleh lantaran massa jenis zat murni tetap, selama reaksi berlangsung massa CaCO3 dan CaO per satuan volume zat padatnya selalu tetap. Hal ini menyebabkan konsentrasi kedua zat murni ini tidak memengaruhi nilai tetapan kesetimbangan. Oleh lantaran itu, konsentrasi CaCO3 dan CaO sanggup dipindahkan ke ruas kiri persamaan dan digabungkan dengan tetapan kesetimbangan (Kc). Persamaan kesetimbangannya menjadi:
 Kc = [CO2]
Kc = [CO2]
Dengan demikian, sanggup disimpulkan bahwa untuk reaksi kesetimbangan yang heterogen, persamaan tetapan kesetimbangan tidak melibatkan konsentrasi zat murninya.
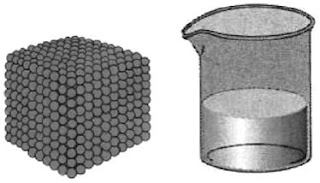 |
| Gambar 7. Volume untuk memilih kemolaran zat murni ialah volume zatnya sendiri, bukan volume wadah (kemolaran zat murni = mol zat/ volume zat) |
B. Faktor-Faktor yang Mempengaruhi Kesetimbangan Kimia
Jika ke dalam sistem reaksi yang berada dalam keadaan kesetimbangan diberi gangguan, contohnya konsentrasi atau suhunya diubah, apa yang terjadi? Sudah menjadi fenomena alam, setiap ada agresi tentu ada reaksi dan reaksinya beragam. Menurut Le Chatelier, jikalau sistem yang berada dalam keadaan kesetimbangan diganggu, sistem akan berusaha mengurangi gangguan dengan cara menggeser posisi kesetimbangan, baik ke arah pereaksi maupun hasil reaksi sehingga gangguan tersebut minimum dan tercapai keadaan kesetimbangan yang baru.
2.1. Gangguan Konsentrasi
Jika pada sistem kesetimbangan dilakukan penambahan atau pengurangan salah satu pereaksi atau hasil reaksi, sistem akan mengadakan reaksi untuk mengurangi gangguan tersebut. Untuk lebih memahami imbas konsentrasi, lakukan penyelidikan berikut.
Praktikum Kimia Pengaruh Perubahan Konsentrasi terhadap Sistem Kesetimbangan 1 :
Tujuan :
Mengetahui imbas perubahan konsentrasi terhadap sistem kesetimbangan
SCN–(aq) + Fe 3+ (aq) ↔ Fe(SCN)2+(aq).
Alat :
- Gelas kimia
- Tabung reaksi
- Pipet tetes
- Gelas ukur
Bahan :
- Larutan NaH2PO4 0,01 M
- Larutan Fe (NO3) 0,01 M
- Larutan KSCN 0,01 M
Langkah Kerja :
- Campurkan 25 mL KSCN 0,01 M dan 2 tetes Fe (NO3)3 0,01 M ke dalam gelas kimia.
- Tuangkan larutan tersebut ke dalam 4 buah tabung reaksi.
- Tabung 1 disimpan sebagai pembanding.
- Tabung 2 ditambahkan setetes KSCN 0,01 M.
- Tabung 3 ditambahkan setetes Fe(NO3)3 0,01 M.
- Tabung 4 ditambahkan setetes NaH2PO4 0,01 M.
- Amati dan catat semua perubahan warna yang terjadi.
Kondisi | Pengamatan |
KSCN (awal) | Bening |
Fe(NO3)3 (awal) | Kuning pucat |
Tabung 1 | ...... |
Tabung 2 | ...... |
Tabung 3 | ...... |
Tabung 4 | ...... |
Pertanyaan :
- Gangguan apakah yang diberikan pada tabung 2, 3, dan 4? Jelaskan.
- Apakah yang sanggup Anda simpulkan dari acara ini? Diskusikan secara berkelompok.
Persamaan reaksi pada Praktikum Kimia 1 cukup rumit, tetapi sanggup disederhanakan menjadi:
KSCN (aq) + Fe(NO3)3(aq) ↔ Fe(SCN)2+(aq) + 2NO3(aq) + KNO3(aq)
Oleh lantaran tidak semua spesi kimia dalam reaksi tersebut mengalami perubahan, Anda sanggup menuliskan spesi kimia yang berubah saja, yaitu:
SCN–(aq) + Fe3+(aq) ↔ Fe(SCN)2+(aq)
Reaksi kesetimbangan tersebut sanggup dipelajari berdasarkan perubahan warna yang terjadi. KSCN(aq) tidak berwarna, Fe(NO3)3(aq) berwarna kuning pucat, sesudah bereaksi larutan menjadi berwarna merah. Warna merah ini berasal dari Fe(SCN)2+(aq) yang terbentuk. Jika ke dalam sistem reaksi, konsentrasi pereaksi dinaikkan (penyelidikan pada tabung 2 dan 3) atau konsentrasi pereaksi dikurangi (penyelidikan pada tabung 4) apa yang akan terjadi? Berdasarkan pengamatan, memperlihatkan bahwa pada tabung 2 dan 3 warna larutan bermetamorfosis merah tua. Warna merah berasal dari FeSCN2+, ini memperlihatkan posisi kesetimbangan telah bergeser ke arah pembentukan hasil reaksi.
Berdasarkan hasil penyelidikan pada tabung 4, warna larutan bermetamorfosis tidak berwarna. Hal ini memperlihatkan bahwa posisi kesetimbangan telah bergeser ke arah pereaksi (pembentukan kembali ion SCN–, tidak berwarna).
Jika pada akhirnya kesetimbangan terbentuk kembali, bagaimana komposisi konsentrasi masing-masing pereaksi sesudah gangguan dikurangi oleh sistem kesetimbangan? Untuk memahami ini, simak penyelidikan pada tabung 2. Penambahan SCN– akan menggeser posisi kesetimbangan ke arah hasil reaksi. Akibatnya, konsentrasi Fe(SCN)2+ lebih besar dari sebelumnya, konsentrasi Fe3+ lebih sedikit, dan konsentrasi SCN– lebih besar lantaran tidak semua SCN– yang ditambahkan bereaksi dengan Fe3+ . Komposisi konsentrasi pereaksi dan produk sanggup dilihat pada Gambar 8.
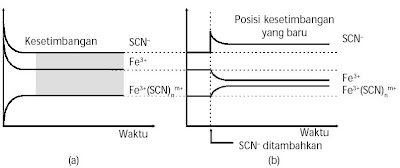 |
| Gambar 8. (a) Keadaan kesetimbangan sebelum penambahanSCN–. (b) Keadaan kesetimbangan baru, sesudah penambahan SCN–. |
Contoh Soal Pengubahan Konsentrasi Kesetimbangan :
Perkirakan arah pergeseran kesetimbangan berikut:
N2(g) + 3H2(g) ↔ 2NH3(g)
Jika terhadap sistem kesetimbangan ditambah NH3?
Bagaimana komposisi konsentrasi masing-masing zat sesudah tercapai kesetimbangan yang baru?
Bagaimana komposisi konsentrasi masing-masing zat sesudah tercapai kesetimbangan yang baru?
Jawaban :
Penambahan NH3 akan menggeser posisi kesetimbangan ke arah penguraian NH3 menjadi N2 dan H2.
Setelah tercapai kesetimbangan yang baru, konsentrasi NH3 bertambah sedikit, konsentrasi N2 dan H2bertambah besar.
Contoh Soal SPMB 2003 :
Reaksi pembuatan sulfur trioksida ialah reaksi eksoterm
2SO2(g) + O2(g) ↔ 2SO3(g)
Produksi sulfur trioksida sanggup meningkat dengan cara ....
A. menahan tekanan
B. menambah katalis
C. menurunkan suhu
D. memperbesar volume
Pembahasan :
Agar reaksi kesetimbangan bergeser ke arah SO3 (ke kanan) maka:
• tekanan diperbesar
• volume diperkecil
• suhu diturunkan
Jadi, jawabannya (C)
2.2. Gangguan terhadap Suhu Sistem Kesetimbangan
Jika sistem kesetimbangan diubah suhunya maka sistem akan bereaksi dengan cara yang berbeda dengan gangguan konsentrasi. Reaksi terhadap gangguan suhu sangat bergantung pada sifat-sifat termokimia dari spesi yang terdapat dalam sistem kesetimbangan.
Seperti telah dibahas pada Bab Termokimia, ada reaksi eksoterm dan reaksi endoterm. Reaksi eksoterm sanggup bermetamorfosis reaksi endoterm jikalau reaksinya dibalikkan, sedangkan nilai ΔH reaksi tetap hanya tandanya saja yang berubah.
Jika sifat-sifat termokimia diterapkan ke dalam sistem reaksi yang membentuk kesetimbangan maka untuk reaksi ke arah hasil reaksi yang bersifat eksoterm, reaksi ke arah sebaliknya bersifat endoterm dengan harga ΔH sama, tetapi berbeda tanda.
Praktikum Kimia Pengaruh Perubahan Suhu terhadap Sistem Kesetimbangan 2 :
Tujuan :
Mengetahui imbas perubahan suhu terhadap sistem kesetimbangan
CuSO4.5H2O(s) ↔ CuSO4(s) + 5H2O(g).
Alat :
- Cawan penguap
- Bunsen, kaki tiga, kawat kasa
- Gabus
- Timbangan
- Padatan CuSO4.5H2O
- Air (H2O)
Langkah Kerja :
- Panaskan 10 g CuSO4.5H2O dalam cawan penguap. Amati perubahan warna yang terjadi.
- Biarkan padatan mendingin. Setelah dingin, tetesi dengan air. Amati perubahan yang terjadi.
- Tuliskan pengamatan Anda dalam bentuk tabel.
Aktivitas | Pengamatan |
Sebelum dipanaskan | |
Sesudah dipanaskan | |
Ditambah air |
Pertanyaan :
- Bagaimanakah warna tembaga(II) sulfat sebelum dipanaskan, sesudah dipanaskan, dan sesudah ditambah air?
- Termasuk ke dalam reaksi jenis apa pemanasan CuSO4.5H2O.
- Apakah yang sanggup Anda simpulkan dari percobaan ini?
Pemanasan CuSO4.5H2O bertujuan untuk melepaskan hidrat yang terikat pada tembaga(II) sulfat pentahidrat. Persamaan termokimianya sebagai berikut.
CuSO4.5H2O(s) | ↔ | CuSO4(s) | + | 5H2O(g) | ΔH = +1508 kJ mol–1 |
Biru | Putih |
Oleh lantaran reaksinya berkesetimbangan maka pada ketika didinginkan (ditambah air), serbuk CuSO4 mengikat kembali molekul air. Persamaan termokimianya sebagai berikut.
CuSO4(s) | + | 5H2O(g) | ↔ | CuSO4.5H2O(s) | ΔH = –1508 kJ mol–1 |
Putih | Biru |
Mengapa perubahan suhu sanggup memengaruhi sistem reaksi kesetimbangan? Ke arah manakah posisi kesetimbangan akan bergeser jikalau suhu reaksi dinaikkan atau diturunkan?
Menurut Le Chatelier, jikalau reaksi kesetimbangan diubah suhunya maka sistem akan melaksanakan tindakan dengan cara meminimalkan imbas suhu tersebut. Pada Praktikum Kimia 2, jikalau suhu dinaikkan, posisi kesetimbangan bergeser ke arah pelepasan hidrat (endoterm). Sebaliknya, jikalau suhu diturunkan, posisi kesetimbangan bergeser ke arah pembentukan hidrat (eksoterm).
Contoh Soal Pengaruh Perubahan Suhu :
Pembuatan amonia bersifat eksoterm. Persamaan termokimianya:
N2(g) + 3H2(g) ↔ 2NH3(g) ΔHo = –366,1 kJ
Tentukan pergeseran posisi kesetimbangan jikalau suhu sistem dinaikkan.
Jawaban :
Jika suhu dinaikkan, posisi kesetimbangan akan bergeser ke arah reaksi endoterm. Oleh lantaran pembentukan amonia eksoterm, posisi kesetimbangan akan bergeser ke arah sebaliknya, yaitu penguraian amonia menjadi N2(g) dan H2(g).
Contoh Soal UNAS 2003
Perhatikan reaksi kesetimbangan berikut.
2NO(g) + O2(g) ↔ 2NO2(g) ΔH = 150 kJ
Apabila pada volume tetap suhu dinaikkan maka kesetimbangan bergeser ke arah ....
A. kanan dan harga K tetap
B. kiri dan harga K makin kecil
C. kanan dan harga K makin besar
D. kiri dan harga K makin besar
Penyelesaian :
2NO(g) + O2(g) ↔ 2NO2(g) ΔH = 150 kJ
Reaksi tersebut ialah reaksi endoterm. Apabila pada volume tetap suhu dinaikkan, reaksi akan bergeser ke arah kanan. Perubahan suhu menyebabkan harga K semakin besar lantaran reaksi tersebut bergeser ke kanan maka harga K bertambah. Jadi, jawabannya (B)
2.3. Gangguan terhadap Tekanan / Volume
Untuk sistem kesetimbangan yang melibatkan fasa padat atau cair, gangguan tekanan atau volume tidak berpengaruh, tetapi untuk sistem yang melibatkan fasa gas, gangguan tekanan terhadap sistem kesetimbangan sangat berpengaruh.
Perhatikan sistem reaksi kesetimbangan berikut.
2NO2(g) ↔ N2O4(g)
Jika tekanan sistem dinaikkan dengan cara memperkecil volume wadah, sistem akan bereaksi sedemikian rupa sehingga imbas volume sekecil mungkin. Bagaimanakah sistem akan bertindak? Tekanan diperbesar atau volume wadah diperkecil, memacu sistem untuk memperkecil imbas tekanan dengan cara mengurangi jumlah molekul. Frekuensi dan jumlah molekul yang bertumbukan dengan dinding wadah makin sedikit sehingga kenaikan tekanan menjadi minimum. Dengan demikian, posisi kesetimbangan akan bergeser ke arah yang jumlah molekulnya paling sedikit.
Pada reaksi pembentukan N2O4, ke arah mana posisi kesetimbangan akan bergeser? Ingat, perbandingan koefisien reaksi menyatakan perbandingan jumlah molekul. Oleh lantaran itu, kesetimbangan akan bergeser ke arah pembentukan N2O4 sebab jumlah molekulnya setengah dari jumlah molekul NO2.
Contoh Soal Pengaruh Tekanan / Volume :
Perhatikan reaksi kesetimbangan berikut:
N2(g) + 3H2(g) ↔ 2NH3(g)
Jika tekanan dalam sistem kesetimbangan diturunkan, bagaimanakah pergeseran kesetimbangannya?
Jawaban :
Penurunan tekanan akan menggeser posisi kesetimbangan ke arah yang jumlah molekulnya lebih banyak. Dalam sistem ini, posisi kesetimbangan akan bergeser ke arah pereaksi (N2 + H2).
Berdasarkan uraian tersebut, jikalau tekanan sistem meningkat, posisi kesetimbangan akan bergeser ke arah jumlah molekul yang lebih sedikit menyerupai ditunjukkan pada Gambar 9.
Bagaimana jikalau jumlah molekul pereaksi sebanding dengan jumlah molekul hasil reaksi? Misalnya pada reaksi berikut.
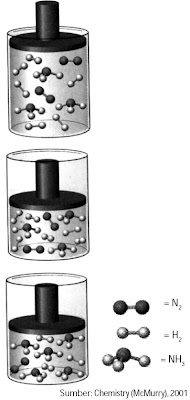 |
| Gambar 9. Ketika tekanan diperbesar atau volume diperkecil, sistem kesetimbangan akan bergeser ke arah yang jumlah molekulnya sedikit. |
H2(g) + I2(g) ↔ 2HI(g)
Jika jumlah molekul pereaksi sebanding dengan hasil reaksi atau jumlah koefisien pereaksi sama dengan hasil reaksi maka perubahan tekanan atau volume sistem tidak akan kuat terhadap sistem kesetimbangan.
Bagaimana jikalau ke dalam sistem reaksi yang berada dalam kesetimbangan ditambahkan gas lembam (inert) menyerupai gas mulia (He, Ne, Ar)? Apakah sistem kesetimbangan terganggu? Jika gas inert menyerupai He, Ne, atau Ar dimasukkan ke dalam sistem reaksi yang berada dalam kesetimbangan, tekanan total sistem meningkat lantaran jumlah molekul bertambah. Tekanan total sistem merupakan jumlah aljabar dari tekanan parsial masing-masing komponen. Menurut Dalton:
Ptotal = P1 + P2 + P3 + ….. + Pi.
Ptotal adalah tekanan total sistem.
P1, P2, ..., Pi ialah tekanan parsial masing-masing komponen gas.
Jika tekanan parsial dari komponen sistem berubah, komposisi gas akan berubah. Akibatnya, sistem kesetimbangan juga turut berubah. Hal ini lantaran tetapan kesetimbangan ditentukan oleh nilai tekanan parsial masing-masing komponen gas.
Gas inert tidak bereaksi dengan komponen gas yang terdapat dalam sistem kesetimbangan sehingga komposisi dari masing-masing komponen sistem kesetimbangan tidak berubah. Akibatnya, penambahan gas inert tidak memengaruhi keadaan kesetimbangan. Penambahan gas inert ke dalam sistem kesetimbangan hanya menambah satu komponen tekanan parsial, sedangkan komponen parsial gas dalam sistem kesetimbangan tidak berubah.
C. Hubungan Kuantitatif Pereaksi dan Hasil Reaksi
Pada awal bab, telah dijelaskan makna tetapan kesetimbangan secara kualitatif, yaitu perbandingan konsentrasi zat-zat yang terlibat dalam sistem reaksi kesetimbangan dipangkatkan dengan koefisien reaksinya. Pada sub pecahan ini, Anda akan memilih secara kuantitatif kekerabatan antara konsentrasi pereaksi dan hasil reaksi dalam sistem reaksi kesetimbangan.
3.1. Penentuan Tetapan Kesetimbangan, Kc
Masih ingatkah Anda cara memilih tetapan kesetimbangan untuk sistem reaksi yang homogen dan heterogen? Perhatikan reaksi kesetimbangan berikut.
N2(g) + 3H2(g) ↔ 2NH3(g)
Dapatkah Anda menuliskan persamaan tetapan kesetimbangan untuk reaksi tersebut? Berapakah nilai tetapan kesetimbangan untuk reaksi tersebut? Untuk sanggup menjawab pertanyaan ini, Anda harus mengetahui konsentrasi molar masing-masing zat yang ada dalam keadaan setimbang. Konsentrasi molar zat-zat dalam sistem kesetimbangan hanya sanggup diketahui dari hasil penyelidikan. Oleh lantaran itu, nilai tetapan kesetimbangan hanya sanggup diketahui sesudah Anda melaksanakan penyelidikan ilmiah.
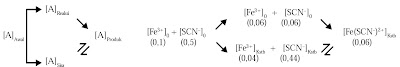
Masih ingatkah Anda dengan penyelidikan gangguan konsentrasi terhadap reaksi kesetimbangan? Anda mereaksikan larutan Fe(NO3)3 dan larutan KSCN, sanggup ditulis dalam bentuk persamaan ionnya:
Fe3+(aq) + SCN–(aq) ↔ Fe(SCN)2+(aq)
Andaikan Anda mereaksikan Fe3+(aq) 0,1 M dan SCN–(aq) 0,5 M pada suhu tertentu. Setelah reaksi mencapai keadaan setimbang, diketahui bahwa konsentrasi Fe3+(aq) dalam sistem menjadi 0,04 M. Apakah makna yang terkandung dalam hasil penyelidikan ini? Untuk memahami makna yang terkandung dalam penyelidikan Anda, simak diagram kesetimbangan pada Gambar 10.
Konsentrasi awal masing-masing pereaksi ialah [Fe3+]0 = 0,1 M dan [SCN–]0 = 0,5 M. Setelah reaksi mencapai kesetimbangan masih tersisa 0,04 M. Artinya, tidak semua Fe3+ habis bereaksi. Konsentrasi Fe3+ sisa tiada lain ialah konsentrasi Fe3+ dalam keadaan kesetimbangan: [Fe3+]kstb = 0,04 M, selebihnya telah bermetamorfosis hasil reaksi, yaitu sebanyak [Fe3+]0 – [Fe3+]kstb = 0,06 M.
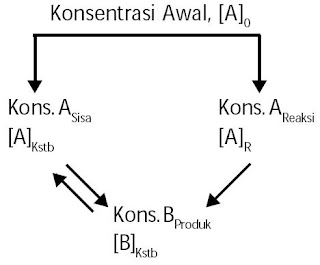 |
| Gambar 10. Pereaksi A sebagian bermetamorfosis B dan sisanya tetap sebagai A. Konsentrasi molar pada keadaan kesetimbangan ialah [A] sisa dan [B] hasil reaksi. |
Berapa konsentrasi SCN– dan konsentrasi Fe(SCN)2+ yang berada dalam kesetimbangan? Jawaban ini sanggup diketahui berdasarkan koefisien reaksinya. Oleh lantaran rasio stoikiometri SCN– terhadap Fe3+ = 1:1 maka konsentrasi SCN– yang bereaksi dengan Fe3+ sama, yaitu 0,06 M sehingga konsentrasi SCN– dalam kesetimbangan [Fe3+]kstb adalah 0,5 M – 0,06 atau M = 0,44 M.
Konsentrasi Fe(SCN)2+ dalam kesetimbangan, juga sanggup dihitung berdasarkan rasio stoikiometrinya, hasilnya: [Fe(SCN)2+]kstb = 0,06 M. Data hasil penyelidikan sanggup diungkapkan ke dalam bentuk diagram kesetimbangan sebagai berikut.
Untuk memudahkan perhitungan, data konsentrasi masing-masing zat sanggup juga ditabulasikan ke dalam tabel menyerupai berikut.
Tabel 2. Contoh Tabulasi Data Sistem Kesetimbangan Fe3+ + SCN– ↔ FeSCN2+
Spesi Kimia | Fe3 | SCN– | FeSCN2 |
Konsentrasi awal (M) | 0,1 | 0,5 | – |
Konsentrasi yang berubah (M) | –0,06 | –0,06 | +0,06 |
Konsentrasi kesetimbangan (M) | 0,04 | 0,44 | 0,06 |
Untuk memilih nilai tetapan kesetimbangan, nilai konsentrasi masing-masing spesi dalam keadaan kesetimbangan dimasukkan ke dalam persamaan tetapan kesetimbangan.

Dengan demikian, tetapan kesetimbangan hanya sanggup ditentukan berdasarkan hasil penyelidikan yang dilakukan pada suhu tetap.
Contoh Soal Menentukan Nilai Tetapan Kesetimbangan :
Perhatikan reaksi kesetimbangan berikut.
PCl5(g) ↔ PCl3(g) + Cl2(g)
Jika konsentrasi awal PCl5 0,1 M dan sesudah kesetimbangan tercapai ditemukan gas Cl2 0,025 M, berapakah tetapan kesetimbangan untuk sistem tersebut?
Pembahasan :
- Gunakan rasio stoikiometri untuk menentukan: konsentrasi PCl5 yang terurai dan PCl5 sisa. konsentrasi PCl3 yang terbentuk.
- Hitung tetapan kesetimbangannya. Diagram reaksi kesetimbangan :
Oleh lantaran koefisien reaksi sama (RS = 1 : 1) maka konsentrasi molar PCl5 terurai dan PCl3 terbentuk sama dengan konsentrasi Cl2 dalam kesetimbangan, yakni 0,025M.
Konsentrasi PCl5 sisa ialah selisih [PCl5] awal dan [PCl5] terurai.
at | PCl5 | PCl3 | Cl2 |
[Awal] /M | 0,1 | – | – |
[Berubah] / M | –0,025 | +0,025 | +0,025 |
[Setimbang]/M | 0,075 | 0,025 | 0,025 |
Setelah konsentrasi molar masing-masing zat dalam keadaan kesetimbangan diketahui maka tetapan kesetimbangan sanggup dihitung, yaitu:

Jadi, nilai Kc untuk reaksi tersebut ialah 120.
Pada uraian tersebut, sistem reaksi kesetimbangan mempunyai rasio stoikiometri atau koefisien reaksi yang sama. Bagaimana jikalau koefisien reaksi dalam kesetimbangan berbeda? Simak referensi soal berikut.
Contoh Soal Menentukan Konsentrasi at dalam Kesetimbangan :
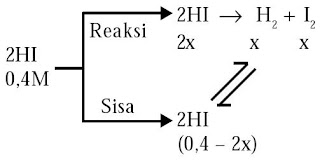
Ke dalam reaktor dengan volume 10 L diisi 4 mol HI. Pada 400°C terbentuk reaksi kesetimbangan berdasarkan persamaan berikut:
2HI(g) ↔ H2(g) + I2(g).
Berapakah konsentrasi masing-masing zat pada keadaan setimbang? Diketahui harga Kc = 0,695.
2HI(g) ↔ H2(g) + I2(g).
Berapakah konsentrasi masing-masing zat pada keadaan setimbang? Diketahui harga Kc = 0,695.
Penyelesaian :
1. Hitung konsentrasi molar HI awal.
2. Buat diagram reaksi kesetimbangan. Sisipkan konsentrasi zat yang diketahui dan buat pemisalan untuk zat yang tidak diketahui, contohnya [x].
3. Tentukan konsentrasi molar HI terurai, HI sisa, serta H2 dan I2 yang terbentuk berdasarkan rasio stoikiometrinya.
• Konsentrasi awal [HI]0 = 4 mol/10 L = 0,4 M.
• Jika [HI] terurai 2x M maka [H2] dan [I2] terbentuk ialah x M, dan [HI] sisa = (0,4 – 2x) M.
Nilai x sanggup ditentukan dari persamaan tetapan kesetimbangan, yaitu:
Jika persamaan di atas dihitung secara aljabar akan diperoleh persamaan kuadrat sebagai berikut:
1,78x2 – 1,11x + 0,11 = 0
Dengan memakai rumus persamaan kuadrat
Jika nilai x1 diambil maka konsentrasi HI yang terurai 2(0,5) = 1,0 M, sedangkan konsentrasi HI awal lebih kecil, yakni 0,4 M (tidak realistik).
Oleh lantaran itu, nilai x yang mewakili penguraian HI adalah x2 = 0,124.
Dengan demikian, konsentrasi masing-masing zat dalam kesetimbangan adalah
[H2] = x = 0,124 M; [I2] = x = 0,124 M;
[HI] = 0,4 – 2x = 0,152 M
Contoh Soal Menentukan Konsentrasi at dan Tetapan Kesetimbangan :
Gas CO dan gas H2 bereaksi berdasarkan persamaan berikut:
CO(g) + 3H2(g) ↔ CH4(g) + H2O(g)
Jika konsentrasi awal CO dan H2 masing-masing 0,75 M, dan sesudah kesetimbangan dicapai diketahui terdapat H2 0,15 M. Berapakah konsentrasi molar masing-masing zat dalam kesetimbangan? Berapa tetapan kesetimbangannya?
Jawaban :
1. Buat diagram reaksi kesetimbangan.
2. Tentukan konsentrasi molar masing-masing zat dalam kesetimbangan.
Konsentrasi zat dalam keadaan kesetimbangan sanggup ditentukan berdasarkan perbandingan koefisien reaksi terhadap konsentrasi molar H2O.
[H2O]Kstb = 0,15 M
[CH4]Kstb = 0,15 M
[CO]Kstb = (0,75 – 0,15) M
[H2]Kstb = (0,75 – 0,45) MHasilnya ditabulasikan dalam tabel berikut:
at | C0 (M) | Perubahan | C Kstb (M) |
CO | 0,75 | 0,15 | 0,60 |
H2 | 0,75 | 0,45 | 0,30 |
CH4 | – | 0,15 | |
H2O | – | 0,15 |
Harga tetapan kesetimbangannya sebagai berikut.

Contoh Soal UNAS 2004 :
Dalam suatu daerah tertutup, berlangsung kesetimbangan:
PCl5(g) ↔ PCl3(g) + Cl2(g)
jikalau volume diperkecil, dengan tetap menjaga suhu, maka:
- jumlah mol PCl3 berkurang
- harga Kc tidak berubah
- jumlah mol PCl5 bertambah
- jumlah mol Cl2 berubah
Pernyataan yang benar
A. 1, 2, dan 3
B. 1 dan 3
C. 2 dan 4
D. 1, 2, dan 4
E. 1, 2, 3, dan 4
Pembahasan :
Jika volume diperkecil, reaksi bergeser ke arah jumlah koefisien terkecil (ke arah kiri) akibatnya:
• jumlah mol PCl3 berkurang
• harga Kc tetap (karena suhu tetap)
• jumlah mol PCl5 bertambah
• jumlah mol Cl2 berkurang
Jadi, jawabannya (A)
3.2. Cara Memanipulasi Tetapan Kesetimbangan
Jika reaksi yang berada dalam kesetimbangan dipelajari dari arah sebaliknya atau konsentrasi molar zat-zat yang bereaksi digandakan dengan faktor tertentu, bagaimana nilai tetapan kesetimbangannya? Semua manipulasi ini akan memengaruhi nilai tetapan kesetimbangan.
a. Pembalikan Arah Reaksi Kesetimbangan
Jika persamaan reaksi kesetimbangan dikaji dari arah yang berlawanan maka nilai tetapan kesetimbangan yang gres merupakan kebalikkan dari tetapan semula.
Contoh :
Tinjau sistem reaksi kesetimbangan berikut.
PCl3(g) + Cl2(g) ↔ PCl5(g)
Persamaan untuk tetapan kesetimbangannya:
Jika dipelajari dari arah sebaliknya, PCl5(g) ↔ PCl3(g) + Cl2(g)
Maka persamaan tetapan kesetimbangannya:
Toksisitas CO
Manusia, menyerupai halnya makhluk hidup lainnya membutuhkan oksigen yang diperoleh melalui proses bernapas. Setiap insan bernapas sekitar 500 mL udara masuk ke dalam paru-paru. Dari nilai tersebut hanya sekitar 3% terlarut dalam darah selebihnya berikatan dengan molekul hemoglobin (Hb). Reaksi oksigen dengan hemoglobin merupakan suatu sistem kesetimbangan.
Hb + O2 ↔ HbO2
Apakah yang terjadi apabila dalam udara yang kita hirup terdapat gas CO? Hemoglobin mempunyai afinitas yang lebih besar terhadap CO dibanding O2. Akibatnya, sistem kesetimbangan mengalami gangguan berupa pengurangan konsentrasi Hb. Menurut asas Le Chatelier gangguan tersebut akan menyebabkan kesetimbangan bergeser ke arah kiri. Ini berarti, pasokan O2 kepada sel badan berkurang. Apabila keadaan berlanjut sanggup menyebabkan kematian. (Sumber: Chemistry The Central Science, 2000)
b. Perkalian dengan Faktor Tertentu
Jika persamaan reaksi kesetimbangan dikalikan dengan faktor tertentu, nilai tetapan kesetimbangan yang gres merupakan pangkat dari faktor pengali. Perhatikan referensi berikut:
SO2(g) + ½ O2(g) ↔ SO3(g) (A)
Jika persamaan dikalikan dengan faktor 2 maka persamaan reaksi kesetimbangan menjadi:
2SO2(g) + O2(g) ↔ 2SO3(g) (B)
Persamaan tetapan kesetimbangan untuk reaksi (A) dan (B) berturut-turut sebagai berikut.
Secara umum sanggup dutulis sebagai Kc = (Kc)n, n sebagai faktor pengali.
c. Penjumlahan Reaksi Kesetimbangan
Dua atau lebih persaman reaksi kesetimbangan sanggup dijumlahkan menjadi satu persamaan. Hal ini sanggup dilakukan jikalau zat-zat dalam sistem reaksi mengandung unsur-unsur yang sama. Perhatikan referensi berikut.
(a) | N2(g) + O2(g) ↔ 2NO(g) | K1 |
(b) | 2NO(g) + O2(g) ↔ 2NO2(g) | K2 |
(c) | N2(g) + 2O2(g) ↔ 2NO2(g) | K3 |
Persamaan tetapan kesetimbangan untuk ketiga sistem reaksi di atas ialah :
Untuk mengetahui kekerabatan antara K1, K2, K3 dapat dilakukan perkalian antara K1 dan K2.
Hasil perkalian K1 dan K2 tiada lain ialah persamaan tetapan untuk K3 Dengan demikian, harga K3 merupakan hasil perkalian K1 dan K2.
Contoh Soal Memanipulasi Tetapan Kesetimbangan :
Tentukan nilai Kc untuk reaksi kesetimbangan:
½ N2(g) + ½ O2(g) + ½ Br2 (g) ↔ NOBr(g)
Diketahui :
(a) 2NO(g) ↔ N2(g) + O2(g) K(a) = 24
(b) NO(g) + ½ Br2(g) ↔ NOBr(g) K(b)= 1,4 Jawaban :
Bentuk persamaan reaksi yang ditanyakan ialah setengah dan kebalikan dari persamaan (a), serta penjumlahan dengan persamaan (b).
½ N2(g) + ½ O2(g) | ↔ | NO(g) |
NO(g) + ½ Br2(g) | ↔ | NOBr(g) |
½ N2(g) + ½ O2(g) + ½ Br2 (g) | ↔ | NOBr(g) |
Perkalian dengan faktor 1/2 dan pembalikan arah reaksi (a) menghasilkan tetapan kesetimbangan :

Penjumlahan dengan reaksi (b) menghasilkan tetapan kesetimbangan berikut:
Kc = K(a) × K(b) = 0,2 ×1,4 = 0,28
Jadi, nilai tetapan kesetimbangan(Kc) untuk reaksi pembentukan NOBr dari unsur-unsurnya ialah 0,28.
3.3. Tetapan Kesetimbangan dalam Bentuk Tekanan Parsial (Kp)
Pada topik sebelumnya, Anda sudah mengenal istilah tekanan parsial, yaitu tekanan salah satu komponen sistem yang terdapat dalam gabungan gas. Selain dengan konsentrasi molar, tetapan kesetimbangan untuk sistem reaksi yang melibatkan gas sanggup dinyatakan dengan tekanan parsial masing-masing komponen gas.
Simak sistem reaksi kesetimbangan berikut:
N2(g) + 3H2(g) ↔ 2NH3(g)
Bagaimanakah persamaan tetapan kesetimbangan untuk reaksi tersebut yang diungkapkan dalam bentuk tekanan parsial komponen gas?
Pada dasarnya tetapan kesetimbangan dalam bentuk tekanan parsial tidak berbeda dengan tetapan kesetimbangan dalam konsentrasi molar.
Kp ialah tetapan kesetimbangan dalam bentuk tekanan parsial. (PNH3)2, PN2, P (H2)3 adalah tekanan parsial masing-masing komponen gas dalam kesetimbangan yang dipangkatkan dengan koefisien reaksinya.
Contoh Soal Menentukan Tekanan Parsial Gas dalam Sistem Kesetimbangan :
Uap HCl sanggup bereaksi dengan uap amonia berdasarkan persamaan:
HCl(g) + NH3(g) ↔ NH4Cl(s)
Jika nilai Kp = 0,15, berapakah tekanan parsial komponen gas dalam sistem kesetimbangan tersebut?
Penyelesaian :
- Lakukan pemisalan untuk memilih tekanan parsial masing-masing komponen.
- Hitung tekanan parsial masing-masing komponen gas memakai tetapan kesetimbangan.
Oleh karena NH4Cl zat murni, tidak perlu dihitung dalam tetapan kesetimbangan.
Koefisien reaksi HCl dan NH3 sama sehingga tekanan parsialnya juga sama, contohnya x atm.
Persamaan tetapan kesetimbangan untuk reaksi ini ialah sebagai berikut.
Dengan demikian, tekanan parsial HCl dan NH3 besarnya sama yaitu 2,58 atm.
3.4. Hubungan Kp dan Kc
Dalam reaksi kesetimbangan yang melibatkan gas, nilai Kp dan Kc dapat sama atau beda. Tinjau persamaan reaksi hipotetik berikut.
αA + βB ↔ γC + δD
Tetapan kesetimbangan untuk reaksi tersebut dalam bentuk tekanan parsial dan konsentrasi molar ialah sebagai berikut.
Bagaimanakah kekerabatan antara Kp dan Kc dalam sistem reaksi yang sama? Apakah mempunyai nilai yang sama atau beda?
Masih ingatkah Anda perihal persamaan gas ideal yang mempunyai kegunaan untuk memilih volume molar gas nonstandar? Persamaan tersebut sanggup menujukkan kekerabatan tekanan dan konsentrasi molar gas.
Persamaannya ialah Pv = nRT.
Persamaan ini sanggup diubah menjadi:
P = (n/v) RT atau P=[C]RT
Tekanan parsial A sanggup ditulis sebagai: PA = [A] RT.
Dengan memasukkan persamaan tekanan parsial komponen gas ke dalam persamaan Kp, diperoleh:
Persaman tersebut masih sanggup disederhanakan menjadi:
Kp = Kc(RT)Δn , Δn ialah selisih koefisien reaksi.
Δn = Jumlah mol hasil reaksi – jumlah mol pereaksi
Contoh Soal Menghitung Tetapan Kesetimbangan Sistem Gas :
Tuliskan rumus persamaan Kp dan Kc untuk reaksi:
2SO2(g) + O2(g) ↔ 2SO3(g)
Bagaimanakah kekerabatan antara Kp dan Kc untuk reaksi tersebut?
Jawaban :
Pada persamaan reaksi di atas , Δn = (2 – 3) = –1.
Dengan demikian, Kp = Kc(RT)–1.
Contoh Soal Menghitung Tetapan Kesetimbangan Sistem Gas :
Pada 300K, nilai Kp untuk reaksi oksidasi SO2 tersebut ialah 7,5.
Tentukan nilai Kc.
Penyelesaian :
Hubungan Kp dan Kc adalah Kp = Kc (RT)–1
Nilai Kc untuk reaksi tersebut:
7,5 = Kc(0,082 L atm K–1 mol–1 × 300 K)–1
Kc = 0,3
Jadi, nilai tetapan kesetimbangan dalam konsentrasi molar sebesar 0,3 (nilai Kc tidak sama dengan Kp).
D. Penerapan Reaksi Kesetimbangan di Industri Kimia
Reaksi-reaksi yang berkesetimbangan merupakan persoalan bagi industri, mengapa? Industri memerlukan produk yang efektif dan efisien dengan biaya semurah-murahnya. Dalam reaksi kesetimbangan, produk yang dihasilkan tidak efektif lantaran sanggup membentuk kembali pereaksi.
Untuk menghasilkan produksi yang maksimal diharapkan pengetahuan untuk menggeser posisi kesetimbangan ke arah produk.
4.1. Penerapan Reaksi Kesetimbangan di Industri Amonia
Amonia merupakan materi dasar untuk pembuatan pupuk, sebagai pelarut, pembersih, dan banyak lagi produk sintetik yang memakai materi dasar amonia. Amonia disintesis dari gas N2 dan H2 melalui proses Haber menyerupai ditunjukkan pada Gambar 11, reaksinya membentuk kesetimbangan.
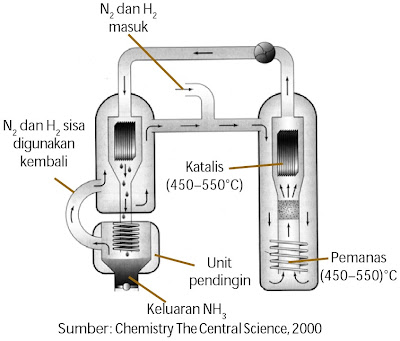 |
| Gambar 11. Diagram sintentis amonia (proses Haber). |
N2(g) + 3H2(g) ↔ 2NH3(g) ΔH25 = –92,2 kJ
Masalah utama sintesis amonia ialah bagaimana menggeser posisi kesetimbangan ke arah kanan biar dihasilkan amonia semaksimal mungkin. Apakah Anda punya gagasan atau saran untuk hal ini?
Saran pertama tentu pereaksi harus dipasok terus menerus biar posisi kesetimbangan bergeser ke arah pembentukan amonia. Saran kedua, suhu dan tekanan sistem harus optimal. Bagaimana caranya?
a. Optimasi Suhu
Oleh lantaran pembentukan amonia bersifat eksoterm maka untuk mengoptimalkan produksi amonia, suhu reaksi harus tinggi atau rendah? Tentunya harus rendah lantaran suhu reaksi yang tinggi akan menggeser kesetimbangan ke arah reaksi endoterm (penguraian amonia).
Jika suhu terlalu rendah, reaksi berlangsung sangat lambat (hampir tidak bereaksi). Jika suhu terlalu tinggi, reaksi bergeser ke arah penguraian amonia. Jadi, bagaimana cara yang efektif dan efisien? Dalam kasus menyerupai ini, perlu ditentukan suhu optimum (tidak terlalu tinggi, juga tidak terlalu rendah). Hasil penyelidikan memperlihatkan bahwa suhu optimum pembentukan amonia sekitar 450 oC – 500 oC (perhatikan Gambar 12).
 |
| Gambar 12. Kurva meningkatkan secara optimal pada sintesis amonia (a) Tekanan (b) Suhu. |
b. Optimasi Tekanan
Selain meningkatkan secara optimal suhu, tekanan juga perlu dioptimasi, mengapa? Ini dikarenakan sintesis amonia melibatkan fasa gas dan rasio stoikiometri antara pereaksi dan hasil reaksi tidak sama. Koefisien reaksi pembentukan amonia lebih kecil dari koefisien pereaksi sehingga tekanan harus tinggi. Dalam praktiknya, tekanan yang diterapkan sekitar 250 atm (perhatikan Gambar 12a).
Mengapa tekanan yang diterapkan tidak lebih tinggi lagi? Hal ini berkaitan dengan aspek teknologi. Semakin tinggi tekanan maka diharapkan peralatan yang sangat kuat biar tidak terjadi ledakan.
4.2. Penerapan Reaksi Kesetimbangan di Industri Asam Sulfat
Di Indonesia, asam sulfat merupakan salah satu materi baku untuk menciptakan pupuk, pigmen dan cat, pembuatan besi dan baja, pembuatan pulp dan kertas, pengisi sel accumulator, pelarut, pengatur pH di dalam proses industri, pendehidrasi, serta pembuatan produk-produk kimia lainnya, menyerupai amonium sulfat dan kalsium hidrofosfat.
 |
| Gambar 13. Diagram proses kontak (sintesis asam sulfat). |
Pembuatan asam sulfat di industri dikembangkan melalui proses kontak menyerupai pada Gambar 13, dengan tiga tahap utama sebagai berikut.
1. Pembentukan sulfur dioksida, persamaan reaksinya adalah
S(l) + O2(g) → SO2(g)
2. Pembentukan sulfur trioksida, persamaan reaksinya adalah
SO2(g) + O2(g) ↔ SO3(g) ΔH = –190 kJ
3. Pembentukan asam sulfat, melalui zat antara, yaitu asam pirosulfat.
Persamaan reaksinya adalah
SO3–(g) + H2SO4(aq) → H2S2O7(aq)
H2S2O7(aq) + ½ O(l) → 2H2SO4(aq) Dari ketiga tahapan tersebut, tahap dua merupakan tahap yang memilih efisiensi produk asam sulfat lantaran membentuk reaksi kesetimbangan. Jika meningkatkan secara optimal sistem reaksi sempurna maka akan diperoleh gas SO3 yang maksimal. Bagaimana cara mengoptimasi pembentukan SO3 pada tahap kedua tersebut?
a. Optimasi Suhu
Oleh lantaran pembentukan SO3 bersifat eksoterm, efektivitas pembentukan SO3 dioperasikan pada suhu rendah. Kendalanya, sama menyerupai pada kasus pembuatan amonia. Jika suhu terlalu rendah maka reaksi berlangsung sangat lambat. Akan tetapi, jikalau suhu terlalu tinggi, reaksi bergeser ke arah penguraian SO3 Selain itu, katalis menjadi tidak berfungsi. Berdasarkan hasil penyelidikan, suhu optimum pembentukan. SO3 sekitar 450 °C – 500 °C (perhatikan Gambar 14).
 |
| Gambar 14. Kurva meningkatkan secara optimal suhu pada sintesis asam sulfat. |
b. Optimasi Tekanan
Berdasarkan data koefisien reaksi, Anda sanggup menduga bahwa tekanan yang dioperasikan harus tinggi, biar posisi kesetimbangan bergeser ke arah produk. Umumnya, tekanan yang dioperasikan berkisar antara 2–3 atm. Tekanan tinggi tidak sanggup dioperasikan dalam proses ini lantaran peralatannya tidak mendukung (SO3 bersifat korosif terhadap logam).
4.3. Penerapan Reaksi Kesetimbangan di Industri Asam Nitrat
Asam nitrat banyak dipakai dalam pembuatan pupuk, nitrasi senyawa organik untuk materi eksplosif, plastik, celupan, dan pernis, juga sebagai materi oksidator dan pelarut. Di industri, pembuatan asam nitrat memakai proses Ostwald, yaitu pembuatan asam nitrat dari materi mentah amonia dan udara. Proses pembuatan asam nitrat melalui tiga tahapan, yaitu:
a. Tahap pembentukan nitrogen oksida.
Campuran amonia dan udara berlebih dialirkan melewati katalis Pt–Rh pada suhu 850 °C dan tekanan 5 atm. Persamaan reaksinya:
4NH3(g) + 5O2(g) ↔ 4NO(g) + 6H2O(l) ΔH= 907 kJ (pada 25 °C)
b. Tahap pembentukan nitrogen dioksida
Nitrogen monoksida dioksidasi kembali dengan udara membentuk gas nitrogen dioksida. Persamaan reaksinya:
2NO(g) + O2(g) ↔ 2NO2(g) ΔH= –114,14 kJ (pada 25°C)
c. Tahap pembentukan asam nitrat
Nitrogen dioksida gotong royong dengan udara berlebih dilarutkan dalam air panas 80 °C membentuk asam nitrat. Persamaannya:
4NO2(g) + O2(g) + 2H2O(l) → 4HNO3(aq)
Pada proses Ostwald, ada dua tahap reaksi yang membentuk kesetimbangan, yaitu tahap satu dan tahap dua. Kedua tahap itu bersifat eksotermis dan mempunyai koefisien reaksi yang berbeda, yaitu koefisien hasil reaksi lebih kecil dari koefisien pereaksi.
Pada tahap dua, reaksi tidak efisien pada suhu tinggi, sehingga gas NO panas yang terbentuk pada tahap pertama didinginkan dengan memasok udara dingin, sekaligus berfungsi untuk mengoksidasi gas NO menjadi NO2.
Rangkuman :
- Dalam reaksi kimia ada yang satu arah, reaksi dua arah, dan reaksi yang membentuk kesetimbangan dinamis.
- Reaksi yang membentuk kesetimbangan dinamis ialah reaksi dua arah dalam waktu bersamaan dengan laju yang sama.
- Kesetimbangan dinamis ialah keadaan suatu pereaksi dan hasil reaksi yang secara makroskopik tidak berubah, tetapi keadaan mikroskopiknya berubah setiap ketika dalam dua arah dengan laju sama.
- Tetapan kesetimbangan ialah suatu besaran yang harganya tetap, diperoleh dari perbandingan konsentrasi produk terhadap konsentrasi pereaksi dan masingmasing dipangkatkan dengan koefisien reaksinya.
- Harga tetapan kesetimbangan diperoleh dari aturan agresi massa yang harganya tetap selama suhu reaksi tidak berubah.
- Kesetimbangan kimia sistem heterogen untuk zat padat murni atau cairan murni tidak berubah, sehingga tidak memengaruhi nilai tetapan kesetimbangan. Oleh lantaran itu, tidak terlibat dalam persamaan tetapan kesetimbangan.
- Faktor-faktor yang sanggup memengaruhi keadaan kesetimbangan ialah perubahan konsentrasi, suhu, dan tekanan atau volume.
- Menurut Le Chatelier, jikalau sistem reaksi kesetimbangan diganggu, sistem akan berusaha mengurangi gangguan itu dengan cara melaksanakan pergeseran posisi kesetimbangan, baik ke arah pereaksi maupun ke arah produk hingga dengan tercapai keadaan kesetimbangan yang baru.
- Tetapan kesetimbangan dalam bentuk molaritas (Kc) dihitung berdasarkan konsentrasi molar zat-zat hasil reaksi dibagi konsentrasi molar zat-zat pereaksi sisa yang masih terdapat dalam sistem kesetimbangan, masing-masing dipangkatkan oleh koefisien reaksinya.
- Tetapan kesetimbangan dalam bentuk tekanan (Kp) dihitung berdasarkan tekanan parsial gas-gas hasil reaksi dibagi tekanan parsial gas-gas pereaksi sisa yang masih ada dalam sistem kesetimbangan masing-masing dipangkatkan dengan koefisien reaksinya.
- Hubungan Kp dan Kc dinyatakan melalui persamaan : Kp = Kc (RT)Δn, R ialah tetapan gas, T = suhu sistem reaksi, dan Δn ialah selisih koefisien reaksinya.
- Dalam industri kimia, banyak reaksi kimia yang membentuk keadaan setimbang sehingga perlu dilakukan upaya untuk menggeser posisi kesetimbangan ke arah produk. Hal ini sanggup dilakukan dengan mengoptimasi suhu, tekanan, dan penambahan katalis.
Anda kini sudah mengetahui Kesetimbangan Kimia. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Sunarya, Y. dan A. Setiabudi. 2009. Praktis dan Aktif Belajar Kimia 2 : Untuk Kelas XI Sekolah Menengah Atas/Madrasah Aliyah Program Ilmu Pengetahuan Alam. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta. p. 250.
Referensi :
Sunarya, Y. dan A. Setiabudi. 2009. Praktis dan Aktif Belajar Kimia 2 : Untuk Kelas XI Sekolah Menengah Atas/Madrasah Aliyah Program Ilmu Pengetahuan Alam. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta. p. 250.




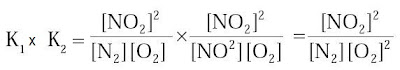
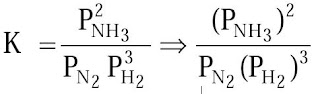
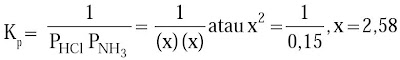


No comments:
Post a Comment