Teori Tumbukan Pada Laju Reaksi, Energi Aktivasi, Kecepatan, Contoh, Grafik, Kimia - Reaksi kimia terjadi sebagai tanggapan tumbukan antara molekul-molekul. Jumlah tumbukan antara molekul-molekul per satuan waktu disebut frekuensi tumbukan. Besar frekuensi tumbukan ini dipengaruhi oleh banyak sekali faktor antara lain:
- konsentrasi;
- suhu, dan
- luas permukaan bidang sentuh.
Semakin besar konsentrasi suatu larutan, semakin banyak molekul yang terkandung di dalamnya. Dengan demikian, semakin sering terjadi tumbukan di antara molekul-molekul tersebut. Hal itu berarti hanya sebagian dari tumbukan molekul yang menghasilkan reaksi. Keadaan itu didasarkan pada 2 faktor, yaitu:
- hanya molekul-molekul yang lebih energik yang akan menghasilkan reaksi sebagai hasil tumbukan;
- kemungkinan suatu tumbukan tertentu untuk menghasilkan reaksi kimia tergantung dari orientasi molekul yang bertumbukan.
Energi minimum yang harus dimiliki molekul untuk sanggup bereaksi disebut energi pengaktifan (Ea). Berdasarkan teori kinetik gas, molekul-molekul gas dalam satu wadah tidak mempunyai energi kinetik yang sama, tetapi bervariasi ibarat ditampilkan pada gambar 1. di bawah ini.
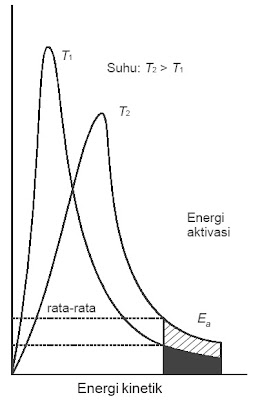 |
| Gambar 1. Distribusi energi molekul-molekul gas. |
Pada suhu yang lebih tinggi (T2), fraksi molekul yang mencapai energi pengaktifan sebesar x2, distribusi energi melebar. Energi kinetik molekul rata-rata meningkat dengan kenaikkan suhu sehingga lebih banyak molekul yang mempunyai energi lebih besar dari energi pengaktifan. Akibatnya, reaksi makin sering terjadi dan laju reaksi juga semakin meningkat.
Laju reaksi kimia tergantung pada hasil kali frekuensi tumbukan dengan fraksi molekul yang mempunyai energi sama atau melebihi energi pengaktifan. Karena fraksi molekul yang teraktifkan biasanya sangat kecil, maka laju reaksi jauh lebih kecil daripada frekuensi tumbukannya sendiri. Semakin tinggi nilai energi pengaktifan, semakin kecil fraksi molekul yang teraktifkan dan semakin lambat reaksi berlangsung. Perhatikan teladan reaksi berikut.
A2(g) + B2(g) → 2AB(g)
Menurut pengertian teori tumbukan, selama tumbukan antara molekul A2 dan B2 (dianggap) ikatan A–A dan B–B putus dan terbentuk ikatan A–B. Pada gambar 2. ditunjukkan bahwa anggapan itu tidak selamanya berlaku untuk setiap tumbukan.
 |
| Gambar 2. Tumbukan molekul dan reaksi kimia (a) Tumbukan yang tidak memungkinkan terjadinya reaksi. (b) Tumbukan yang memungkinkan terjadinya reaksi. |
Molekul-molekul harus mempunyai orientasi tertentu biar tumbukan efektif untuk menghasilkan reaksi kimia. Pada gambar 2. ditunjukkan bahwa jumlah tumbukan yang orientasinya tidak memungkinkan terjadi reaksi umumnya lebih banyak daripada jumlah tumbukan yang memungkinkan terjadinya reaksi. Hal itu berarti peluang suatu tumbukan tertentu untuk menghasilkan reaksi umumnya kecil.
1. Luas permukaan sentuhan
Makin luas permukaan sentuhan antara zat-zat pereaksi, makin banyak molekul-molekul pereaksi yang bertumbukan. Dengan demikian, kemungkinan terjadi reaksi semakin besar sehingga reaksi lebih cepat berlangsung.
2. Sifat kimia pereaksi
Senyawa-senyawa ion lebih cepat bereaksi daripada senyawa-senyawa kovalen. Pada setiap tumbukan yang terjadi antara ion positif dan ion negatif selalu dihasilkan reaksi lantaran tidak ada energi tumbukan yang dibutuhkan untuk memutuskan ikatan terlebih dahulu. Lain halnya dengan reaksi antara senyawa-senyawa kovalen yang tidak setiap tumbukan sanggup menghasilkan reaksi.
3. Konsentrasi
Dalam konsentrasi yang besar, jumlah partikel per satuan volume juga besar. Kemungkinan terjadinya tumbukan antar partikel di dalamnya lebih besar kalau dibandingkan dengan yang terjadi pada konsentrasi yang rendah. Dengan demikian makin besar konsentrasi zat yang bereaksi, makin banyak partikel yang bereaksi per satuan waktu dan makin besar laju reaksinya.
Pada beberapa jenis reaksi, perbesaran konsentrasi pereaksi tidak selalu mempercepat reaksi atau perbesaran konsentrasi tidak sebanding dengan perbesaran laju reaksinya. Hal ini dijelaskan dengan teori tumbukan sebagai berikut.
Agar pereaksi sanggup bereaksi, terlebih dahulu harus terjadi tumbukan antara partikel-partikel zat pereaksi tersebut. Pada reaksi sederhana, yaitu reaksi yang berlangsung satu tahap, perubahan konsentrasi pereaksi sebanding dengan perubahan kecepatan reaksinya. Misalnya, pada reaksi sederhana A + B → C kalau konsentrasi A dijadikan 2 kali dan konsentrasi B tetap, maka laju reaksi akan menjadi 2 kali pula. Demikian pula, kalau konsentrasi B dijadikan 2 kali dan konsentrasi A tetap. Pada reaksi yang tidak sederhana, tumbukan antara partikel-partikel pereaksi tidak eksklusif menghasilkan hasil akhir. Reaksi ini sanggup terjadi pada reaksi yang melibatkan satu jenis pereaksi atau lebih. Reaksi yang melibatkan lebih dari dua partikel ibarat dalam reaksi 2H2 + 2NO → N2 + 2H2O tidak mungkin terjadi lantaran tumbukan sekaligus antara 4 partikel pada satu titik dan satu ketika yang sama. Tumbukan hanya mungkin terjadi antara dua partikel. Oleh lantaran itu, diperkirakan bahwa reaksi yang tidak sederhana berjalan tahap demi tahap yang pada setiap tahap hanya terjadi tumbukan antara dua partikel. Pada teladan reaksi di atas, diperkirakan reaksi berjalan melalui tahap-tahap sebagai berikut.
Tahap 1 | : | NO(g) + NO(g) ↔ N2O2(g) (cepat) | |
Tahap 2 | : | N2O2(g) + H2(g) → N2O(g) + H2O(l) (cepat) | |
Tahap 3 | : | N2O(g) + H2(g) → N2(g) + H2O(l) (lambat) | + |
2NO(g) + 2H2(g) → N2(g) + 2 H2O(l) (reaksi stoikiometri) |
Tiap-tiap tahap merupakan reaksi sederhana.
Rangkaian tahap-tahap yang menunjukan jalannya suatu reaksi dari awal sampai simpulan disebut prosedur reaksi. Setiap tahap mempunyai laju reaksi yang berbeda. Seringkali ditemukan bahwa di antara tahap-tahap reaksi dalam prosedur reaksi terdapat satu tahap dengan laju yang relatif rendah. Dalam hal ini, laju reaksi secara keseluruhan ditentukan oleh tahap yang lambat atau dengan kata lain tahap yang paling lambat dalam suatu prosedur reaksi merupakan tahap penentu laju reaksi.
Pada prosedur reaksi tersebut, tahap ketiga merupakan tahap yang memilih laju reaksi keseluruhan.
r = k [N2O] [H2]
Oleh karena N2O tidak terdapat dalam reaksi stoikiometri, maka konsentrasi N2O pada persamaan laju reaksi harus dieliminasi. Hal ini sanggup dilakukan dengan memperhatikan reaksi tahap 1. Reaksi tahap 1 merupakan reaksi yang berjalan dua arah dengan laju yang sama (reaksi kesetimbangan).
rke kanan = rke kiri
rke kanan = k" [NO]2
rke kiri = k" [N2O2]
k' [NO]2 = k" [N2O2]
Berdasarkan stoikiometri reaksi tahap 2, sanggup dilihat bahwa [N2O2] sama dengan [N2O]
k’ [NO]2 = k” [N2O]
[N2O] = k’/ k” [NO]2
Jadi, r = k . k’/ k” [NO]2 [H2] atau kalau k . k’/ k” = K, maka,
r = K [NO]2 [H2]
Reaksi merupakan orde ketiga dan ini sesuai dengan hasil eksperimen.
4. Suhu / Temperatur
Kenaikan suhu mempercepat reaksi lantaran dengan kenaikan suhu gerakan partikel semakin cepat. Energi kinetik partikel-partikel semakin bertambah sehingga makin banyak terjadi tumbukan yang efektif. Dengan demikian, makin banyak partikel-partikel yang bereaksi.
5. Katalis
Katalis ialah zat yang sanggup meningkatkan laju reaksi tanpa menjadikan perubahan kimia yang baka bagi zat itu sendiri. Setelah reaksi kimia berlangsung, katalis terdapat kembali dalam keadaan dan jumlah yang sama dengan sebelum reaksi.
Telah dijelaskan bahwa biar terjadi reaksi, partikel-partikel zat harus mempunyai energi minimum tertentu yang disebut energi pengaktifan. Dalam hal ini, katalis berfungsi untuk menurunkan sejumlah energi pengaktifan biar reaksi sanggup berlangsung.
Berikut ini diberikan teladan dampak katalis terhadap energi pengaktifan suatu reaksi.
a. Reaksi : 2N2O(g) → 2N2(g) + O2(g)
Reaksi ini membutuhkan energi pengaktifan sebesar 247 kJ kalau tanpa katalis. Akan tetapi, dengan menawarkan logam platina (Pt) sebagai katalis, energi pengaktifannya berkurang menjadi 138 kJ.
b. Reaksi : 2HI(g) → H2(g) + I2(g)
Reaksi ini membutuhkan energi pengaktifan sebesar 184 kJ kalau tanpa katalis. Akan tetapi, dengan menawarkan logam emas (Au) sebagai katalis, energi pengaktifannya berkurang menjadi 59 kJ.
Peranan katalis dalam menurunkan energi pengaktifan ditunjukkan pada gambar 3.
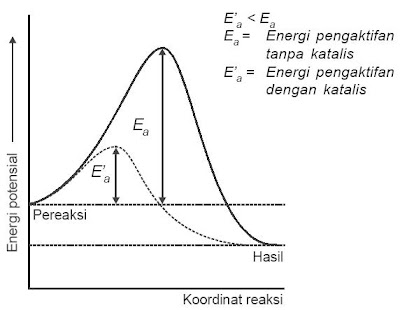 |
| Gambar 3. Katalis menurunkan energi pengaktifan sehingga memperbesar laju reaksi. |
6. Jenis katalis
Katalis digolongkan sebagai katalis homogen dan heterogen. Katalis homogen ialah katalis yang mempunyai fase yang sama dengan pereaksi dan bekerja melalui penggabungan dengan molekul atau ion pereaksi membentuk keadaan ‘antara’. Keadaan antara ini bergabung dengan pereaksi lainnya membentuk produk dan sesudah produk dihasilkan, katalis melaksanakan regenerasi sebagai zat semula.
Suatu katalis heterogen ialah katalis yang berbeda fase dengan pereaksi dan produk. Katalis ini biasanya padatan dalam pereaksi gas atau cairan, dan reaksi terjadi pada permukaan katalis heterogen. Untuk alasan ini, katalis biasanya dipecah-pecah menjadi butiran halus.
7. Hubungan Faktor-Faktor yang Mempercepat Laju Reaksi dengan Teori Tumbukan
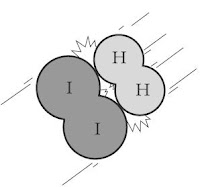
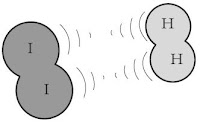
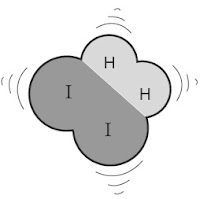
Tumbukan antara pereaksi ada yang menghasilkan reaksi dan tidak, sebagai teladan amati gambar reaksi antara hidrogen dan iodium berikut.
1. Tumbukan dengan energi yang tidak cukup. | 2. Molekul terpisah kembali tumbukan tidak berhasil. |
1. Tumbukan dengan energi yang cukup. Ikatan-ikatan akan putus dan terbentuk ikatan baru. | 2. Molekul HI terbentuk. Tumbukan berhasil. |
Sumber: Lewis, Thinking Chemistry | |
Bagaimana teori tumbukan menjelaskan faktor-faktor yang mempengaruhi laju reaksi? Perhatikan Tabel 1.
Tabel 1. Hubungan faktor-faktor yang mempercepat laju reaksi dengan teori tumbukan
Berdasarkan teori tumbukan, suatu tumbukan akan menghasilkan suatu reaksi kalau ada energi yang cukup. Selain energi, jumlah tumbukan juga berpengaruh. Laju reaksi akan lebih cepat, kalau tumbukan antara partikel yang berhasil lebih banyak terjadi.
8. Energi Aktivasi [2]
Pada kenyataannya molekul-molekul sanggup bereaksi kalau terdapat tumbukan dan molekul-molekul mempunyai energi minimum untuk bereaksi. Energi minimum yang dibutuhkan untuk bereaksi pada ketika molekul bertumbukan disebut energi aktivasi. Energi aktivasi dipakai untuk memutuskan ikatan-ikatan pada pereaksi sehingga sanggup membentuk ikatan gres pada hasil reaksi.
Misalnya energi aktivasi pada reaksi gas hidrogen dan iodium dengan
persamaan reaksi : H2(g) + I2(g) → 2HI(g), digambarkan pada grafik sebagai berikut.
Energi aktivasi pada reaksi tersebut ialah 170 kJ per mol. Untuk terjadi tumbukan antara H2 dan I2 diperlukan energi ≥ 70 kJ. Pada ketika reaksi terjadi energi sebesar 170 kJ diserap dan dipakai untuk memutuskan ikatan H – H dan I – I selanjutnya ikatan H – I terbentuk. Pada ketika terbentuk H – I ada energi yang dilepaskan sehingga reaksi tersebut termasuk reaksi eksoterm.
Bagaimana kerja katalis sehingga sanggup mempercepat reaksi?
Perhatikan Gambar 5.
Pada Gambar 5, proses reaksi tanpa katalis digambarkan dengan satu kurva yang tinggi sedangkan dengan katalis menjadi kurva dengan dua puncak yang rendah sehingga energi aktivasi pada reaksi dengan katalis lebih rendah daripada energi aktivasi pada reaksi tanpa katalis. Berarti secara keseluruhan katalis sanggup menurunkan energi aktivasi dengan cara mengubah jalannya reaksi atau prosedur reaksi sehingga reaksi lebih cepat.
Anda kini sudah mengetahui Pengaruh Katalis Terhadap Laju Reaksi. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Tabel 1. Hubungan faktor-faktor yang mempercepat laju reaksi dengan teori tumbukan
Fakta | Uraian Teori |
Peningkatan konsentrasi pereaksi sanggup mempercepat laju reaksi. | Peningkatan konsentrasi berarti jumlah partikel akan bertambah pada volume tersebut dan menimbulkan tumbukan antar partikel lebih sering terjadi. Banyaknya tumbukan memungkinkan tumbukan yang berhasil akan bertambah sehingga laju reaksi meningkat. |
Peningkatan suhu sanggup mempercepat laju reaksi. | Suhu suatu sistem ialah ukuran dari rata-rata energi kinetik dari partikel-partikel pada sistem tersebut. Jika suhu naik maka energi kinetik partikel-partikel akan bertambah, sehingga kemungkinan terjadi tumbukan yang berhasil akan bertambah dan laju reaksi meningkat. |
Penambahan luas permukaan bidang sentuh akan mempercepat laju reaksi. | Makin besar luas permukaan, menimbulkan tumbukan makin banyak, lantaran makin banyak pecahan permukaan yang bersentuhan sehingga laju reaksi makin cepat. |
Katalis sanggup mempercepat reaksi. | Katalis sanggup menurunkan energi aktivasi (Ea), sehingga dengan energi yang sama jumlah tumbukan yang berhasil lebih banyak sehingga laju reaksi makin cepat. |
Sumber: Lewis, Thinking Chemistry | |
Berdasarkan teori tumbukan, suatu tumbukan akan menghasilkan suatu reaksi kalau ada energi yang cukup. Selain energi, jumlah tumbukan juga berpengaruh. Laju reaksi akan lebih cepat, kalau tumbukan antara partikel yang berhasil lebih banyak terjadi.
8. Energi Aktivasi [2]
Pada kenyataannya molekul-molekul sanggup bereaksi kalau terdapat tumbukan dan molekul-molekul mempunyai energi minimum untuk bereaksi. Energi minimum yang dibutuhkan untuk bereaksi pada ketika molekul bertumbukan disebut energi aktivasi. Energi aktivasi dipakai untuk memutuskan ikatan-ikatan pada pereaksi sehingga sanggup membentuk ikatan gres pada hasil reaksi.
Misalnya energi aktivasi pada reaksi gas hidrogen dan iodium dengan
persamaan reaksi : H2(g) + I2(g) → 2HI(g), digambarkan pada grafik sebagai berikut.
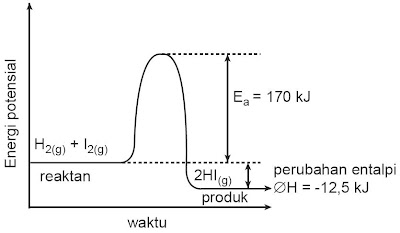 |
| Gambar 4. Grafik energi potensial dan waktu pada reaksi H2 dan I2. |
Bagaimana kerja katalis sehingga sanggup mempercepat reaksi?
Perhatikan Gambar 5.
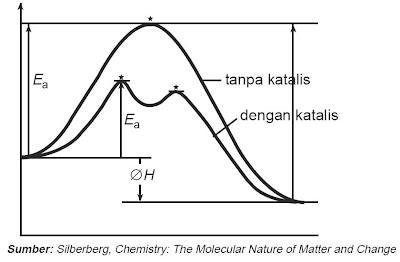 |
| Gambar 5. Grafik energi potensial reaksi tanpa katalis dan dengan pinjaman katalis. |
Anda kini sudah mengetahui Pengaruh Katalis Terhadap Laju Reaksi. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Harnanto, A dan Ruminten. 2009. Kimia 2 : Untuk SMA/MA Kelas XI. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 294.
Referensi Lainnya :
[1] Kalsum, S., P. K. Devi, Masmiami, dan H. Syahrul. 2009. Kimia 2 : Kelas XI Sekolah Menengan Atas dan MA. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 294.
Harnanto, A dan Ruminten. 2009. Kimia 2 : Untuk SMA/MA Kelas XI. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 294.
Referensi Lainnya :
[1] Kalsum, S., P. K. Devi, Masmiami, dan H. Syahrul. 2009. Kimia 2 : Kelas XI Sekolah Menengan Atas dan MA. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 294.

No comments:
Post a Comment