Ciri-ciri Kesetimbangan Dinamis, Reaksi Kimia Bolak-balik dan Searah, Contoh, Pengertian - Jika kita mereaksikan larutan asam klorida (HCl) dengan larutan natrium hidroksida (NaOH), maka akan dihasilkan larutan natrium klorida (NaCl) dan air (H2O). Reaksi yang terjadi antara larutan HCl dan NaOH yaitu sebagai berikut. (Baca juga : Kesetimbangan Kimia)
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l)
Bila dipanaskan hingga jenuh, larutan NaCl dari hasil reaksi di atas akan berkembang menjadi kristal putih yang rasanya asin. Tetapi, kalau kalian mereaksikan kristal putih tersebut dengan air, maka tidak akan terbentuk asam klorida (HCl) dan natrium hidroksida (NaOH). Reaksi tersebut dinamakan reaksi satu arah (irreversible), lantaran hasil reaksi (produk) tidak sanggup diubah kembali menjadi pereaksi (reaktan).
Bagaimana cara kita mengidentifikasi bahwa suatu reaksi berlangsung satu arah? Kalian ingin tahu caranya, bukan? Perhatikan ciri-ciri reaksi satu arah berikut.
- Antara pereaksi dan hasil reaksi dihubungkan dengan satu arah anak panah (→)
- Reaksi berlangsung tuntas. Maksudnya, reaksi akan berhenti bila salah satu atau semua pereaksi habis.
- Zat hasil reaksi tidak sanggup diubah kembali menjadi pereaksi.
Selain reaksi di atas, kita sanggup mengambil teladan reaksi lain. Misalnya, reaksi antara larutan timbal nitrat Pb(NO3)2 yang berwarna putih dengan larutan natrium iodida (NaI) yang jernih. Hasil reaksi mengatakan terbentuknya endapan berwarna kuning dari timbal iodida (PbI2) dan larutan natrium nitrat (NaNO3), yang sanggup dituliskan dalam persamaan reaksi berikut.
Pb(NO3)2(aq) | + | 2 NaI(aq) | → | PbI2(s) | + | NaNO3(aq) ….1) |
kuning | putih |
Bila direaksikan dengan NaNO3 berlebih, endapan PbI2 yang terbentuk dari reaksi di atas akan kembali menjadi larutan Pb(NO3)2 yang berwarna putih dan larutan NaI. Perhatikan reaksi berikut.
PbI2(s) | + | 2 NaNO3(aq) | → | Pb(NO3)2(aq) | + | 2 NaI(aq) ……2) |
kuning | putih |
Berdasarkan hasil reaksi pada reaksi 1 dan 2, diketahui bahwa pereaksi sanggup berkembang menjadi hasil reaksi, dan sebaliknya. Oleh lantaran itu, reaksi 1 dan 2 disebut reaksi bolak-balik (reversible). Persamaan reaksinya yaitu:
Pb(NO3)2(aq) + 2 NaI(aq) D PbI2(s) + 2 NaNO3(aq)
Adapun ciri-ciri reaksi bolak-balik yaitu sebagai berikut.
- Antara pereaksi dan hasil reaksi dihubungkan dengan dua arah anak panah (D)
- Reaksi ke kanan disebut reaksi maju, sedangkan reaksi ke kiri disebut reaksi balik.
Pada reaksi bolak-balik, reaksi maju memiliki laju reaksi yang dilambangkan dengan r1. Sementara itu, laju reaksi pada reaksi balik dilambangkan dengan r2. Jika reaksi bolak-balik mencapai suatu keadaan, saat r1 = r2, maka sanggup disimpulkan bahwa reaksi tersebut mencapai keadaan setimbang, sehingga disebut reaksi kesetimbangan.
Pada dikala mencapai keadaan setimbang, reaksi dianggap selesai lantaran tidak terjadi perubahan yang sanggup dilihat dengan mata, contohnya konsentrasi dan warna. Tetapi, secara mikroskopis, reaksi tersebut berlangsung terus menerus dan tidak berhenti. Maksudnya, pereaksi di sebelah kiri selalu membentuk hasil reaksi di sebelah kanan, dan sebaliknya. Keadaan itu berlangsung terus menerus dengan laju yang sama, sehingga sanggup dikatakan bahwa reaksi tersebut mengalami kesetimbangan dinamis.
Kalian sanggup menemukan teladan kesetimbangan dinamis dalam kehidupan sehari-hari. Misalnya, orang yang sedang menaiki tangga eskalator yang bergerak turun. Jika kecepatan naiknya orang tersebut sama dengan kecepatan turunnya eskalator, maka dikatakan mengalami kesetimbangan dinamis.
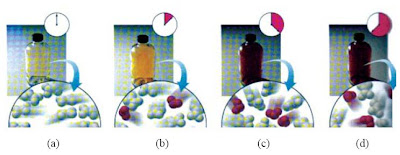
Ciri-ciri kesetimbangan dinamis yaitu : [1]
N2O4(g) D 2NO2(g)
Tercapainya kesetimbangan dinamis peruraian N2O4 dapat dilihat pada gambar 1.
Ciri-ciri kesetimbangan dinamis yaitu : [1]
- Reaksi berlangsung terus-menerus dengan arah yang berlawanan.
- Terjadi pada ruang tertutup, suhu, dan tekanan tetap.
- Kecepatan reaksi ke arah produk (hasil reaksi) sama dengan kecepatan reaksi ke arah reaktan (zat-zat pereaksi).
- Tidak terjadi perubahan makroskopis, yaitu perubahan yang sanggup dilihat, tetapi terjadi perubahan mikroskopis, yaitu perubahan tingkat partikel (tidak sanggup dilihat).
- Setiap komponen tetap ada.
N2O4(g) D 2NO2(g)
Tercapainya kesetimbangan dinamis peruraian N2O4 dapat dilihat pada gambar 1.
Selain teladan di atas, kita sanggup memperhatikan bencana lain yaitu pemanasan air dalam wadah tertutup. Jika air sudah mendidih dan menguap, maka uap air berubah kembali menjadi air. Jika kecepatan terbentuknya uap air sama dengan kecepatan terbentuknya air dari uap air, maka termasuk kesetimbangan dinamis.
Perhatikan reaksi berikut.
Perhatikan reaksi berikut.
H2O(l) D H2O(g)
Suatu reaksi bolak-balik sanggup berlangsung dalam banyak sekali wujud. Berdasarkan wujud zat yang terlibat dalam reaksi, reaksi kesetimbangan dibedakan menjadi dua, yaitu Kesetimbangan Homogen dan Heterogen.
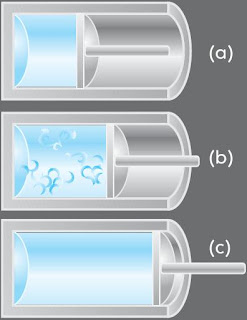
Suatu gas yang ditahan oleh sebuah piston di dalam sebuah silinder.
Proses perluasan gas yang irreversible (reaksi satu arah) yaitu sebagai berikut.
a) Keadaan awal dengan volume V1.
b) Gas tidak berada dalam kesetimbangan disebabkan turbulensi, tekanan, dan suhu tidak sanggup ditentukan.
c) Keadaan simpulan dengan volume V2.
(Sumber : Oxtoby, 2001, hlm. 191)
Kesetimbangan reaksi banyak terjadi dalam badan organisme sehingga organisme tersebut sanggup hidup dengan baik. Misalnya, keasaman dan kebasaan darah dipertahankan dalam batas tertentu oleh beberapa reaksi yang berlawanan. Selain itu, kesetimbangan reaksi juga dilibatkan dalam proses fotosintesis pada tumbuhan. (Keenan, dkk., 1998, hlm. 556)
Dalam sistem terbuka (di alam sekitar kita) terjadi kesetimbangan kimia (reaksi bolak-balik/dua arah/reversibel), yaitu proses siklus oksigen, siklus air, dan siklus nitrogen. Dengan adanya kesetimbangan kimia (reaksi reversibel/dua arah), maka makhluk hidup tidak kehabisan oksigen untuk bernapas dan tidak kehabisan air untuk keperluan sehari-hari. [1]
Anda kini sudah mengetahui Kesetimbangan Dinamis. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Premono, S. A. Wardani, dan N. Hidayati. 2009. Kimia : SMA/ MA Kelas XI. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 282.
Referensi Lainnya :
[1] Utami, B. A. Nugroho C. Saputro, L. Mahardiani, S. Yamtinah, dan B. Mulyani. 2009. Kimia 2 : Untuk SMA/MA Kelas XI, Program Ilmu Alam. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 274.
Suatu gas yang ditahan oleh sebuah piston di dalam sebuah silinder.
Proses perluasan gas yang irreversible (reaksi satu arah) yaitu sebagai berikut.
a) Keadaan awal dengan volume V1.
b) Gas tidak berada dalam kesetimbangan disebabkan turbulensi, tekanan, dan suhu tidak sanggup ditentukan.
c) Keadaan simpulan dengan volume V2.
(Sumber : Oxtoby, 2001, hlm. 191)
Kesetimbangan reaksi banyak terjadi dalam badan organisme sehingga organisme tersebut sanggup hidup dengan baik. Misalnya, keasaman dan kebasaan darah dipertahankan dalam batas tertentu oleh beberapa reaksi yang berlawanan. Selain itu, kesetimbangan reaksi juga dilibatkan dalam proses fotosintesis pada tumbuhan. (Keenan, dkk., 1998, hlm. 556)
Dalam sistem terbuka (di alam sekitar kita) terjadi kesetimbangan kimia (reaksi bolak-balik/dua arah/reversibel), yaitu proses siklus oksigen, siklus air, dan siklus nitrogen. Dengan adanya kesetimbangan kimia (reaksi reversibel/dua arah), maka makhluk hidup tidak kehabisan oksigen untuk bernapas dan tidak kehabisan air untuk keperluan sehari-hari. [1]
Anda kini sudah mengetahui Kesetimbangan Dinamis. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Premono, S. A. Wardani, dan N. Hidayati. 2009. Kimia : SMA/ MA Kelas XI. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 282.
Referensi Lainnya :
[1] Utami, B. A. Nugroho C. Saputro, L. Mahardiani, S. Yamtinah, dan B. Mulyani. 2009. Kimia 2 : Untuk SMA/MA Kelas XI, Program Ilmu Alam. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 274.
No comments:
Post a Comment