Tabel Sistem Periodik Unsur Lengkap, Sejarah Perkembangan, Pengertian, Periode dan Golongan, Sifat Unsur, Contoh Soal, Pembahasan, Praktikum Kimia - Sampai ketika ini, sudah dikenal 118 macam unsur dengan sifat yang khas untuk setiap unsur. Jika unsur-unsur itu tidak disusun secara tepat maka akan mengalami kesukaran dalam mempelajari sifat-sifatnya. Oleh sebab itu, semenjak dulu para ilmuwan berusaha menggolongkan unsur-unsur berdasarkan sifat-sifatnya. Bagaimanakah unsur-unsur disusun dalam sistem periodik? Apakah yang dimaksud dengan sistem periodik unsur? Bagaimanakah perkembangan dari penyusunan sistem periodik? Anda akan mengetahui jawabannya jikalau Anda pelajari uraian yang disajikan pada penggalan ini.
A. Sejarah Perkembangan Sistem Periodik
Sistem periodik ialah suatu tabel berisi identitas unsur-unsur yang dikemas secara terpola dalam bentuk periode dan golongan berdasarkan kemiripan sifat-sifat unsurnya.
1.1. Sistem Periodik Klasik
Ilmuwan pertama yang membuatkan sistem periodik unsur adalah Johan W. Dobereiner. Sistem periodik unsur-unsur yang dikembangkannya didasarkan pada nomor massa atom. Menurut Dobereiner, jikalau nomor massa atom unsur A ditambah nomor massa atom unsur B, kemudian dirataratakan maka akan dihasilkan nomor massa atom unsur C. Ketiga unsur ini akan mempunyai sifat yang mirip. Kelompok unsur tersebut oleh Dobereiner dinamakan triade.
Contoh :
Massa atom Cl = 35
Massa atom I = 127
Massa atom Br = (35 + 127) = 81
Massa atom Br = (35 + 127) = 81
Jadi, sifat unsur bromin akan mirip dengan unsur klorin dan iodin.
Pada perkembangan berikutnya, John Newland menemukan hubungan antara sifat unsur dan massa atom berdasarkan pola tertentu. Jika unsur-unsur dideretkan berdasarkan kenaikan nomor massa atom maka unsur kedelapan mempunyai sifat mirip dengan unsur pertama. Pola ini dinamakan Hukum Oktaf. Namun, pada perkembangan selanjutnya ditemukan beberapa unsur yang tidak sesuai dengan Hukum Oktaf, misalnya: Cr tidak mirip dengan Al ; Mn tidak mirip dengan P ; Fe tidak mirip dengan S; dan yang lainnya.
Catatan :
1 | 2 | 3 | 4 | 5 | 6 | 7 |
Li | Be | B | C | N | O | F |
Na | Mg | Al | Si | P | S | Cl |
K | Ca | Cr | - | Mn | Fe |
Jerman, Lothar Meyer, menyusun tabel periodik unsur-unsur secara terpisah di setiap negaranya. Sistem periodik Mendeleev didasarkan pada nomor massa atom, sedangkan sistem periodik Meyer didasarkan pada massa jenis atom. Walaupun dasar penggolongan sistem periodik berbeda, tetapi hasilnya hampir sama. Mendeleev menyusun sistem periodik unsur-unsur dengan cara menempatkan unsur-unsur ke dalam bentuk baris dan kolom.
Unsur-unsur dalam kolom yang sama ini mempunyai sifat-sifat yang mirip. Unsur yang terdapat di bawah aluminium disebut eka-aluminium dengan lambang Ea. Menurut Mendeleev, sifat-sifat unsur ini sanggup diprediksi berdasarkan perbandingan terhadap unsur-unsur tetangganya. Hasil prediksi Mendeleev terhadap unsur eka-aluminium, yaitu nomor massa 68, massa jenis 5,9 g/cm3, titik leleh rendah, titik didih tinggi, dan rumus oksidanya Ea2O3. Sistem periodik Mendeleev sanggup dilihat pada Tabel 1.
Tabel 1. Sistem Periodik Menurut Mendeleev
Periode | Gol.I | Gol.II | Gol.III | Gol.IV | Gol.V | Gol.VI | Gol.VII | Gol.VIII |
1 | H=1 | |||||||
2 | Li=7 | Be=9,4 | B=11 | C= 12 | N=14 | O= 16 | F= 19 | |
3 | Na=23 | Mg=24 | Al=27,3 | Si=28 | P= 31 | S= 32 | Cl= 35,5 | |
4 | K=39 | Ca=40 | – = 44 | –=48 | V= 51 | Cr= 52 | Mn= 55 | Fe= 56; Co= 59 Ni= 59; Cu= 63 |
5 | Cu=63 | Zn=65 | –= 68 | –=72 | As= 75 | Se= 78 | Br= 80 | |
6 | Rb=85 | Sr=87 | Yt=88 | Zr=90 | Nb= 94 | Mo= 96 | –= 100 | Ru=104; Rh=104 Pd=106; Ag=108 |
7 | Ag=108 | Cd=112 | In=113 | Sn=118 | Sb= 122 | Te= 125 | J= 127 | |
8 | Cs=133 | Ba=137 | Di=138 | Ce=140 | – | – | – | – – – – – |
9 | – | – | – | La=180 | – | – | – | Os=195; Ir= 197 |
10 | – | – | Er=178 | Pb= 207 | Ta= 182 | W= 184 | – | Pt=198; Au=199 |
11 | Au=199 | Hg=200 | Tl=204 | Th=231 | Bi= 208 | – | – | – – – – – |
Pada 1874, hebat kimia Prancis, Paul Émile Lecoq de Bois-baudran menemukan unsur galium (perhatikan Gambar 1).
Sifat-sifat unsur galium tidak berbeda dengan eka-aluminium yang diramalkan oleh Mendeleev. Jadi, eka-aluminium tiada lain ialah galium. Sifat galium menurut prediksi Mendeleev ditunjukkan pada Tabel 2.
 |
| Gambar 1. Galium |
Tabel 2. Prediksi Mendeleev pada Unsur Galium
Sifat | Ramalan Eka-Aluminium | Galium yang Ditemukan |
Nomor massa | 68 | 67,7 |
Massa jenis | 5,9 g/ | 5,91 g/ |
Titik leleh | Rendah | 30,1 °C |
Titik didih | Tinggi | 1983 °C |
Keberhasilan Mendeleev dalam memprediksi unsur-unsur yang belum ditemukan waktu itu, menjadikan sistem periodik Mendeleev lebih diterima oleh masyarakat ilmiah dibandingkan sistem periodik yang dikembangkan oleh Lothar Meyer.
Sekilas Kimia
Sekilas Kimia
Dmitri Mendeleev
(1834 -1907)
Kemampuan memprediksi Mendeleev ditunjukkan lagi ketika skandium (eka-boron) ditemukan pada 1879 dan germanium (ekasilikon) ditemukan pada 1886. Kedua unsur itu mempunyai sifat-sifat mirip sesuai ramalan Mendeleev. Kemampuan memprediksi Mendeleev inilah yang menyebabkan sistem periodiknya lebih diterima oleh masyarakat. (Sumber : Jendela IPTEK: Materi, 1997)
Contoh Soal Dasar Pemikiran Disusunnya Tabel Periodik Mendeleev (1) :
Berdasarkan apakah Mendeleev menyusun tabel periodik unsur-unsur? Mengapa sistem periodik dari Mendeleev lebih dikenal daripada model Lothar Meyer?
Pembahasan :
Dasar yang digunakan Mendeleev menyusun tabel periodik unsur-unsur ialah kenaikan nomor massa atom. Kemampuan prediksi Mendeleev menjadikan tabel periodik yang disusunnya lebih dikenal masyarakat ilmiah.
1.2. Sistem Periodik Modern
Bentuk sistem periodik modern ialah berupa tabel panjang yang dimodifikasi dengan cara mengeluarkan dua deret unsur-unsur yang tergolong unsur-unsur transisi dalam, yaitu unsur-unsur dimulai dengan nomor atom 58 hingga 71 (golongan lantanida) dan nomor atom 90 sampai 103 (golongan aktinida).
Baca juga : Sistem Periodik Meyer, Sistem Periodik Moseley dan Sistem periodik Lavoisier.
Baca juga : Sistem Periodik Meyer, Sistem Periodik Moseley dan Sistem periodik Lavoisier.
Dalam sistem periodik modern, unsur-unsur disusun menurut kenaikan nomor atom, bukan nomor massanya dan disusun ke dalam periode dan golongan. Terdapat 7 periode dan 18 golongan. Periode 1 dihuni 2 unsur; periode 2 dan 3 dihuni 8 unsur; periode 4 dan 5 dihuni 18 unsur; periode 6 dan 7 dihuni 32 unsur. Oleh lantaran terlalu panjang maka pada periode 6 dan 7, unsur dengan nomor atom 58–71 dan 90–103 dikeluarkan dari tabel dan ditempatkan di bawah tabel (perhatikan Gambar 2).
Setiap kolom dalam tabel periodik modern mengandung informasi tentang lambang unsur, nomor atom, nomor massa, wujud, dan informasi lainnya, mirip ditunjukkan pada sistem periodik unsur-unsur berikut.
 |
 |
| Gambar 2. Tabel periodik dan informasi kolom yang penting |
B. Pengertian dan Perbedaan Periode dan Golongan
Periode berisi unsur-unsur dalam baris horizontal. Golongan berisi unsur-unsur dengan kolom vertikal. Dalam tabel periodik modern, golongan diberi label. Label yang digunakan ada yang mengikuti aturan lama, ada juga yang mengikuti hukum gres (IUPAC). Menurut aturan lama, nomor golongan ditandai dengan angka romawi diikuti karakter A dan B, sedangkan berdasarkan hukum IUPAC menyarankan golongan dinomori mulai dari angka 1 hingga angka 18.
Contoh :
Unsur-unsur pada kolom ke-13, berdasarkan hukum usang diberi nomor IIIA, sedangkan berdasarkan IUPAC diberi nomor 13. Unsur-unsur golongan A disebut unsur-unsur utama dan unsur-unsur golongan B disebut unsur-unsur transisi, atau transisi deret pertama. Dua baris yang diletakkan di bawah tabel dinamakan unsur-unsur transisi dalam (golongan aktinida dan lantanida).
Pada tabel periodik modern, unsur-unsur sanggup digolongkan ke dalam logam, bukan logam, dan semi-logam (metalloid). Penggolongannya dapat dipahami dengan gampang dengan memerhatikan skema Gambar 3. yang menampilkan beberapa unsur utama. Unsur-unsur logam berada dalam golongan IA hingga IIIA dan unsur transisi, unsur-unsur bukan logam berada dalam golongan VA sampai VIIIA. Adapun golongan IVA dengan arah diagonal ke kanan bawah, umumnya semi-logam.
Contoh Soal Menentukan Golongan dan Periode Unsur-Unsur (2) :
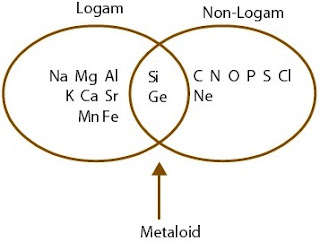 |
| Gambar 3. Pengelompokan unsur-unsur dalam tabel periodik modern |
a. Dalam kata 'CInTa' terdapat berapa macam unsur dan berada pada golongan serta periode berapa?
b. Susun satu kalimat dari unsur-unsur yang ada dalam golongan dan periode berikut:
• golongan IA, periode 2 dan 3;
• golongan IIA, periode 4;
• golongan VA, periode 2;
• golongan golongan, IVB periode 4; dan
• golongan IA, periode 4.
Penyelesaian :
a. Dalam kata CInTa terdapat 3 unsur, yaitu C (karbon), In (indium), dan Ta (tantalum). Masing-masing terdapat dalam golongan dan periode:
C = IVA atau 14, periode 2
In = IIIA atau 13, periode 5
Ta = VB atau 5; periode 6
b. Li, Na, Ca, N, Ti, K
Jadi, susunan kalimatnya ialah LiNa CaNTiK.
Catatan :
IUPAC (International Unions of Pure and Applied Chemistry) ialah suatu organisasi kimia dunia yang menetapkan banyak sekali hukum dan kebijakan terkait perihal Ilmu Kimia.
C. Sistem Periodik dan Konfigurasi Elektron
Dalam tabel periodik modern, unsur-unsur dalam satu golongan memiliki sifat-sifat yang mirip, demikian pula dalam satu periode memiliki sifat-sifat beraturan. Mengapa demikian? Kemiripan dan keteraturan sifat-sifat unsur dalam tabel periodik ada kaitannya dengan konfigurasi elektron atom dari unsur-unsur itu.
3.1. Periode dan Konfigurasi Elektron
Adakah relasi antara jumlah unsur yang terdapat dalam tiap periode dan konfigurasi elektronnya? Jika Anda simak tabel periodik pada baris mendatar kemudian dihubungkan dengan jumlah elektron dalam setiap lintasan atau orbit, tentu Anda akan memperoleh kesimpulan sebagai berikut.
- Jumlah unsur dalam periode 1 menyatakan jumlah maksimum elektron yang menghuni orbit ke-1, yaitu 2 macam unsur.
- Jumlah unsur dalam periode 2 menyatakan jumlah maksimum elektron yang menghuni orbit ke-2, yaitu 8 unsur.
Contoh :
Jumlah elektron maksimum yang sanggup menghuni orbit-1 (n = 1) ialah 2 elektron sehingga jumlah unsur yang terdapat dalam periode 1 ialah 2 macam. Demikian juga pada orbit ke-2 (n=2) dapat dihuni maksimum oleh 8 elektron sehingga jumlah unsur pada periode 2 ialah 8 macam.
Pertanyaan selanjutnya ialah adakah relasi antara posisi unsur-unsur dalam periode dan konfigurasi elektronnya? Untuk menemukan jawabannya, Anda sanggup menghubungkannya dengan kedudukan elektron valensi dari atom unsur itu. Jika elektron valensi berada dalam orbit ke-3 maka unsur yang bersangkutan akan menghuni periode 3.
3.2. Golongan dan Konfigurasi Elektron
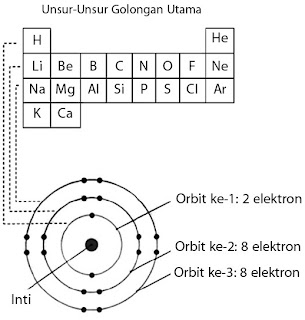 |
| Gambar 4. Hubungan jumlah elektron maksimum dalam setiap orbit dengan jumlah unsur dalam satu periode pada tabel periodik |
Pertanyaan selanjutnya ialah apakah ada relasi antara golongan dalam tabel periodik dan konfigurasi elektron?
Untuk menemukan jawaban tersebut, kembangkan oleh Anda konfigurasi elektron unsur-unsur, contohnya golongan IA (H, Na, K) dan golongan IIA (Be, Mg, Ca), kemudian temukan kesamaannya pada setiap golongan. Selanjutnya, hubungkan oleh Anda kesamaan konfigurasi elektron dalam setiap golongan dengan nomor golongan, contohnya IA, IIA, IIIA, dan seterusnya.
Contoh Soal Hubungan Tabel Periodik dan Konfigurasi Elektron (3) :
a. Pada periode dan golongan berapakah suatu unsur mempunyai jumlah elektron 8?
b. Pada periode dan golongan berapakah suatu unsur mempunyai jumlah elektron 14?
Kunci Jawaban :
a. Konfigurasi elektronnya ialah 2 6.
Jadi, unsur tersebut akan berada pada periode ke-2 dan golongan VIA.
b. Konfigurasi elektronnya ialah 2 8 4
Jadi, unsur tersebut berada pada periode ke-3 dan golongan IVA.
D. Beberapa Sifat Periodik Unsur
Unsur-unsur dalam golongan yang sama mempunyai elektron valensi yang sama. Demikian pula unsur-unsur pada periode yang sama, elektron valensinya menghuni orbit yang sama. Oleh lantaran sifat-sifat unsur ada hubungannya dengan konfigurasi elektron maka unsur-unsur dalam golongan yang sama akan mempunyai sifat yang mirip dan dalam periode yang sama akan memperlihatkan sifat yang khas secara terpola (periodik) dari logam ke nonlogam. Beberapa sifat periodik unsur di antaranya adalah jari-jari atom, afinitas elektron, energi ionisasi, dan keelektronegatifan.
4.1. Jari-jari Atom
Jari-jari atom sangat kecil, diduga diameternya sekitar 10–10 m. Satuan yang biasa digunakan untuk menyatakan jari-jari atom ialah angstrom (Å). Satu angstrom sama dengan 10–10 m.
Tabel 3. Jari-Jari Atom Menurut Golongan (dalam satuan pm)
Golongan | Unsur | Jari-Jari | ||
Atom | Kation | Muatan | ||
IA | Li Na K Rb | 135 154 196 211 | 60 95 133 148 | +1 +1 +1 +1 |
IIA | Be Mg Ca | 90 130 174 | 31 65 99 | +2 +2 +2 |
IIIA | Al Ga In | 143 122 162 | 50 62 81 | +3 +3 +3 |
VIIA | F Cl Br I | 64 114 133 | 136 181 195 216 | –1 –1 –1 –1 |
VIA | O S Se | 66 104 117 | 140 184 198 | –2 –2 –2 |
VA | N P As | 70 110 125 | 171 212 – | –3 –3 – |
Sumber: Chemistry with Inorganic Quantitative Analysis, 1989 | ||||
Jari-jari atom didefinisikan sebagai setengah jarak antara dua inti atom yang berikatan dalam wujud padat (perhatikan Gambar 5).
Hasil pengukuran ditunjukkan pada Tabel 3. Jika Anda perhatikan Tabel 3. maka akan terlihat adanya keteraturan jari-jari, baik dalam golongan yang sama maupun dalam periode yang sama.
 |
| Gambar 5. Jari-jari atom |
Perhatikanlah jari-jari atom dari atas ke bawah dalam golongan yang sama. Apakah yang sanggup Anda simpulkan mengenai jari-jari atom dalam golongan yang sama? Bertambahnya jari-jari atom dari atas ke bawah dalam golongan yang sama disebabkan bertambahnya orbit (lintasan) elektron. Bertambahnya orbit mengakibatkan volume atom mengembang sehingga jari-jari atom meningkat.
Perhatikanlah jari-jari atom dari kiri ke kanan dalam periode yang sama. Apakah yang sanggup Anda simpulkan mengenai jari-jari atom dalam periode yang sama?
Catatan :
Konversi satuan panjang :
sentimeter (cm) | 10-2 m |
milimeter (mm) | 10-3 m |
mikrometer (μm) | 10-6 m |
nanometer (nm) | 10-9 m |
angstrom (Å) | 10-10 m |
pikometer (pm) | 10-12 m |
femtometer (fm) | 10-15 m |
attometer (am) | 10-18 m |
Penurunan jari-jari atom dari kiri ke kanan dalam periode yang sama disebabkan bertambahnya jumlah proton di dalam inti atom, sedangkan jumlah orbitnya sama. Dengan bertambahnya jumlah proton, tarikan inti
terhadap elektron valensi makin berpengaruh sehingga terjadi pengerutan volume atom. Akibatnya, jari-jari atom dari kiri ke kanan mengecil (perhatikan Gambar 6).
Contoh Soal Menentukan Kecenderungan Jari-Jari Atom (4) :
 |
| Gambar 6. Jari-jari atom dipengaruhi oleh jumlah proton dalam inti. |
Urutkan unsur-unsur berikut berdasarkan kenaikan jari-jarinya: Na, K, Mg, dan Ca. Jelaskan alasannya.
Pembahasan :
Na dan K berada dalam golongan yang sama, tetapi atom K mempunyai orbit terluar lebih jauh dari inti sehingga jari-jari atom K lebih panjang daripada Na. Demikian pula atom Mg dan Ca, dengan jari-jari atom Ca lebih panjang dari Mg. Na dan Mg berada pada periode yang sama dan jari-jari atom Na lebih panjang dari Mg lantaran muatan inti atom Mg (ditunjukkan oleh naiknya nomor atom) lebih besar daripada Na. Demikian pula atom K dan Ca, dengan jari-jari atom K lebih panjang dari Ca.
Dengan demikian, sanggup disimpulkan bahwa urutan kenaikan jari-jari atom adalah Mg < Na < Ca < K.
Contoh Soal Ebtanas 1995–1996 :
Manakah di antara penyataan di bawah ini yang bukan merupakan sifat periodik unsur-unsur?
A. Dari atas ke bawah dalam satu golongan energi ionisasi makin kecil.
B. Dari kiri ke kanan dalam satu periode afinitas elektron makin besar.
C. Dari atas ke bawah dalam satu golongan jari-jari atom makin besar.
D. Dari kiri ke kanan dalam satu periode keelektronegatifan makin besar.
E. Dari kiri ke kanan dalam satu periode titik didih makin tinggi.
Pembahasan :
Jawaban (A), (B), (C), dan (D) ialah sifat-sifat periodik unsur. Jadi, jawabannya ialah (E).
Contoh Soal Ebtanas 1995–1996 :
Manakah di antara penyataan di bawah ini yang bukan merupakan sifat periodik unsur-unsur?
A. Dari atas ke bawah dalam satu golongan energi ionisasi makin kecil.
B. Dari kiri ke kanan dalam satu periode afinitas elektron makin besar.
C. Dari atas ke bawah dalam satu golongan jari-jari atom makin besar.
D. Dari kiri ke kanan dalam satu periode keelektronegatifan makin besar.
E. Dari kiri ke kanan dalam satu periode titik didih makin tinggi.
Pembahasan :
Jawaban (A), (B), (C), dan (D) ialah sifat-sifat periodik unsur. Jadi, jawabannya ialah (E).
4.2. Energi Ionisasi
Energi ionisasi ialah energi yang diharapkan untuk mengeluarkan elektron valensi dari suatu atom atau ion dalam wujud gas.
Na(g) → Na+(g) + e–
Na(g) → Na+(g) + e–
Nilai energi ionisasi bergantung pada jarak elektron valensi terhadap inti atom. Makin jauh jarak elektron valensi terhadap inti atom, makin lemah tarikan inti terhadap elektron sehingga energi ionisasi makin kecil. Nilai energi ionisasi unsur-unsur utama ditunjukkan pada Gambar 7. yang digambarkan secara grafik.
Pada periode yang sama, dari kiri ke kanan jari-jari atom relatif tetap, tetapi muatan inti bertambah. Hal ini mengakibatkan tarikan inti terhadap elektron valensi makin besar. Bagaimanakah kecenderungan energi ionisasi jikalau diurutkan dari kiri ke kanan pada periode yang sama?
 |
| Gambar 7. Grafik energi ionisasi pertama unsur-unsur golongan utama. |
Selain muatan inti atom, energi ionisasi juga dipengaruhi oleh konfigurasi elektron, terutama konfigurasi elektron dengan jumlah elektron valensi sebanyak 8 (golongan VIIIA, gas mulia). Perhatikan grafik pada Gambar 7, pada setiap periode, energi ionisasi terbesar dimiliki oleh unsur-unsur gas mulia (He, Ne, Ar, Kr, dan Xe). Unsurunsur gas mulia ialah teladan unsur-unsur paling stabil. Kestabilan ini disebabkan atom-atom gas mulia mempunyai elektron valensi paling banyak (8 elektron). Oleh lantaran itu, untuk mengeluarkan elektron valensi dari atom gas mulia memerlukan energi ionisasi yang sangat besar.
Contoh Soal Menentukan Kecenderungan Energi Ionisasi (5) :
Urutkan atom-atom berikut: Na, Mg, K, dan Ca berdasarkan kenaikan energi ionisasinya, kemudian jelaskan alasannya.
Pembahasan :
Pada periode yang sama, dari kiri ke kanan energi ionisasi bertambah akibat bertambahnya muatan inti. Jadi, energi ionisasi Mg lebih besar dari Na. Demikian pula energi ionisasi Ca lebih besar dari K. Dalam golongan yang sama, dari atas ke bawah energi ionisasi berkurang tanggapan orbit elektron makin jauh dari inti. Jadi, energi ionisasi Na lebih besar dari K dan energi ionisasi Mg lebih besar dari Ca. Dengan demikian, sanggup disimpulkan bahwa urutan energi ionisasi ialah K < Na < Ca < Mg.
Praktikum Kimia Kaitan antara Konfigurasi Elektron, Golongan, Periode, dan Energi Ionisasi dalam Tabel Periodik (1) :
Tujuan :
Menyelidiki kaitan antara konfigurasi elektron dan unsur-unsur dalam tabel periodik.
Langkah Kerja :
1. Pelajari dan lengkapilah tabel berikut.
2. Pelajari dan lengkapilah tabel berikut.
Pertanyaan :
Praktikum Kimia Kaitan antara Konfigurasi Elektron, Golongan, Periode, dan Energi Ionisasi dalam Tabel Periodik (1) :
Tujuan :
Menyelidiki kaitan antara konfigurasi elektron dan unsur-unsur dalam tabel periodik.
Langkah Kerja :
1. Pelajari dan lengkapilah tabel berikut.
Unsur | Nomor Atom | Konfigurasi Elektron | Golongan | Periode |
C | 6 | 2 4 | IV | 2 |
Si | 14 | ... | ... | ... |
Ge | 32 | ... | ... | ... |
Sn | 50 | ... | ... | ... |
Pb | 82 | ... | ... | 6 |
2. Pelajari dan lengkapilah tabel berikut.
Unsur | Nomor Atom | Konfigurasi Elektron | Golongan | Periode |
Y | 39 | 2 8 18 11 | IIIB | 5 |
Zr | 40 | ... | ... | 5 |
Nb | 41 | ... | ... | ... |
Mo | 42 | ... | ... | ... |
Tc | 43 | ... | ... | ... |
Pertanyaan :
- Bagaimanakah kaitannya antara jumlah elektron valensi dan nomor golongan?
- Bagaimanakah kaitan antara orbit yang ditempati elektron valensi dan nomor periode?
- Dari hasil pengamatan, ramalkan kecenderungan jari-jari atom tersebut dalam periode dan golongan yang sama.
- Ramalkan pula kecenderungan energi ionisasi atom tersebut dalam periode dan golongan yang sama.
4.3. Afinitas Elektron
Afinitas elektron ialah perubahan energi atom ketika elektron ditambahkan kepada atom itu dalam keadaan gas. Contoh:
Cl(g) + e– → cl–(g)
Berbeda dengan energi ionisasi, afinitas elektron sanggup berharga positif atau negatif. Jika satu elektron ditambahkan kepada atom yang stabil dan sejumlah energi diserap maka afinitas elektronnya berharga positif. Jika dilepaskan energi, afinitas elektronnya berharga negatif.
Tabel 4. Afinitas Elektron Unsur-Unsur Golongan Utama
IA | IIA | IIIA | IVA | VA | VIA | VIIA | VIIIA |
H = –73 | Be = 240 | B = 83 | C = 123 | N = 0,0 | O = 141 | F = 322 | He = 21 |
Li = –60 | Mg = 230 | Al = 50 | Si = 120 | P = 74 | S = 200 | Cl = 349 | Ne = 29 |
Na = –53 | Ca = 156 | Ga = 36 | Ge= 116 | As = 77 | Se= 195 | Br = 325 | Ar = 35 |
K = –48 | Sr = 168 | In = 34 | Sn= 121 | Sb= 101 | Te= 183 | I = 295 | Kr = 39 |
Rb = –47 | Ba = 52 | Tl = 50 | Pb= 101 | Bi = 101 | Po= 270 | At = 270 | Xe = 41 |
Secara umum, nilai afinitas elektron dalam golongan yang sama dari atas ke bawah menurun, sedangkan pada periode yang sama dari kiri ke kanan meningkat. Nilai afinitas elektron umumnya sejalan dengan jari-jari atom. Makin kecil jari-jari atom, nilai afinitas elektron makin tinggi. Sebaliknya, makin besar jari-jari atom, nilai afinitas elektron kecil.
Contoh Soal Menentukan Kecenderungan Afinitas Elektron (6) :
Urutkan atom-atom berikut berdasarkan kenaikan afinitas elektronnya: S, Cl, dan P.
Penyelesaian :
Afinitas elektron ialah perubahan energi ketika atom mendapatkan elektron. Pada periode yang sama, dari kiri ke kanan dalam tabel periodik, afinitas elektron umumnya meningkat. Jadi, sanggup disimpulkan bahwa afinitas elektron untuk P < S < Cl.
4.4. Keelektronegatifan Atom
Keelektronegatifan didefinisikan sebagai kecenderungan suatu atom dalam molekul untuk menarik pasangan elektron yang digunakan pada ikatan ke arah atom bersangkutan. Skala keelektronegatifan yang digunakan sampai sekarang ialah yang dikembangkan oleh Pauling lantaran lebih lengkap dibandingkan skala keelektronegatifan yang lain. Pauling memberikan skala keelektronegatifan 4 untuk unsur yang mempunyai energi ionisasi dan energi afinitas elektron tinggi, yaitu pada unsur florin, sedangkan unsur-unsur lainnya di bawah nilai 4.
Tabel 5. Keelektronegatifan Beberapa Unsur Menurut Golongan dan Periode pada Tabel Periodik
Pada tabel periodik, unsur florin yang ditetapkan mempunyai keelektronegatifan 4 (terbesar) berada di ujung kanan paling atas. Adapun Unsur fransium yang mempunyai keelektronegatifan terendah yaitu 0,7 berada di kiri paling bawah dalam tabel periodik.
Sekilas Kimia :
Ilmuwan yang terlibat dalam mengembangkan skala keelektronegatifan di antaranya Sanderson, Mulliken, dan Pauling. Keelektronegatifan yang diterima publik ialah dari Pauling sebab didasarkan pada data energi ikatan yang sanggup diukur. (Sumber: dlib.org)
Contoh Soal Menentukan Kecenderungan Skala Keelektronegatifan (1) :
 |
Sekilas Kimia :
Linus Pauling
(1901-1994)
Contoh Soal Menentukan Kecenderungan Skala Keelektronegatifan (1) :
Nomor atom unsur X, Y, dan Z berturut-turut ialah 11, 15, dan 20. Urutkan unsur-unsur tersebut berdasarkan kenaikan skala keelektronegatifannya.
Kunci Jawaban :
Unsur-unsur tersebut berada pada golongan dan periode sebagai berikut :
X: golongan IA dan periode ke-3
Y: golongan VA dan periode ke-3
Z: golongan IIA dan periode ke-4
Berdasarkan data pada Tabel 2.5, skala keelektronegatifan X = Na, Y = P, dan Z = Ca.
Jadi, urutan skala keelektronegatifannya ialah X < Z < Y.
E. Sifat-Sifat Unsur
Unsur-unsur utama (IA – VIIIA) dalam golongan yang sama memiliki konfigurasi elektron valensi yang sama. Akibatnya, unsur-unsur tersebut memiliki kecenderungan sifat-sifat kimia dan fisika yang mirip, seperti sifat logam, bukan logam, muatan ion, dan kemampuan bereaksi.
5.1. Unsur-Unsur Golongan IA
Unsur-unsur golongan IA disebut juga unsur-unsur logam alkali. Unsur-unsur golongan alkali semuanya bersifat logam yang sangat reaktif. Kereaktifan unsur-unsur alkali disebabkan mempunyai energi ionisasi kecil sehingga cenderung melepaskan elektron valensinya dan membentuk suatu kation bermuatan +1. Beberapa sifat unsur golongan IA sanggup dilihat pada Tabel 6.
Tabel 6. Sifat-Sifat Fisik Unsur Golongan IA
Sifat | Li | Na | K | Rb | Cs |
Titik leleh (°C) | 181 | 97,8 | 63,6 | 38,9 | 28,4 |
Titik didih (°C) | 1347 | 883 | 774 | 688 | 678 |
Massa jenis (g/cm3) | 0,53 | 0,97 | 0,86 | 1,53 | 1,88 |
Sumber: General Chemistry (Ebbing), 1990 | |||||
Semua unsur alkali berwarna putih, contohnya perak. Pada suhu kamar, semua unsur alkali berwujud padat kecuali cesium berwujud cair. Natrium adalah logam bersifat lunak sehingga sanggup dipotong dengan pisau. Kalium lebih lunak dari natrium. Logam litium, natrium, dan kalium mempunyai massa jenis kurang dari 1,0 g/cm3. Akibatnya, ketiga logam tersebut terapung di atas air, tetapi ketiga logam ini sangat reaktif terhadap air dan bereaksi sangat dahsyat yang disertai nyala api (perhatikan Gambar 8).
bawah dalam tabel periodik. Sepotong logam litium jikalau ditambahkan ke dalam air akan bereaksi dengan air disertai nyala api. Kalium bereaksi lebih dahsyat disertai ledakan dan nyala berwarna ungu. Logam alkali bereaksi dengan oksigen dari udara membentuk oksida logam alkali, seperti Li2O (litium oksida), Na2O2 (natrium peroksida), dan KO2 (kalium superoksida). Li2O padatan berwarna putih, Na2O2 padatan berwarna putih-kekuningan, dan KO2 berwarna kuning-jingga.
Ketika dibakar di udara, semua logam alkali menghasilkan nyala dengan warna yang karakteristik. Uji nyala sanggup digunakan untuk mengidentifikasi keberadaan senyawa yang tidak diketahui. Warna yang dihasilkan oleh unsur-unsur golongan IA disebutkan dalam Tabel 7.
 |
| Gambar 8. Logam alkali sangat reaktif dalam air |
 |
| Gambar 9. Uji nyala pada logam alkali. |
Tabel 7. Warna Nyala Unsur Logam Alkali
Unsur | Warna Nyala |
Litium | Merah Jingga |
Natrium | Kuning keemasan |
Kalium | Ungu |
Rubidium | Merah |
Cesium | Biru |
Contoh Soal UMPTN 1998/B :
Sifat-sifat berikut yang bukan merupakan sifat logam alkali ialah …
A. merupakan unsur sangat reaktif
B. terdapat dalam keadaan bebas di alam
C. ionnya bermuatan positif satu
D. senyawanya gampang larut dalam air
E. bereaksi dengan oksigen di udara
Pembahasan :
Logam alkali sangat reaktif sehingga tidak terdapat dalam keadaan bebas di alam. Jadi, jawabannya ialah (B).
5.2. Unsur-Unsur Golongan IIA
Sifat-sifat berikut yang bukan merupakan sifat logam alkali ialah …
A. merupakan unsur sangat reaktif
B. terdapat dalam keadaan bebas di alam
C. ionnya bermuatan positif satu
D. senyawanya gampang larut dalam air
E. bereaksi dengan oksigen di udara
Pembahasan :
Logam alkali sangat reaktif sehingga tidak terdapat dalam keadaan bebas di alam. Jadi, jawabannya ialah (B).
5.2. Unsur-Unsur Golongan IIA
Unsur-unsur golongan IIA disebut juga logam alkali tanah. Unsur-unsur ini cukup reaktif, tetapi kurang reaktif jikalau dibandingkan dengan unsur-unsur logam alkali. Logam alkali tanah mempunyai energi ionisasi yang cukup rendah sehingga gampang melepaskan kedua elektron valensinya membentuk kation bermuatan positif +2.
Tabel 8. Sifat-Sifat Fisika dan Kimia Unsur Golongan IIA
Sifat | Be | Mg | Ca | Sr | Ba |
Titik leleh (°C) | 1278 | 649 | 839 | 769 | 725 |
Titik didih (°C) | 2970 | 1090 | 1484 | 1384 | 1640 |
Massa jenis (g/cm3) | 1,85 | 1,74 | 1,54 | 2,6 | 3,51 |
Keelektronegatifan | 1,5 | 1,2 | 1,0 | 1,0 | 0,9 |
Sumber: General Chemistry (Ebbing), 1990 | |||||
Berilium merupakan logam berwarna bubuk dan bersifat keras menyerupai besi sehingga cukup berpengaruh untuk menggores kaca. Unsur logam alkali tanah yang lain berupa logam berwarna perak dan lebih lunak dari berilium, tetapi masih lebih keras dibandingkan logam alkali. Berilium kurang reaktif terhadap air. Magnesium bereaksi agak lambat pada suhu kamar, tetapi lebih cepat jikalau dengan uap air. Kalsium bereaksi cepat dengan air. Logam alkali tanah bereaksi dengan oksigen membentuk oksida logam.
Pembakaran unsur-unsur alkali tanah mengemisikan spektrum warna yang khas. Nyala stronsium berwarna krimson, barium berwarna hijau kuning, dan magnesium memperlihatkan nyala terang. Oleh lantaran itu, garam-garam alkali tanah sering digunakan sebagai materi kembang api.
5.3. Aluminium
Aluminium berada dalam golongan IIIA pada sistem periodik dengan konfigurasi elektron 2 8 3. Oleh lantaran mempunyai 3 elektron valensi maka aluminium sanggup membentuk kation bermuatan +3. Beberapa sifat aluminium ditunjukkan pada Tabel 9.
Tabel 9 Sifat Fisika dan Kimia Aluminium
Titik leleh (°C) | Titik didih (°C) | Massa jenis (g/cm3) | Keelektronegatifan |
660 | 2.450 | 2,70 | 1,6 |
Sumber: Foundations of Chemistry,1996 | |||
Di alam aluminium terdapat sebagai oksidanya. Corundum ialah mineral keras yang mengandung aluminium oksida, Al2O3. Oksida aluminium murni tak berwarna, tetapi tanggapan adanya pengotor sanggup menghasilkan berbagai warna, mirip safir (berwarna biru) dan ruby (merah tua) (perhatikan Gambar 10).
Aluminium sanggup bereaksi dengan gas klorin membentuk aluminium klorida, AlCl3. Aluminium klorida sanggup membentuk polimer yang disebut polialuminium klorida (PAC). Senyawa ini banyak digunakan untuk menjernihkan air.
 |
| Gambar 10. Permata ruby dan safir |
5.4. Karbon dan Silikon
Karbon dan silikon berada dalam golongan IVA dengan masing-masing konfigurasi elektronnya C = 2 4 dan Si = 2 8 4. Kedua unsur ini cenderung membentuk ikatan kovalen. Karbon berbentuk kristal mirip grafit dan intan, ada juga yang nonkristalin (amorf). Grafit bersifat lunak, berwarna hitam mengkilap dengan struktur berlapis, dan sanggup menghantarkan listrik (konduktor). Intan merupakan padatan berikatan kovalen paling keras, tidak berwarna dan transparan terhadap cahaya, tetapi intan tidak sanggup menghantarkan arus listrik (insulator). Perbedaan intan dan grafit ditunjukkan oleh bentuk strukturnya. Intan membentuk struktur jaringan tiga dimensi, yaitu setiap atom karbon terikat secara kovalen oleh empat atom karbon lain.
Karbon yang berupa amorf ialah arang dan karbon hitam. Kedua jenis karbon ini mempunyai struktur mirip grafit, perbedaannya terletak pada tumpukan lapisan. Lapisan pada grafit beraturan, sedangkan pada karbon amorf tidak beraturan (perhatikan Gambar 11).
Catatan :
Kristal ialah bentuk struktur dari suatu zat yang mempunyai keteraturan tinggi. Kebalikannya ialah amorf (tidak beraturan).
5.5. Nitrogen, Oksigen, dan Belerang
Nitrogen berada dalam golongan VA sistem periodik dengan konfigurasi elektron 2 5, oksigen dan sulfur berada dalam golongan VIA dengan konfigurasi elektron masing-masing 2 6 dan 2 8 6. Nitrogen dan oksigen berupa gas diatom, sedangkan sulfur berupa zat padat dengan rumus molekul S8. Beberapa sifat nitrogen, oksigen, dan belerang ditunjukkan pada Tabel 10.
Tabel 10. Sifat-Sifat Fisika dan Kimia Unsur Nitrogen, Oksigen, dan Belerang
Sifat-Sifat | N | O | S |
Titik leleh (°C) | –210 | –218 | 113 |
Titik didih (°C) | –196 | –183 | 445 |
Massa jenis (g/cm3) | 0,0013 | 0,002 | 2,07 |
Keelektronegatifan | 3,0 | 3,5 | 2,5 |
Afinitas elektron (kJ mol–1) | 0,70 | 141 | –200 |
Sumber: General Chemistry (Ebbing), 1990 | |||
Pada suhu kamar, nitrogen relatif kurang reaktif lantaran ikatannya kuat. Akan tetapi, pada suhu tinggi nitrogen bereaksi dengan unsurunsur lain, mirip dengan oksigen menghasilkan NO. Oksigen membentuk molekul diatom O2 dan bentuk alotropnya ialah ozon (O3). Oksigen merupakan gas tidak berwarna, tidak berasa, dan berwujud gas pada keadaan normal. Molekul oksigen merupakan gas reaktif dan dapat bereaksi dengan banyak zat, umumnya menghasilkan oksida. Hampir semua logam bereaksi dengan oksigen membentuk oksida logam.
Keadaan stabil dari sulfur ialah bentuk rombik mirip mahkota yang berwarna kuning (perhatikan Gambar 12).
Belerang rombik meleleh pada 113 °C menghasilkan cairan berwarna jingga. Pada pemanasan berlanjut, bermetamorfosis cairan kental berwarna cokelat-merah.
 |
| Gambar 12. Sampel sulfur rombik merupakan alotrop paling stabil dari sulfur. (Wikia.com) |
Pada waktu meleleh, bentuk mahkota pecah menjadi bentuk rantai spiral yang panjang. Kekentalan meningkat tanggapan molekul S8 yang padat berubah menjadi rantai berupa spiral panjang. Pada suhu lebih tinggi dari 200 °C, rantai mulai pecah dan kekentalan menurun. Belerang (S8) bereaksi dengan oksigen menghasilkan sulfur dioksida (SO2) dengan nyala biru yang khas. Oksida yang lain dari sulfur ialah SO3 , tetapi hanya terbentuk dalam jumlah kecil selama pembakaran sulfur dalam udara.
5.6. Halogen
Unsur-unsur yang menempati golongan VIIA dinamakan unsur-unsur halogen, artinya pembentuk garam. Unsur-unsur halogen sangat reaktif sehingga di alam tidak pernah ditemukan dalam keadaan atomnya, tetapi membentuk senyawa dengan banyak sekali unsur maupun dengan unsur sejenis. Semua unsur halogen terdapat sebagai molekul diatom, yaitu F2, Cl2, Br2, dan I2. Fluorin dan klorin berwujud gas, fluorin berwarna kuning pucat, sedangkan klorin berwarna kuning kehijauan. Bromin gampang menguap, cairan dan uapnya berwarna cokelat-kemerahan. Iodin berupa zat padat berwarna hitam mengkilap yang sanggup menyublim menghasilkan uap berwarna ungu.
Unsur-unsur halogen gampang dikenali dari busuk dan warnanya. Halogen umumnya berbau menyengat, terutama klorin dan bromin (bromos, artinya pesing). Kedua gas ini bersifat racun sehingga penanganannya harus hati-hati. Jika uap bromin keluar dari wadahnya maka dalam beberapa saat ruangan akan tampak cokelat-kemerahan.
Unsur-unsur halogen gampang dikenali dari busuk dan warnanya. Halogen umumnya berbau menyengat, terutama klorin dan bromin (bromos, artinya pesing). Kedua gas ini bersifat racun sehingga penanganannya harus hati-hati. Jika uap bromin keluar dari wadahnya maka dalam beberapa saat ruangan akan tampak cokelat-kemerahan.
Titik leleh, titik didih, dan sifat-sifat yang lainnya ditunjukkan pada Tabel 11. Kenaikan titik leleh dan titik didih dari atas ke bawah dalam tabel periodik tanggapan gaya tarik di antara molekul yang makin meningkat dengan bertambahnya jari-jari atom.
Tabel 11. Sifat-Sifat Fisika dan Kimia Unsur Halogen
Sifat-Sifat | F | Cl | Br | I | At |
Titik leleh (°C) | –220 | –101 | –7 | 114 | – |
Titik didih (°C) | –188 | –35 | –59 | 184 | – |
Massa jenis (g/cm3) | 0,0017 | 0,0032 | 3,12 | 4,93 | – |
Keelektronegatifan | 4,0 | 3,0 | 2,8 | 2,5 | 2,2 |
Afinitas elektron (kJ mol–1) | – 328 | –349 | –325 | –295 | 270 |
Kereaktifan halogen sanggup dipelajari dari jari-jari atomnya. Dari atas ke bawah, jari-jari atom meningkat sehingga gaya tarik inti terhadap elektron valensi makin lemah. Akibatnya, kereaktifan unsur-unsur halogen makin berkurang dari atas ke bawah. Kereaktifan halogen sanggup juga dipelajari dari afinitas elektron. Makin besar afinitas elektron, makin reaktif unsur tersebut. Dari atas ke bawah dalam tabel periodik, afinitas elektron unsurunsur halogen makin kecil sehingga kereaktifan F > Cl > Br > I.
Sekilas Kimia
Neon
Neon mengeluarkan cahaya kemerah-merahan jikalau listrik dialirkan melalui sebuah pipa vakum udara mengandung neon. Neon ini digunakan untuk menghasilkan tanda-tanda iklan yang berwarna sangat cerah. Cahaya terang yang diperoleh berkaitan dengan tenaga yang digunakan. Gas mulia lain, xenon, digunakan untuk mengisi tabung fluoresen dan menghasilkan cahaya pada lampu-lampu yang digunakan di rumah-rumah. (Sumber: Jendela IPTEK: Kimia, 1997)
5.7. Gas Mulia
Oleh lantaran unsur-unsur gas mulia mempunyai konfigurasi elektron valensi penuh (8 elektron) maka unsur-unsur gas mulia bersifat stabil. Kestabilan unsur-unsur ini menjadikan pandangan di kalangan para ilmuwan bahwa unsur-unsur gas mulia sukar membentuk senyawa sehingga gas mulia menerima julukan gas lembam (inert). Selain konfigurasi elektron yang terisi penuh, ketidakreaktifan gas mulia juga sanggup dilihat dari data energi ionisasinya. Makin besar energi ionisasi gas mulia, makin sukar gas tersebut untuk bereaksi.
Tabel 12. Energi Ionisasi Unsur-Unsur Gas Mulia
Gas Mulia | He | Ne | Ar | Kr | Xe | Rn |
Energi ionisasi (kJ mol–1) | 2377 | 2088 | 1527 | 1356 | 1176 | 1042 |
Sumber: General Chemistry (Ebbing), 1990 | ||||||
Gas mulia merupakan gas tidak berwarna, tidak berasa, dan tidak berbau. Argon, kripton, dan xenon sedikit larut dalam air. Helium dan neon tidak sanggup larut dalam air. Sifat-sifat fisika lainnya dari unsurunsur gas mulia ditunjukkan pada Tabel 13.
Tabel 13 Sifat-Sifat Fisika Unsur-Unsur Gas Mulia
Sifat Fisik | He | Ne | Ar | Kr | Xe | Rn |
Massa jenis (g/cm3) | 0,18 | 0,90 | 1,80 | 3,75 | 5,80 | 10,0 |
Titik didih (°C) | –269 | –246 | –186 | –153 | –108 | –62 |
Titik leleh (°C) | –272 | –249 | –189 | –157 | –112 | –71 |
Sumber: General Chemistry (Ebbing), 1990 | ||||||
Jika dilihat dari titik lelehnya, gas mulia berwujud gas pada suhu kamar. Pada tekanan normal, hampir semua gas mulia sanggup dicairkan, kecuali gas helium. Gas helium hanya sanggup dicairkan pada tekanan sangat tinggi sekitar 25 atm. Oleh lantaran gas helium merupakan gas yang memiliki titik leleh dan titik didih paling rendah maka gas tersebut sering digunakan sebagai pendingin untuk mempertahankan suhu di sekitar 0 °K Pada 4 K, gas helium memperlihatkan sifat super fluida tanpa viskositas, dinamakan super konduktor, yaitu zat yang memiliki daya hantar listrik dan panas tanpa kendala dan tanpa medan magnet. Besarnya hantaran listrik mencapai 800 kali lebih cepat dibandingkan kawat tembaga.
Rangkuman :
- Dasar pengelompokan unsur-unsur dalam tabel periodik mengalami perkembangan, mulai model triade dari Dobereiner, model oktaf dari Newland, model Mendeleev, hingga model tabel periodik panjang.
- Sistem periodik modern memakai bentuk memanjang yang didasarkan pada kenaikan nomor atom. Struktur dasar tabel periodik modern adalah pengaturan unsur-unsur ke dalam baris (periode) dan kolom (golongan).
- Golongan merupakan kumpulan unsur-unsur yang terletak dalam satu lajur vertikal. Unsur-unsur segolongan mempunyai kemiripan sifat kimia.
- Periode merupakan kumpulan unsur-unsur yang terletak dalam satu lajur horizontal. Unsur-unsur dalam periode yang sama cenderung sifatnya berubah seperti dari logam menuju bukan logam (dalam sistem periodik).
- Penempatan unsur-unsur dalam sistem periodik berhubungan dengan konfigurasi elektronnya. Nomor pada golongan mencerminkan elektron valensinya, sedangkan nomor periode bekerjasama jumlah orbit.
- Umumnya jari-jari atom unsur-unsur seperiode dari kiri ke kanan berkurang secara periodik. Demikian pula dari bawah ke atas dalam golongan yang sama, yaitu jari-jari atom berkurang.
- Umumnya, energi ionisasi dalam golongan yang sama dari bawah ke atas meningkat. Demikian pula pada periode yang sama, yaitu dari kiri ke kanan meningkat.
- Secara umum, afinitas elektron dalam golongan yang sama dari bawah ke atas bertambah. Demikian pula pada periode yang sama dari kiri ke kanan, afinitas elektron bertambah.
- Unsur-unsur golongan IA dinamakan golongan alkali, IIA golongan alkali tanah, VIIA golongan halogen, dan VIIIA golongan gas mulia. Nomor golongan sesuai dengan jumlah elektron pada kulit terluar (elektron valensi) dari atom.
Anda kini sudah mengetahui Sistem Periodik. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Sunarya, Y. dan A. Setiabudi. 2009. Praktis dan Aktif Belajar Kimia 1 : Untuk Kelas X Sekolah Menengah Atas / Madrasah Aliyah. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 226.





No comments:
Post a Comment