Cara Menghitung Laju Reaksi Kimia Melalui Perubahan Volume dan Massa, Contoh Soal, Pembahasan - Apa yang dimaksud dengan laju reaksi? Di dalam reaksi kimia pereaksi berkembang menjadi hasil reaksi. Laju dari perubahan zat ialah ukuran jumlah perubahan zat yang terjadi tiap satuan waktu. Bagaimana cara mengukur laju reaksi ini? Untuk mempelajarinya perhatikan ilustrasi berikut.
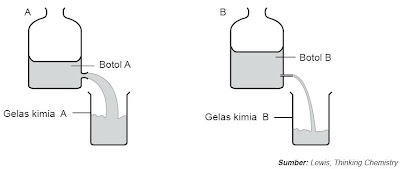 |
| Gambar 1. Membandingkan laju reaksi air pada botol A dan B. |
Pada Gambar 1, air dialirkan dari botol besar ke gelas kimia. Lubang untuk aliran kedua botol tersebut berbeda. Pada botol yang mana laju aliran air yang lebih cepat? Dari percobaan ini, laju sanggup ditentukan dengan dua cara yaitu dengan mengukur volume air yang berkurang dari botol per satuan waktu dan volume air yang bertambah pada gelas kimia per satuan waktu.
Dari ilustrasi tersebut maka untuk mengukur laju reaksi sanggup ditentukan dengan dua cara yaitu dengan mengukur:
- jumlah pereaksi yang dipakai atau bereaksi per satuan waktu, dan
- jumlah hasil reaksi yang terbentuk per satuan waktu.
Misalnya pada ketika mereaksikan logam magnesium dengan asam klorida dengan reaksi :
Mg(s) + 2HCl(aq) → MgCl2(aq) + H2(g)
Laju reaksi sanggup dihitung dengan mengukur jumlah magnesium atau asam klorida yang dipakai dalam waktu tertentu atau jumlah magnesium klorida atau gas hidrogen yang terbentuk dalam waktu tertentu.
Bagaimana cara mengukur jumlah pereaksi atau hasil reaksi dalam suatu reaksi? Dalam beberapa reaksi, pereaksi dan hasil reaksi dalam keadaan bercampur dan dalam wujud yang sama. Untuk memisahkannya cukup sulit. Oleh sebab itu, pengukuran laju reaksi akan lebih gampang pada reaksi yang wujud hasil reaksinya berbeda dengan pereaksi.
Pengukuran laju reaksi yang menghasilkan gas sanggup dilakukan dengan mengukur volume gas yang terjadi dalam waktu yang ditentukan atau mengukur massa sehabis beberapa waktu yang ditentukan.
1. Cara Menghitung Laju Reaksi dengan Mengukur Perubahan Volume
Sebagai pola pengukuran laju reaksi untuk reaksi logam dengan asam. Perhatikan Gambar 2.
 |
| Gambar 2. Menghitung laju reaksi dengan mengukur perubahan volume. |
Pada percobaan ini dipakai labu erlenmeyer berlengan. Pada ketika logam dimasukkan ke dalam larutan asam, labu erlenmeyer segera di tutup. Asam dan logam akan bereaksi menghasilkan gas. Gas yang terbentuk akan menekan air sehingga volume gas sanggup diukur. Volume gas diukur tiap menit. Hasil percobaannya sanggup dilihat pada Tabel 1.
Tabel 1. Hasil pengukuran volume gas yang terbentuk dari reaksi asam dan logam
Waktu (menit) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
Volume gas (mL) | 0 | 12 | 20 | 26 | 30 | 33 | 35 | 36,5 | 37,5 | 38 | 38 |
Data percobaan tersebut sanggup dibentuk grafik ibarat Gambar 3.
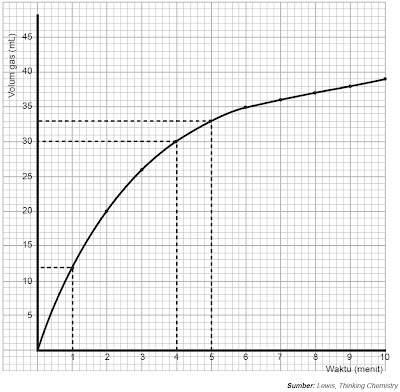 |
| Gambar 3. Grafik antara volume gas yang dihasilkan dari reaksi asam dan logam dengan waktu (menit). |
Dari data percobaan sanggup dilihat reaksi mula-mula sangat cepat gas yang dihasilkan 12 mL dalam waktu 1 menit. Tetapi sehabis 5 menit hanya 3 mL dan sehabis 9 menit tidak ada lagi gas yang dihasilkan, artinya reaksi telah selesai.
Untuk memilih laju reaksinya diambil dari kemiringan (gradien) kurva pada waktu-waktu tertentu dan menggambarkan tangens pada kurva. Langkah-langkahnya yaitu :
- Buat garis miring pada titik yang mengatakan waktu 2 menit.
- Gambarkan tangens pada kurva.
- Ukur perubahan jarak vertikal dan perubahan jarak horizontal.
Hitung kemiringan (gradien) dengan rumus:
Gradien = 
Perhatikan Gambar 4.
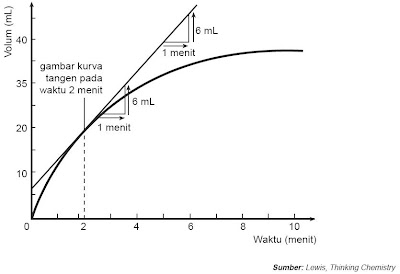 |
| Gambar 4. Menentukan gradien antara volume gas yang dihasilkan dari reaksi asam dan logam dengan waktu (menit). |
Pada diagram, perubahan jarak vertikal = perubahan volume dan perubahan jarak horizontal = perubahan waktu.
Kaprikornus gradien =  =
=  = 6 mL per menit
= 6 mL per menit
Gradien pada grafik mengatakan perubahan volum per satuan waktu atau laju reaksi, maka laju reaksi di atas ialah 6 mL per menit. Artinya setiap 1 menit dihasilkan 6 mL hidrogen.
2. Cara Menghitung Laju Reaksi melalui Perubahan Massa
Metode ini cocok untuk reaksi yang menghasilkan gas dengan massa cukup tinggi seperti CO2. Misalnya reaksi antara CaCO3 dengan HCl.
Persamaan reaksi : CaCO3(s) + HCl(aq) → CaCl2(aq) + CO2(g) + H2O(l)
Berikut ini ialah cara mengukur perubahan massa zat selama reaksi dan perhitungan laju reaksinya menurut grafik perubahan massa zat selama reaksi. Perhatikan Gambar 5.
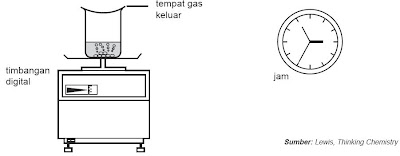 |
| Gambar 5. Mengukur laju reaksi melalui perubahan massa. |
Pada percobaan ini sistem yang terdiri dari zat yang direaksikan dan peralatan diletakkan pada timbangan digital. Kaca arloji epilog gelas kimia diganjal sehingga ada celah kecil supaya gas sanggup keluar. Akibat gas hasil reaksi keluar maka massa sistem setiap waktu akan berkurang. Hasil pengamatan pengukuran massa setiap menit dibentuk grafik contohnya ibarat Gambar 6.
 |
| Gambar 6. Menentukan gradien dari pengukuran massa vs waktu. |
Gradien = (0,3 gram) / 10 menit = 0,03 gram / 1 menit
Jadi, Laju reaksi = 0,03 gram CO2 yang dihasilkan per menit.
Jika pada percobaan yang diukur ialah perubahan konsentrasi ibarat pada grafik berikut.
Kemiringannya sanggup dihitung dengan rumus :
Kemiringan =  =
= 
Berdasarkan grafik di atas sanggup disimpulkan bahwa laju reaksi ialah perubahan konsentrasi pereaksi atau hasil reaksi per satuan waktu. Laju reaksi sanggup dirumuskan sebagai berikut.
• Untuk perubahan konsentrasi pereaksi : 
Tanda negatif mengatakan konsentrasi pereaksi berkurang selama bereaksi.
• Untuk perubahan konsentrasi hasil reaksi : 
Keterangan :
r = laju reaksi
∆C = perubahan konsentrasi
∆t = perubahan waktu
Satuan untuk laju reaksi ialah mol liter–1 detik–1 atau M detik–1.
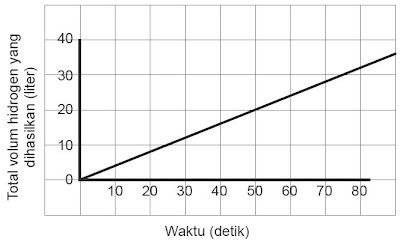
Contoh Soal Menghitung Laju Reaksi (1) :
Data percobaan reaksi antara Mg dengan HCl digambarkan dalam grafik sebagai berikut!
Tentukan rata-rata laju reaksi pembentukan gas H2!
Penyelesaian :
r = 32 L / 80 detik = 0,4 L detik–1
Contoh Soal Menghitung Laju Reaksi (2) :
Untuk reaksi : N2(g) + 3H2(g) → 2NH3(g).
Jika konsentrasi gas N2 mula-mula = 1 mol L–1 setelah selang waktu 5 menit ternyata konsentrasi N2 tersisa 0,5 mol L–1, tentukan laju reaksi untuk : N2, H2, dan NH3.
Pembahasan :
∆[N2] = [N2]sisa – [N2] mula-mula = 0,5 mol L–1 – 1 mol L–1
∆[N2] = - 0,5 mol L–1
∆t = 5 x 60 detik = 300 detik
Laju reaksi pengurangan N2 : r =  = 1,67 x 10–3 mol L–1detik–1
= 1,67 x 10–3 mol L–1detik–1
Dalam stoikiometri, perbandingan mol berbanding lurus dengan perbandingan koefisien reaksi sanggup dikatakan berbanding lurus dengan laju pengurangan dan penambahan zat reaksi.
Laju pengurangan H2 = 3 x laju pengurangan N2
= 3 x 1,67 x 10–3 mol L–1 detik–1 = 5 x 10–3 mol L–1 detik–1
Laju pertambahan NH3 = 2 x laju pengurangan N2
= 2 x 1,67 x 10-3 mol L–1 detik–1 = 3,34 x 10–3 mol L–1 detik–1
Anda kini sudah mengetahui Cara Menghitung Laju Reaksi. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Kalsum, S., P. K. Devi, Masmiami, dan H. Syahrul. 2009. Kimia 2 : Kelas XI Sekolah Menengan Atas dan MA. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 294.
No comments:
Post a Comment