Orde Reaksi 0 1 2 Nol Satu Dua, Negatif, Persamaan Laju Reaksi, Pengertian, Grafik, Rumus, Contoh Soal, Pembahasan, Kimia - Pada umumnya hubungan antara laju reaksi dengan konsentrasi zat-zat pereaksi hanya diturunkan dari data eksperimen. Orde reaksi ialah Bilangan pangkat yang menyatakan hubungan konsentrasi zat pereaksi dengan laju reaksi. Untuk reaksi aA + bB → cC + dD, persamaan laju reaksi ditulis:
r = k[A]m.[B]n
Keterangan :
r = laju reaksi
k = tetapan laju reaksi
[A] = konsentrasi zat A dalam mol per liter
[B] = konsentrasi zat B dalam mol per liter
m = orde reaksi terhadap zat A
n = orde reaksi terhadap zat B
Beberapa rujukan reaksi dan rumus laju reaksi yang diperoleh dari hasil eksperimen sanggup dilihat pada Tabel 1.
Tabel 1. Contoh beberapa reaksi dan rumus laju reaksinya
Reaksi | Rumus Laju Reaksi |
2H2(g) + 2NO(g) → 2H2O(g) + N2(g) | r = k[H2][NO]2 |
H2(g) + I2(g) → 2HI(g) | r = k[H2][I2] |
2HI(g) → H2(g) + I2(g) | r = k[HI]2 |
2H2(g) + SO2(g) → 2H2O(g) + S(g) | r = k[H2][SO2] |
2H2O2(aq) → 2H2O(l) + O2(g) | r = k[H2O2]2 |
Sumber: Ebbing, General Chemistry | |
Orde reaksi sanggup ditentukan dari persamaan laju reaksi. Misalnya, pada reaksi :
2H2(g) + 2NO(g) → 2H2O(g) + N2(g)
dengan persamaan laju reaksi :
r = k[H2][NO]2
orde reaksi terhadap H2 = orde satu, orde reaksi terhadap NO = orde dua, dan orde reaksi total ialah tiga. Untuk lebih memahami cara memilih orde reaksi dan rumus laju reaksi, perhatikan rujukan soal berikut.
Contoh Soal Orde Reaksi (1) :
Gas nitrogen oksida dan gas klor bereaksi pada suhu 300 K berdasarkan persamaan
2NO(g) + Cl2(g) ↔ 2NOCl(g)
Laju reaksi diikuti dengan mengukur pertambahan konsentrasi NOCl dan diperoleh data sebagai berikut.
Percobaan | [Cl2] mol L–1 | [NO] mol L–1 | Laju Pembentukan NOCl (mol L–1 detik–1) |
1 | 0,10 | 0,10 | 0,0001 |
2 | 0,10 | 0,20 | 0,0004 |
3 | 0,10 | 0,30 | 0,0009 |
4 | 0,20 | 0,10 | 0,0002 |
5 | 0,30 | 0,10 | 0,0003 |
a. Tentukan orde reaksi terhadap NO, terhadap Cl2, dan orde reaksi total!
b. Tulis rumus laju reaksi.
c. Hitung harga k.
Penyelesaian :
a Orde reaksi terhadap NO (gunakan data nomor 1 dan 2)
Jadi, orde reaksi terhadap NO ialah 2.
Bandingkan akhirnya bila kau memakai data nomor 1 dengan 3 atau 2 dengan 3.
Orde reaksi terhadap Cl2 (gunakan data nomor 1 dan 4)
Jadi, orde reaksi terhadap Cl2 adalah 1.
Orde reaksi total = m + n = 1 + 2 = 3.
b. Rumus laju reaksi yaitu: r = k[Cl2][NO]2
c. Untuk menghitung k sanggup memakai salah satu data, contohnya data nomor 5.
Orde reaksi sanggup juga ditentukan melalui kecenderungan dari data suatu percobaan yang digambarkan dengan grafik. Berikut ini dijelaskan penentuan orde reaksi melalui grafik.
1. Grafik Orde Reaksi 0 Nol
Laju reaksi tidak dipengaruhi oleh besarnya konsentrasi pereaksi. Persamaan laju reaksinya ditulis:
r = k[A]0
Bilangan dipangkatkan nol sama dengan satu sehingga persamaan laju reaksi menjadi :
r ≈ k.
Jadi, reaksi dengan laju tetap memiliki orde reaksi nol. Grafiknya digambarkan ibarat Gambar 1.
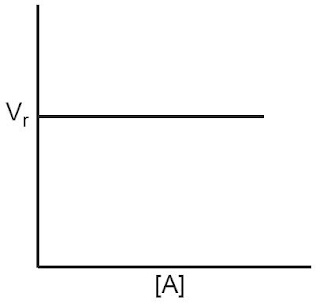 |
| Gambar 1. Grafik Hubungan kecepatan dengan konsentrasi (Orde Reaksi 0 (Nol)). |
Suatu reaksi kimia dikatakan memiliki orde nol, jikalau besarnya laju reaksi tersebut tidak dipengaruhi oleh konsentrasi pereaksi. Artinya, seberapapun peningkatan konsentrasi pereaksi tidak akan mensugesti besarnya laju reaksi. [1]
2. Grafik Orde Reaksi 1 Satu
Untuk orde satu, persamaan laju reaksi ialah :
r = k[A]1
Persamaan reaksi orde satu merupakan persamaan linier berarti laju reaksi berbanding lurus terhadap konsentrasinya pereaksinya. Jika konsentrasi pereaksinya dinaikkan contohnya 4 kali, maka laju reaksi akan menjadi 41 atau 4 kali lebih besar. Grafiknya digambarkan ibarat Gambar 2.
 |
| Gambar 2. Grafik Hubungan kecepatan dengan konsentrasi (Orde Reaksi 1 (Satu)). |
Suatu reaksi kimia dikatakan memiliki orde satu, apabila besarnya laju reaksi berbanding lurus dengan besarnya konsentrasi pereaksi. Artinya, jikalau konsentrasi pereaksi dinaikkan dua kali semula, maka laju reaksi juga akan meningkat besarnya sebanyak (2)1 atau 2 kali semula juga. [1]
3. Grafik Orde Reaksi 2 Dua
Persamaan laju reaksi untuk reaksi orde dua ialah :
r = k[A]2
Apabila suatu reaksi berorde dua terhadap suatu pereaksi berarti laju reaksi itu berubah secara kuadrat terhadap perubahan konsentrasinya. Apabila konsentrasi zat A dinaikkan contohnya 2 kali, maka laju reaksi akan menjadi 22 atau 4 kali lebih besar. Grafiknya digambarkan ibarat Gambar 3.
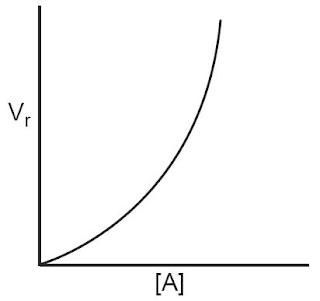 |
| Gambar 3. Grafik Hubungan kecepatan dengan konsentrasi (Orde Reaksi 1 (Satu)). |
Suatu reaksi dikatakan memiliki orde dua, apabila besarnya laju reaksi merupakan pangkat dua dari peningkatan konsentrasi pereaksinya. Artinya, jikalau konsentrasi pereaksi dinaikkan 2 kali semula, maka laju reaksi akan meningkat sebesar (2)2 atau 4 kali semula. Apabila konsentrasi pereaksi dinaikkan 3 kali semula, maka laju reaksi akan menjadi (3)2 atau 9 kali semula. [1]
4. Orde Reaksi Negatif (-)
Suatu reaksi kimia dikatakan memiliki orde negatif, apabila besarnya laju reaksi berbanding terbalik dengan konsentrasi pereaksi. Artinya, apabila konsentrasi pereaksi dinaikkan atau diperbesar, maka laju reaksi akan menjadi lebih kecil. [1]
Anda kini sudah mengetahui Orde Reaksi. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Kalsum, S., P. K. Devi, Masmiami, dan H. Syahrul. 2009. Kimia 2 : Kelas XI Sekolah Menengan Atas dan MA. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 294.
Referensi Lainnya :
[1] Utami, B. A. Nugroho C. Saputro, L. Mahardiani, S. Yamtinah, dan B. Mulyani. 2009. Kimia 2 : Untuk SMA/MA Kelas XI, Program Ilmu Alam. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 274.
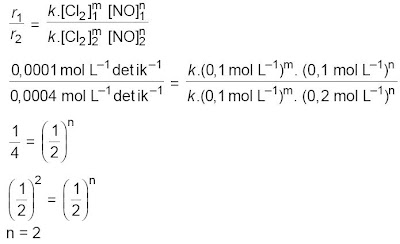


No comments:
Post a Comment