Diagram Fasa Air, Sifat Koligatif Larutan, Rumus, Pengertian, Gambar Grafik, Kimia - Diagram fasa ialah ungkapan perubahan keadaan dasar fasa suatu zat dalam bentuk diagram. Diagram fasa sanggup dinyatakan menurut perubahan suhu (°C) dan tekanan (atm), dinamakan diagram P – T. Dalam diagram fasa terdapat kurva kesetimbangan antara fasa padat, cair, dan gas.
1. Diagram Fasa Air
Seperti Anda ketahui, air sanggup berada dalam fasa gas, cair, dan padat bergantung pada suhu dan tekanan. Ketiga fasa tersebut sanggup diungkapkan dalam bentuk diagram P – T (Gambar 1).
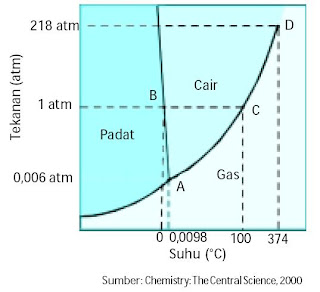 |
| Gambar 1. Diagram fasa air Titik tripel A (0,01 °C; 0,006 atm), titik leleh (atau titik beku) normal B (0 °C; 1 atm); titik didih normal C (100 °C; 1 atm), dan titik kritis D (374,4 °C; 217,7 atm). |
Pada diagram fasa tersebut terdapat tiga kurva yang membagi diagram ke dalam tempat padat, cair, dan gas. Pada setiap daerah, memperlihatkan keadaan wujud zat yang stabil. Setiap titik pada kurva memperlihatkan relasi tekanan dan suhu. Kurva AB yang membagi wilayah padat dan cair, menyatakan keadaan padat dan cair berada dalam keadaan setimbang:
Padat D Cair
Kurva tersebut menawarkan gosip wacana titik leleh padatan atau titik beku cairan pada suhu dan tekanan tertentu. Umumnya peleburan (padat → cair) atau pembekuan (cair → padat) tidak dipengaruhi oleh tekanan sehingga kurva AB cenderung membentuk garis lurus.
Kurva AB untuk air agak miring ke kiri lantaran pembentukan es pada tekanan tinggi suhunya turun sebesar 1 °C dari keadaan normal (1 atm). Hal ini disebabkan pada keadaan cair kurang rapat dibandingkan pada keadaan padat.
Kurva AC yang membagi wilayah cair dan gas menawarkan gosip wacana tekanan uap air pada banyak sekali suhu. Kurva tersebut memperlihatkan garis kesetimbangan fasa antara cair dan gas. Titik leleh dan titik didih air pada tekanan 1 atm ditunjukkan dengan garis putus-putus, berada pada suhu 0 °C dan 100 °C.
Kurva AD yang membagi wilayah padat dan gas menawarkan gosip wacana tekanan uap padatan pada banyak sekali suhu. Kurva tersebut memperlihatkan garis kesetimbangan fasa antara padat dan gas. Kurva ini berpotongan dengan kurva yang lain pada titik A. Titik A dinamakan titik tripel, yaitu titik di mana pada suhu dan tekanan tersebut terjadi kesetimbangan fasa antara gas, cair, dan padat secara bersama-sama. Titik tripel untuk air terjadi pada suhu 0,01 °C dan tekanan 0,006 atm (4,58 mmHg).
Dengan diagram fasa, Anda sanggup memperkirakan wujud suatu zat pada suhu dan tekanan tertentu. Pada tekanan 1 atm dan suhu 25 °C, air akan berwujud cair, sedangkan pada suhu 0 °C air berwujud padat (es). Diagram fasa yang lain contohnya diagram fasa CO2, ibarat ditunjukkan pada Gambar 2.
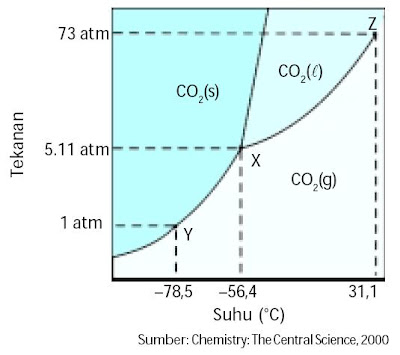 |
| Gambar 2. Diagram fasa karbon dioksida Titik tripel X (–56,4 °C; 5,11 atm), titik sublimasi Y (–78,5 °C; 1 atm), dan titik kritis Z (31,1 °C; 73,0 atm). |
Titik tripel CO2 berada pada –56,4 °C dan 5,11 atm. Oleh alasannya ialah itu, CO2 padat (dry ice) akan menyublim kalau dipanaskan di bawah tekanan 5,11 atm. Di atas 5,11 atm, dry ice akan mencair kalau dipanaskan. Pada suhu kamar dan tekanan udara normal dry ice menyublim sehingga sifat ini sering dimanfaatkan untuk pertunjukan panggung terbuka, supaya di panggung tampak ibarat berkabut. Dengan sedikit pemanasan, dry ice eksklusif menguap ibarat asap.
Beberapa istilah fasa transisi:
Penguapan : H2O(l) → H2O(g)
Pengembunan : H2O(g) → H2O(l)
Peleburan : H2O(s) → H2O(l)
Pembekuan : H2O(l) →H2O(s)
Sublimasi : H2O(s) → H2O(g)
Deposisi : H2O(g) → H2O(s)
2. Diagram Fasa dan Sifat Koligatif
Diagram fasa sanggup dipakai untuk menyatakan sifat koligatif larutan, ibarat kenaikan titik didih, penurunan titik beku, dan penurunan tekanan uap. Jika ke dalam air ditambahkan zat non volatil, larutan yang terbentuk akan mempunyai titik didih lebih tinggi dibandingkan pelarut murninya. Adapun titik beku larutan akan lebih rendah dibandingkan titik beku pelarut murninya.
 |
| Gambar 3. Diagram fasa larutan dalam pelarut air. |
Perhatikanlah diagram fasa pada Gambar 3. Pada tekanan normal (1 atm), pelarut murni air mempunyai titik beku 0 °C (titik C), titik didih 100 °C (titik B), dan tekanan uap (kurva A – B) yang bergantung pada suhu. Adanya zat terlarut nonvolatil menjadikan pergeseran posisi kesetimbangan diagram fasa cair-gas.
Titik beku larutan lebih rendah dari titik beku pelarutnya (titik C'), titik didih larutan lebih tinggi dibandingkan titik didih pelarutnya (titik B'), dan tekanan uap turun, ditunjukkan oleh kurva (A' – B'). Demikian pula titik tripel larutan lebih rendah dari titik tripel air murni.
Nilai ΔTf dan ΔTb ditunjukkan oleh selisih pergeseran kesetimbangan antara pelarut murni dan larutannya, yaitu: ΔTf = C – C' dan ΔTb = B' – B. Penurunan tekanan uap larutan ditunjukkan oleh selisih garis AB – A'B'.
Anda kini sudah mengetahui Diagram Fasa. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Sunarya, Y. dan A. Setiabudi. 2009. Praktis dan Aktif Belajar Kimia 3 : Untuk Kelas XII Sekolah Menengah Atas / Madrasah Aliyah. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 298.
No comments:
Post a Comment