Sifat-Sifat Monosakarida, Reaksi Reduksi dan Oksidasi, Pembentukan Glikosida, Isomeri, Kimia - Pelajarilah uraian materi di bawah ini.
a) Mengalami Reaksi Reduksi
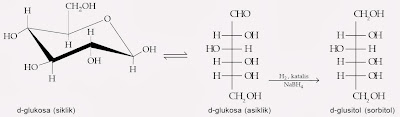
Gugus karbonil dari aldosa dan ketosa sanggup direduksi oleh aneka macam reagen. Produksinya ialah poliol, yang disebut alditol. Contohnya, hidrogenasi katalitik atau reduksi dengan natrium boronhidrida (NaBH4) mengonversi d-glukosa menjadi d-glusitol.
Contoh :
Reaksi yang terjadi yaitu reaksi reduksi sejumlah kecil aldehida dalam kesetimbangan dengan hemiasetal siklik. Jika aldehida yang sedikit itu direduksi, keseimbangan bergeser ke kanan, sehingga balasannya semua gula terkonversi. Sorbitol dipakai secara komersial sebagai aksesori dan pengganti gula.
b) Mengalami Reaksi Oksidasi
Aldosa berada terutama dalam bentuk hemiasetal siklik, tetapi struktur ini juga ada meskipun sedikit dalam bentuk aldehida rantai terbuka. Gugus aldehida ini sanggup dengan gampang dioksidasi menjadi asam. Produknya dinamakan asam aldonat (aldonic acid). Contohnya, d-glukosa gampang dioksidasi menjadi asam d-glukonat.
Oksidasi aldosa gampang terjadi sehingga senyawa ini bereaksi dengan materi pengoksidasi ringan menyerupai reagen Tollens (Ag+ dalam larutan amonia berair), reagen Fehling (kompleks Cu2+ dengan ion tartrat), atau reagen Benedict (kompleks Cu2+ dengan ion sitrat). Reagen Tollens menghasilkan uji cermin perak, dan reagen Fehling menimbulkan terbentuknya endapan merah dari tembaga oksida (Cu2O).
Karbohidrat yang bereaksi dengan Ag+ atau Cu2+ disebut gula pereduksi (reducing sugar) alasannya yaitu reduksi terhadap logam diiringi dengan oksidasi terhadap gugus aldehida. Reagen ini dipakai di laboratorium untuk menguji keberadaan gula pereduksi.
Reaksi aldosa dengan pereaksi Fehling dituliskan menyerupai berikut.
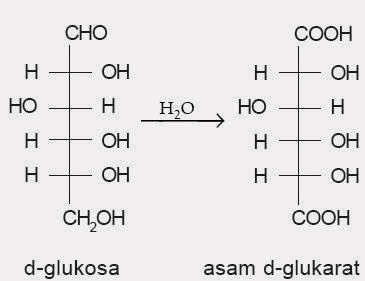
Bahan pengoksidasi yang lebih kuat, menyerupai larutan basah asam nitrat, mengoksidasi gugus aldehida, dan gugus alkohol primer menghasilkan asam dikarboksilat yang disebut asam aldarat (aldaric acid). Contohnya, d-glukosa menghasilkan asam d-glukarat menyerupai gambar di bawah ini.
c) Pembentukan Glikosida dari Monosakarida
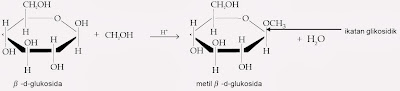
Oleh lantaran monosakarida berada sebagai hemiasetal siklik, senyawa ini sanggup bereaksi dengan satu ekuivalen alkohol membentuk asetat. Contohnya ialah reaksi β-d-glukosa dengan metanol.
Perhatikan bahwa hanya gugus –OH pada karbon anomerik yang digantikan oleh gugus –OR. Asetal menyerupai ini dinamakan glikosida, dan ikatan dari karbon anomerik dengan gugus–OR dinamakan ikatan glikosidik. Tata nama glikosida menurut nama monosakaridanya dengan mengganti akhiran -a dengan akhiran -ida.
d) Isomeri pada Monosakarida
Monosakarida memiliki isomer optis. Contoh (+) glukosa memiliki isomer α dan β. Dalam larutan air, konsentrasi α-glukosa yaitu 36% dan β-glukosa yaitu 64%. Isomer-isomer tersebut memiliki sifat fisika dan kimia yang berbeda sehingga sanggup dipisahkan.
Anda kini sudah mengetahui Sifat Monosakarida. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Sukmanawati, W. 2009. Kimia 3 : Untuk SMA/ MA Kelas XII. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 266.


No comments:
Post a Comment