Reaksi Polimerisasi, Pembentukan Polimer, Adisi, Radikal Bebas, Ion, Kondensasi, Kimia - Carothers, pakar kimia USA menggolongkan prosedur polimerisasi ke dalam dua golongan, yaitu polimerisasi adisi dan polimerisasi kondensasi. Polimerisasi adisi melibatkan reaksi rantai. Penyebab reaksi rantai sanggup berupa radikal bebas atau ion. Polimerisasi adisi terjadi pada senyawa yang mempunyai ikatan rangkap, menyerupai etena.
Polimerisasi kondensasi yaitu reaksi dua molekul bergugus fungsi lebih dari satu menghasilkan molekul besar dengan gugus fungsi yang juga lebih dari satu diikuti penyingkiran molekul kecil.
a. Polimerisasi Adisi
Polimerisasi adisi terjadi dalam tiga tahap, yaitu pemicuan, perambatan, dan pengakhiran. Oleh lantaran pembawa rantai sanggup berupa ion atau radikal bebas maka polimerisasi adisi digolongkan ke dalam polimerisasi radikal bebas dan polimerisasi ion.
1) Radikal Bebas
Radikal bebas biasanya dibuat melalui penguraian zat kurang stabil dengan energi tertentu. Radikal bebas menjadi pemicu pada polimerisasi. Zat pemicu berupa senyawa peroksida, menyerupai dibenzoil peroksida dan azodiisobutironitril.
Jika radikal bebas dinyatakan dengan R• dan molekul monomer dinyatakan dengan CH2=CHX maka tahap pemicuan sanggup digambarkan sebagai berikut.
 |
| Gambar 1. Dibenzoil peroksida gampang menjadi radikal bebas. |
R• + H2C = CHX → R – CH2 – CHX•
Tahap perambatan yaitu perpanjangan (elongasi) radikal bebas yang terbentuk pada tahap pemicuan dengan monomer-monomer lain:
R – CH2 – CHX• + CH2=CHX → R – CH2 – CHX – CH2 – CHX•
Tahap pengakhiran sanggup terjadi dengan cara berikut.
Laju polimerisasi sanggup dikendalikan dengan memakai zat penghambat (inhibitor) dan pelambat (retarder). Penghambat bereaksi dengan radikal bebas saat radikal bebas terbentuk. Polimerisasi tidak akan berlanjut sebelum seluruh zat penghambat habis terpakai.
Kuinon sanggup bertindak sebagai zat penghambat bagi banyak sistem polimerisasi alasannya yaitu kuinon bereaksi dengan radikal bebas menghasilkan radikal yang mantap jawaban resonansi. Radikal bebas yang mantap ini tidak sanggup memicu polimerisasi lebih lanjut.
Zat pelambat yang biasa digunakan yaitu gas oksigen. Gas ini kurang reaktif dibandingkan dengan penghambat. Cara kerja zat pelambat yaitu melalui persaingan dengan monomer untuk bereaksi dengan radikal bebas sehingga laju polimerisasi menurun. Persamaannya:
2) Polimerisasi Ionik
Polimerisasi adisi sanggup terjadi melalui prosedur yang tidak melibatkan radikal bebas. Dalam hal ini, pembawa rantai sanggup berupa ion karbonium (polimerisasi kation) atau ion karbanion (polimerisasi anion).
Dalam polimerisasi kation, monomer pembawa rantai yaitu ion karbonium. Katalis untuk reaksi ini yaitu asam Lewis, seperti AlCl3, BF3, TiCl4, SnCl4, H2SO4, dan asam berpengaruh lainnya.
Polimerisasi radikal bebas memerlukan energi atau suhu tinggi, sebaliknya polimerisasi kation paling baik dilakukan pada suhu rendah.
Misalnya, polimerisasi 2–metilpropena berlangsung optimum pada –100 oC dengan adanya katalis BF3 atau AlCl3.
Polimerisasi kation terjadi pada monomer yang mempunyai gugus yang gampang melepaskan elektron. Dalam polimerisasi yang dikatalis oleh asam, tahap pemicuan sanggup digambarkan sebagai berikut.
HA yaitu molekul asam, menyerupai HCl, H2SO4, dan HClO4. Pada tahap pemicuan, proton dialihkan dari asam ke monomer sehingga menghasilkan ion karbonium (C+).
Tabel 1. Beberapa Singkatan Polimer
| Nomor | Singkatan | Polimer |
| 1 2 3 4 5 6 | PET HDPE PVC LDPE PP PS | Polyethyleneterephthalate High density polyethylene Polyvinyl chloride Low density polyethylene Polypropylene Polystyrene |
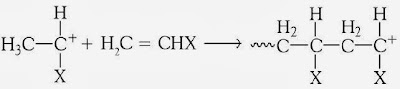
Perambatan berupa adisi monomer terhadap ion karbonium, prosesnya hampir sama dengan perambatan pada radikal bebas.
Pengakhiran rantai sanggup terjadi melalui banyak sekali proses. Proses paling sederhana yaitu penggabungan ion karbonium dan anion pasangannya (disebut ion lawan).
Dalam polimerisasi anion, monomer pembawa rantai yaitu suatu karbanion (C-). Dalam hal ini, monomer pembawa rantai yaitu yang mempunyai gugus dengan keelektronegatifan tinggi, menyerupai propenitril (akrilonitril), 2–metilpropenoat (metil metakrilat), dan feniletena (stirena).
Seperti polimerisasi kation, reaksi polimerisasi anion optimum pada suhu rendah. Katalis yang sanggup digunakan yaitu logam alkali, alkil, aril, dan amida logam alkali.
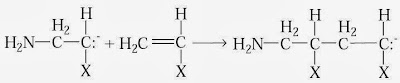
Contohnya yaitu kalium amida (KNH2) yang dalam pelarut amonia cair sanggup mempercepat polimerisasi monomer CH2=CHX dalam amonia. Kalium amida akan terionisasi berpengaruh sehingga pemicuan sanggup berlangsung menyerupai berikut.
Proses pengakhiran pada polimerisasi anion tidak begitu terang menyerupai pada polimerisasi kation alasannya yaitu penggabungan rantai anion dengan ion lawan (K+) tidak terjadi. Namun demikian, kalau terdapat sedikit air, karbon dioksida, atau alkohol akan mengakhiri pertumbuhan rantai.
b. Polimerisasi Kondensasi
Polimerisasi kondensasi melibatkan penggabungan molekul kecil membentuk molekul besar melalui reaksi kondensasi. Jika etanol dan asam asetat dipanaskan dengan sedikit asam sulfat pekat, akan terbentuk ester etil asetat disertai penyingkiran molekul air. Reaksi esterifikasi akan berhenti, alasannya yaitu tidak ada gugus fungsi lagi yang sanggup membentuk polimer.
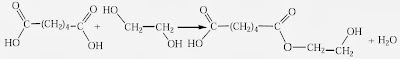
Namun demikian, kalau setiap molekul pereaksi mengandung dua atau lebih gugus fungsional maka reaksi berikutnya boleh jadi terbentuk. Misalnya, reaksi antara dua monomer asam heksanadioat (asam adipat) dan etana–1,2–diol (etilen glikol).
Dapat dilihat bahwa hasil reaksi masih mengandung dua gugus fungsional. Oleh karenanya, reaksi berikutnya dengan monomer sanggup terjadi, baik pada ujung hidroksil maupun pada ujung karboksil.
Polimer yang terbentuk mengandung satuan berulang (–OCH2–CH2–OOHCH–(CH2)4–CO–). Massa molekul bertambah secara sedikit demi sedikit dan waktu reaksi sangat usang kalau dibutuhkan massa molekul polimer yang terbentuk sangat besar. Jadi, polimerisasi kondensasi berbeda dengan polimerisasi adisi.
Pada polimerisasi kondensasi tidak terjadi pengakhiran. Polimerisasi berlangsung terus hingga tidak ada lagi gugus fungsi yang sanggup membentuk polimer. Namun demikian, reaksi polimerisasi sanggup dikendalikan dengan mengubah suhu. Misalnya, reaksi sanggup dilarang dengan cara didinginkan, tetapi polimerisasi sanggup mulai lagi kalau suhu dinaikkan.
Cara menghentikan reaksi yang lebih infinit yaitu dengan memakai penghentian ujung. Misalnya, penambahan sedikit asam asetat pada reaksi pertumbuhan polimer. Oleh lantaran asam asetat bergugus fungsional tunggal, sekali asam itu bereaksi dengan ujung rantai yang sedang tumbuh maka tidak akan terjadi lagi reaksi lebih lanjut. Jadi, polimerisasi yang sedang berlangsung sanggup dikendalikan.
Anda kini sudah mengetahui Polimerisasi. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Sunarya, Y. dan A. Setiabudi. 2009. Praktis dan Aktif Belajar Kimia 3 : Untuk Kelas XII Sekolah Menengah Atas / Madrasah Aliyah. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 298.
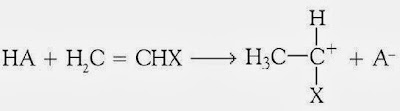
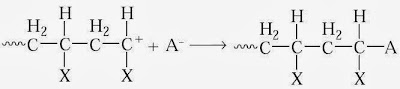

No comments:
Post a Comment