Struktur Benzena dan Turunannya, Ikatan, Sifat, Sifat, Contoh, Senyawa Kimia - Senyawa benzena pertama kali disintesis oleh Michael Faraday pada tahun 1825, dari gas yang digunakan sebagai materi bakar lampu penerang. Sepuluh tahun lalu diketahui bahwa benzena mempunyai rumus molekul C6H6 sehingga disimpulkan bahwa benzena mempunyai ikatan rangkap yang lebih banyak daripada alkena.
Ikatan rangkap pada benzena berbeda dengan ikatan rangkap pada alkena. Ikatan rangkap pada alkena sanggup mengalami reaksi adisi, sedangkan ikatan rangkap pada benzena tidak sanggup diadisi, tetapi benzena sanggup bereaksi secara substitusi. Contoh:
Reaksi adisi : C2H4 + Cl2 → C2H4Cl2
Reaksi substitusi : C6H6 + Cl2 → C6H5Cl + HCl
Menurut Friedrich August Kekule, keenam atom karbon pada benzena tersusun secara siklik membentuk segienam beraturan dengan sudut ikatan masing-masing 120°. Ikatan antaratom karbon yaitu ikatan rangkap dua dan tunggal bergantian (terkonjugasi).
Analisis sinar-X terhadap struktur benzena menunjukkan bahwa panjang ikatan antaratom karbon dalam benzena sama, yaitu 0,139 nm. Adapun panjang ikatan rangkap dua C=C yaitu 0,134 nm dan panjang ikatan tunggal C–C yaitu 0,154 nm. Jadi, ikatan karbon-karbon pada molekul benzena berada di antara ikatan rangkap dua dan ikatan tunggal. Hal ini menggugurkan struktur dari Kekule.
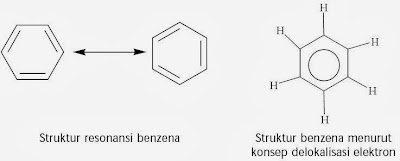
Berdasarkan hasil analisis sinar-X maka diusulkan bahwa ikatan rangkap pada molekul benzena tidak terlokalisasi pada karbon tertentu melainkan sanggup berpindah-pindah (terdelokalisasi). Gejala ini dinamakan resonansi. Untuk menggambarkan ikatan rangkap dua yang terdelokalisasi pada molekul benzena dinyatakan dengan bentuk lingkaran, ibarat ditunjukkan berikut ini.
Teori resonansi sanggup membuktikan mengapa benzena sukar mengalami reaksi adisi. Sebab, ikatan rangkap dua karbon-karbon dalam benzena terdelokalisasi dan membentuk cincin yang berpengaruh terhadap reaksi kimia sehingga tidak gampang diganggu.
Pada suhu kamar, benzena berwujud cair dengan amis yang khas, tidak berwarna, bersifat racun, dan gampang terbakar. Titik didih benzena 80 °C dan titik bekunya 5,5 °C. Lihat tabel berikut.
Tabel 1. Titik Beku dan Titik Didih dari Molekul Benzena
Nama | Titik Beku (°C) | Titik Didih (°C) |
Benzena | 5,5 | 80 |
Naftalena | 81 | 218 |
Antrasena | 216 | 342 |
Metilbenzena | – 95 | 111 |
Stirena | – 31 | 145 |
o–dimetilbenzena | – 25 | 144 |
m–dimetilbenzena | – 48 | 139 |
p–dimetilbenzena | 13 | 138 |
Benzena paling banyak digunakan sebagai pelarut senyawa karbon yang bersifat nonpolar dan sebagai materi baku untuk pembuatan senyawa turunan benzena. Semua senyawa karbon yang mengandung cincin benzena digolongkan sebagai turunan benzena. Reaksi umum benzena yaitu reaksi substitusi, yaitu penggantian atom H oleh gugus lain tanpa mengganggu cincin karbonnya. Contoh:
Sebagai komplemen acuan bacalah juga materi di bawah ini. [1]
Untuk pertama kalinya benzena diisolasi pada tahun 1825 oleh Michael Faraday dari residu berminyak yang tertimbun dalam pipa induk gas di London. Kemudian pada tahun 1834 ditetapkan rumus molekul benzena adalah C6H6. Struktur yang mula-mula diusulkan pada tahun 1865 tidak mengandung ikatan rangkap lantaran benzena tidak gampang mengalami reaksi adisi ibarat pada alkena. Struktur yang demikian ini tidak sesuai dengan tetravalensi karbon.
Agar tidak menyalahi tetravelensi karbon, pada tahun 1872 Friedrich August Kekule mengusulkan bahwa benzena mengandung tiga ikatan tunggal dan tiga ikatan rangkap yang berselang-seling.
Rumus struktur di atas sanggup disederhanakan penulisannya menjadi:
Pengukuran spektroskopik menunjukkan bahwa molekul benzena yaitu planar dan semua ikatan karbon-karbonnya sama panjang yaitu 1,39 Å. Ikatan karbon-karbon pada benzena panjangnya di antara ikatan karbon-karbon tunggal (1,47 Å) dan ikatan karbon-karbon rangkap (1,33 Å).
Hal ini sanggup dibenarkan lantaran ikatan karbon-karbon pada benzena mengalami resonansi (berpindah pindah). Inilah sebabnya mengapa benzena sukar mengalami adisi.
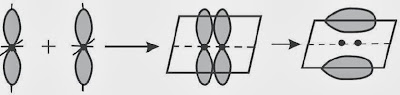
Ikatan karbon-karbon pada benzena terdiri atas ikatan sigma ( σ ) dan ikatan phi ( π ). Menurut teori ini ikatan valensi orbital molekul terbentuk dari tumpang tindih orbital-orbital atom. Ikatan kovalen yang terbentuk dari tumpang tindih ujung dengan ujung disebut ikatan sigma ( σ ), sedangkan ikatan kovalen yang terbentuk dari tumpang tindih sisi dengan sisi disebut ikatan phi ( π ).
Contoh ikatan sigma ( σ ) dari tumpang tindih orbital p – p (ujung dengan ujung).
Contoh ikatan phi ( π ) dari tumpang tindih orbital p – p (sisi dengan sisi).
Ikatan yang pertama antara dua atom merupakan ikatan sigma, dan ikatan yang kedua merupakan ikatan phi. Makara ikatan tunggal yaitu ikatan sigma, dan ikatan kovalen rangkap dua terdiri atas ikatan sigma dan ikatan phi.
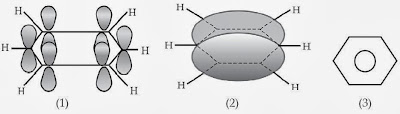
Benzena mempunyai enam karbon sp2 dalam sebuah cincin segi enam datar. Tiap atom karbon mempunyai satu orbital p yang tegak lurus bidang cincin. Tumpang tindih keenam orbital p menyebabkan terbentuknya enam orbital molekul sehingga terbentuk awan elektron berbentuk “donat” pada kepingan atas dan bawah cincin segi enam benzena.
2. Tata Nama Benzena
3. Reaksi Substitusi Benzena
4. Kereaktifan Benzena
Anda kini sudah mengetahui Struktur Benzena. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
3. Reaksi Substitusi Benzena
4. Kereaktifan Benzena
Anda kini sudah mengetahui Struktur Benzena. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Sunarya, Y. dan A. Setiabudi. 2009. Praktis dan Aktif Belajar Kimia 3 : Untuk Kelas XII Sekolah Menengah Atas / Madrasah Aliyah. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 298.
Referensi Lainnya :
[1] Pangajuanto, T. 2009. Kimia 3 : Untuk SMA/ MA Kelas XII. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 282.





No comments:
Post a Comment