Pengaruh Luas Permukaan Terhadap Laju Reaksi, Bidang Sentuh, Dasar Teori, Praktikum Kimia - Luas permukaan sentuhan antara zat-zat yang bereaksi merupakan suatu faktor yang menghipnotis kecepatan reaksi bagi gabungan pereaksi yang heterogen, contohnya antara zat padat dan gas, zat padat dengan larutan, dan dua macam zat cair yang tak sanggup campur. Reaksi kimia sanggup berlangsung kalau molekul-molekul, atom-atom, atau ion-ion dari zat-zat pereaksi terlebih dahulu bertumbukan. Hal ini terjadi kalau antara zat-zat yang akan bereaksi terjadi kontak. Semakin luas permukaan sentuhan antara zat-zat yang bereaksi, semakin banyak molekul-molekul yang bertumbukan dan semakin cepat reaksinya.
Pada reaksi antara zat padat dan gas atau antara zat padat dan larutan, kontak terjadi di permukaan zat padat itu. Kontak yang terjadi antara dua zat cair yang tidak sanggup bercampur terjadi pada bidang batas antara kedua macam zat cair tersebut.
Untuk menunjukan dampak luas permukaan sentuhan antara zat-zat yang bereaksi terhadap laju reaksinya, sanggup diambil pola reaksi antara pualam dan larutan HCl yang berlangsung berdasarkan persamaan sebagai berikut.
CaCO3(g) + 2 HCl(aq) → CaCl2(aq) + H2O(l) + CO2(aq)
Pada percobaan pertama (Gambar 1) digunakan CaCO3 berbentuk butiran dan pada percobaan kedua digunakan CaCO3 berupa serbuk. Harus diperhatikan bahwa pada kedua percobaan itu massa CaCO3 dan konsentrasi larutan HCI yang dipakai harus sama. Perbedaan kecepatan reaksi tersebut sanggup diketahui dengan membandingkan volume gas CO2 yang terbentuk selama selang waktu tertentu yang sama.
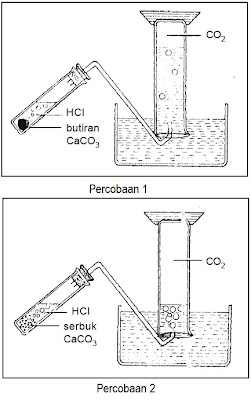 |
| Gambar 1. Pengaruh luas permukaan pada laju reaksi. |
Ternyata volume CO2 yang dihasilkan pada percobaan pertama lebih sedikit daripada yang diperoleh pada percobaan kedua. Hal ini menunjukan bahwa laju reaksi yang memakai serbuk CaCO3 lebih besar daripada yang memakai butiran CaCO3.
Data hasil eksperimen tercantum dalam tabel di bawah ini.
Percobaan | HCl 3 M (mL) | Pualam (0,3 g) | Waktu (sekon) |
1 | 5 | butiran sebesar pasir | 35 |
2 | 5 | satu keping | 60 |
Berdasarkan data tersebut sanggup disimpulkan bahwa pualam berbentuk butiran lebih cepat bereaksi dengan larutan HCI daripada pualam berbentuk kepingan. Dalam massa yang sama, pualam butiran memiliki luas permukaan sentuhan lebih besar daripada luas permukaan satu keping pualam.
Pada sistem heterogen, laju reaksi dipengaruhi pula oleh luas permukaan sentuhan pereaksi. Untuk pereaksi yang berwujud padat makin diperkecil ukuran partikel makin besar jumlah luas permukaan sentuhannya, makin cepat reaksi berlangsung. Dalam kehidupan sehari-hari dampak luas permukaan sentuhan pereaksi sanggup ditunjukkan bahwa kayu yang dipotong-potong kecil lebih cepat rusak daripada kayu balokan.
Praktikum Pengaruh Luas Permukaan Terhadap Laju Reaksi [1] :
Reaksi kimia sanggup terjadi antara reaksi satu fasa maupun beda fasa. Pada reaksi yang berlangsung lebih dari satu fasa, tumbukan antar partikel atau reaksi terjadi pada permukaan bidang sentuh. Jika luas permukaan ini diperbanyak, dengan jalan memperkecil ukuran partikel, maka laju reaksi menjadi lebih cepat.
Untuk lebih memahami dampak luas permukaan terhadap laju reaksi, lakukan percobaan berikut.
Pengaruh Luas Permukaan Bidang Sentuh
Alat dan materi :
- 3 buah tabung reaksi
- 3 macam kerikil pualam (CaCO3) dalam bentuk serbuk, butiran, dan belahan masing-masing massanya 1 gram
- 30 mL larutan HCl 2 M
Cara kerja :
- Percobaan dilakukan pada suhu kamar.
- Masukkan kerikil pualam ke dalam masing-masing tabung reaksi.
- Masukkan 10 mL HCl ke dalam tiap tabung reaksi. Segera hidupkan stopwatch, ketika memasukkan HCl.
- Catat waktu yang diharapkan mulai dari memasukkan HCl hingga dengan habisnya pita Mg bereaksi dengan HCl.
- Salin dan tuliskan data ke dalam tabel pengamatan.
Tabung Reaksi | CaCO3 1 gram | 10 mL HCl (M) | Waktu (detik) |
1 | serbuk | 2 M | .......................... |
2 | butiran | 2 M | .......................... |
3 | kepingan | 2 M | .......................... |
Bagaimana kesimpulan Anda terhadap hasil percobaan tersebut?
Anda kini sudah mengetahui Pengaruh Luas Permukaan Terhadap Laju Reaksi. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Referensi :
Harnanto, A dan Ruminten. 2009. Kimia 2 : Untuk SMA/MA Kelas XI. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 294.
Referensi Lainnya :
[1] Utami, B. A. Nugroho C. Saputro, L. Mahardiani, S. Yamtinah, dan B. Mulyani. 2009. Kimia 2 : Untuk SMA/MA Kelas XI, Program Ilmu Alam. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 274.
No comments:
Post a Comment