Tetapan Kesetimbangan pada Tekanan Parsial Gas, Kp, Contoh Soal, Pembahasan, Kimia - Tetapan kesetimbangan berdasarkan tekanan gas dinyatakan dengan notasi Kp, yakni hasil kali tekanan parsial gas-gas hasil reaksi dibagi dengan hasil kali tekanan parsial gas-gas pereaksi, masing-masing tekanan parsial gas dipangkatkan koefisiennya berdasarkan persamaan reaksi.
Menurut persamaan reaksi :
mA(g) + nB(g) D pC(g) + qD(g)
dengan :
Kp = tetapan kesetimbangan tekanan gas
PA = tekanan parsial gas A (atm) = (mol A / mol total) x Ptotal
PB = tekanan parsial gas B (atm) = (mol B / mol total) x Ptotal
PC = tekanan parsial gas C (atm) = (mol C / mol total) x Ptotal
PD = tekanan parsial gas D (atm) = (mol D / mol total) x Ptotal
Contoh Soal Tetapan Kesetimbangan Parsial Gas :
Dalam ruang 2 liter terdapat 5 mol gas amonia (NH3) yang terurai sesuai reaksi:
2NH3(g) D N2(g) + 3H2(g)
Pada keadaan setimbang terdapat 2 mol NH3. Tentukan:
a. besarnya derajat disosiasi (α)
b. Kc
c. Kp jika tekanan total sebesar 2 atm
Jawaban :
Persamaan reaksi | : | 2NH3(g) | D | N2(g) | + | 3H2(g) |
Mula-mula | : | 5 mol | 0 mol | 0 mol | ||
Bereaksi | : | 3 mol | → | 1,5 mol | 4,5 mol | |
Sisa (setimbang) | : | 2 mol | 1,5 mol | 4,5 mol |
a. α = mol NH3 bereaksi (terurai) / mol NH3 mula-mula = (3/5) x 100 % = 60%
b. • Mol N2 bereaksi dan mol H2 bereaksi sanggup ditentukan dengan perbandingan koefisien.
• Mol N2 bereaksi = (koefisien N2/ koefisien NH3) x mol NH3 = (1/2) x 3 = 1,5 mol
• mol H2 bereaksi = (koefisien H2 / koefisien NH3) x mol NH3 = (3/2) x 3 = 4,5 mol
c. Mol sisa (setimbang) total = mol N2 + mol H2 + mol NH3 = 1,5 + 4,5 + 2 = 8 mol
PN2 = (mol N2/mol total) x Ptotal = (1,5/8) x 2 atm = 0,375 atm
PH2 = (mol H2/mol total) x Ptotal = (4,5/8) x 2 atm = 1,125 atm
PNH3 = (mol NH3/mol total) x Ptotal = (2/8) x 2 atm = 0,5 atm
Anda kini sudah mengetahui Tetapan Kesetimbangan pada Tekanan Parsial Gas. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Utami, B. A. Nugroho C. Saputro, L. Mahardiani, S. Yamtinah, dan B. Mulyani. 2009. Kimia 2 : Untuk SMA/MA Kelas XI, Program Ilmu Alam. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 274.

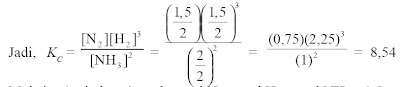
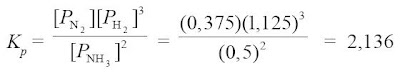
No comments:
Post a Comment