Faktor Penyebab Mengapa Partikel Koloid Bermuatan Listrik ? Kimia - Pernahkah kalian berpikir bahwa ternyata koloid bermuatan listrik dan bisa menghantarkan listrik menyerupai halnya larutan elektrolit? Bagaimanakah caranya? Coba kalian perhatikan klarifikasi berikut.
1. Elektroforesis [1]
Elektroforesis ialah pergerakan partikel koloid dalam medan listrik. Apabila ke dalam sistem koloid dimasukkan dua batang elektrode, kemudian dihubungkan dengan sumber arus searah, maka partikel koloid akan bergerak ke salah satu elektrode bergantung pada jenis muatannya. Koloid bermuatan negatif akan bergerak ke anode (elektrode positif), sedangkan koloid yang bermuatan positif bergerak ke katode (elektrode negatif). Dengan demikian, elektroforesis sanggup dipakai untuk memilih jenis muatan koloid.
2. Adsorpsi
Bagaimana cara partikel koloid sanggup bermuatan listrik? Pada permukaan partikel koloid bekerja Gaya Van der Waals terhadap ion atau molekul lain yang berada di sekitarnya, sehingga bisa menyerap ion atau muatan listrik. Hal ini mengakibatkan koloid menjadi bermuatan listrik.
Melekatnya partikel lain pada permukaan koloid disebut adsorpsi. Suatu koloid pada umumnya hanya mengadsorpsi ion positif atau negatif saja. Contohnya, koloid As2S3 bermuatan negatif alasannya mengadsorpsi ion negatif, sedangkan koloid Fe(OH)3 menjadi bermuatan positif sehabis mengadsorpsi H+.
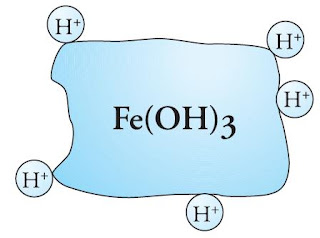 |
| Gambar 1. Koloid Fe(OH)3 bermuatan positif alasannya permukaannya menyerap ion H+. |
 |
| Gambar 2. Sol As2S3 mengadsorpsi ion negatif sehingga bermuatan negatif. |
3. Koagulasi [1]
Apabila muatan suatu koloid dilucuti, maka kestabilan koloid tersebut akan berkurang dan sanggup mengakibatkan koagulasi atau penggumpalan. Pelucutan muatan koloid sanggup terjadi pada sel elektroforesis atau kalau elektrolit ditambahkan ke dalam sistem koloid. Koagulasi koloid alasannya penambahan elektrolit terjadi sebagai berikut. Koloid yang bermuatan negatif akan menarik ion positif (kation), sedangkan koloid yang bermuatan positif akan menarik ion negatif (anion). Ion-ion tersebut akan membentuk selubung lapisan kedua. Apabila selubung lapisan kedua itu terlalu dekat, maka selubung itu akan menetralkan muatan koloid sehingga terjadi koagulasi. Makin besar muatan ion makin besar lengan berkuasa daya tarik-menariknya dengan partikel koloid, sehingga makin cepat terjadi koagulasi.
Beberapa pola koagulasi dalam kehidupan sehari-hari dan industri sebagai berikut:
a. Pembentukan delta di muara sungai terjadi alasannya koloid tanah liat (lempung) dalam air sungai mengalami koagulasi dikala bercampur dengan elektrolit dalam air laut.
b. Karet dalam lateks digumpalkan dengan menambahkan asam format.
c. Lumpur koloidal dalam sungai sanggup digumpalkan dengan menambahkan tawas. Sol tanah liat dalam air sungai biasanya bermuatan negatif, sehingga akan digumpalkan oleh ion Al3+ dari tawas (aluminium sulfat).
d. Asap atau bubuk dari pabrik dan industri sanggup digumpalkan dengan alat koagulasi listrik dari Cottrel.
Asap dari pabrik sebelum meninggalkan cerobong asap dialirkan melalui ujung-ujung logam yang tajam dan bermuatan pada tegangan tinggi (20.000 hingga 75.000 volt). Ujung-ujung yang runcing akan mengionkan molekul-molekul dalam udara. Ion-ion tersebut akan diadsorpsi oleh partikel asap dan menjadi bermuatan. Selanjutnya, partikel bermuatan itu akan tertarik dan diikat pada elektrode yang lainnya. Pengendap Cottrel ini banyak dipakai dalam industri untuk dua tujuan, yaitu mencegah polusi udara oleh buangan beracun dan memperoleh kembali bubuk yang berharga (misalnya bubuk logam).
Referensi :
Premono, S. A. Wardani, dan N. Hidayati. 2009. Kimia : SMA/ MA Kelas XI. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 282.
Referensi Lainnya :
[1] Utami, B. A. Nugroho C. Saputro, L. Mahardiani, S. Yamtinah, dan B. Mulyani. 2009. Kimia 2 : Untuk SMA/MA Kelas XI, Program Ilmu Alam. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 274.
No comments:
Post a Comment