Struktur Atom, Partikel Penyusun, Model, Proton, Elektron, Neutron, Penemuan, Inti, Nomor Massa, Muatan, Contoh Soal, Pembahasan, Isotop, Isoton, Isobar - Untuk mengidentifikasi struktur atom, kita tidak sanggup melakukan pengamatan secara eksklusif terhadap atom alasannya yaitu atom terlalu kecil untuk diamati secara langsung. Saat ini, atom telah sanggup dilihat dengan memakai mikroskop STM (Scanning Tunneling Microscope) dan AFM (Atomic Force Microscope) sehingga sifat dan karakteristik dari bentuk atom dapat diamati dengan lebih jelas. Gejala yang ditimbulkan atom dapat dipelajari, menyerupai warna nyala, difraksi, sifat listrik, sifat magnet, dan gejala-gejala lainnya.
A. Partikel Penyusun Atom
Sebelum ilmu Kimia berkembang, para filsafat Yunani Kuno sudah mengenal istilah atom. Menurut pandangannya, atom yaitu partikel terkecil yang membangun materi. Dengan teknologi modern, atom dapat diurai menjadi partikel-partikel yang lebih kecil, dinamakan partikel subatom, yaitu elektron, proton, dan neutron.
1.1. Penemuan Elektron
Keberadaan elektron sanggup diketahui berdasarkan percobaan sinar katode (Sir William Crookes, 1879). Dalam percobaannya, Crookes menggunakan alat yang disebut tabung sinar katode atau disebut juga tabung Crookes (lihat Gambar 1).
 |
| Gambar 1. Tabung sinar katode (tabung Crookes) |
Jika tabung Crookes dihubungkan dengan sumber arus searah tegangan tinggi maka katode akan memancarkan berkas sinar menuju anode. Sinar itu dinamakan sinar katode. Sinar katode mempunyai massa. Hal ini sanggup dilihat dengan memutarnya baling-baling yang dipasang pada jalannya berkas sinar katode (Gambar 1). Pengamatan lain menunjukkan, sinar katode dapat dibelokkan oleh medan listrik menuju kutub positif listrik. Hal ini menandakan bahwa sinar katode mempunyai muatan negatif (perhatikan Gambar 2).
 |
| Gambar 2. Sinar katode dibelokkan oleh medan listrik |
Berdasarkan fakta tersebut, apa yang sanggup Anda simpulkan? Stoney menamakan sinar katode dengan istilah elektron. Dengan demikian, elektron mempunyai massa dan bermuatan negatif. Jika materi katode diganti dengan logam lain selalu dihasilkan sinar katode yang sama. Hal ini membuktikan bahwa sinar katode atau elektron merupakan partikel dasar penyusun materi.
Contoh Soal Mengidentifikasi Sifat-Sifat Elektron (1) :
Elektron sanggup dibelokkan menuju kutub positif listrik sehingga disimpulkan bahwa sinar katode bermuatan negatif. Apakah dasar hukumnya?
Penyelesaian :
Benda-benda yang muatannya berlawanan akan tarik-menarik. Dengan demikian, dapat disimpulkan bahwa elektron bermuatan negatif.
1.2. Penemuan Proton
Keberadaan proton dibuktikan melalui percobaan tabung Crookes yang dimodifikasi (perhatikan Gambar 3).
Tabung Crookes diisi gas hidrogen dengan tekanan rendah. Percobaan ini dikembangkan oleh Eugen Goldstein. Jika tabung Crookes dihubungkan dengan sumber arus listrik di bagian belakang katode yang dilubangi maka akan terbentuk berkas sinar. Goldstein menamakan sinar itu sebagai sinar terusan. Oleh lantaran sinar susukan bergerak menuju katode maka disimpulkan bahwa sinar susukan bermuatan positif. Menurut Goldstein, sinar terusan tiada lain yaitu ion hidrogen. Ion ini terbentuk akhir gas hidrogen bertumbukan dengan sinar katode.
Oleh lantaran ion hidrogen hanya mengandung satu proton maka disimpulkan bahwa sinar positif yaitu proton. Penggantian gas hidrogen oleh gas lain selalu dihasilkan sinar yang sama dengan sinar susukan yang dihasilkan oleh gas hidrogen. Hal ini sanggup menandakan bahwa setiap materi mengandung proton sebagai salah satu partikel penyusunnya.
Contoh Soal Mengidentifikasi Sifat-Sifat Proton (2) :
Bagaimanakah terbentuknya ion hidrogen dalam tabung sinar katode? Jelaskan.
Bagaimanakah terbentuknya ion hidrogen dalam tabung sinar katode? Jelaskan.
Pembahasan :
Ketika tabung Crookes dihubungkan dengan arus listrik, sinar katode akan terpancar menuju anode. Dalam perjalanannya menuju anode, sinar katode bertumbukan dengan gas hidrogen yang terdapat dalam tabung sehingga terbentuk ion hidrogen yang bermuatan positif.
1.3. Penemuan Neutron
Keberadaan neutron dalam atom ditemukan oleh J. Chadwick melalui percobaan penembakan unsur berilium oleh partikel alfa kecepatan tinggi. Dari percobaan tersebut, terbentuk partikel yang tidak dipengaruhi medan magnet dan sanggup bertumbukan dengan parafin (Gambar 4). Partikel alfa yaitu partikel bermuatan positif yang dipancarkan oleh unsur radio aktif.
 |
| Gambar 4. Diagram alir pelepasan partikel neutron |
Data percobaan memperlihatkan bahwa sinar yang keluar dari target berilium tidak dipengaruhi oleh medan magnet. Ketika sinar yang keluar dari sasaran berilium menumbuk parafin, proton akan keluar dari parafin dengan kecepatan tinggi. Chadwick menyimpulkan bahwa partikel yang keluar dari unsur berilium tidak bermuatan dan mempunyai massa hampir sama dengan massa proton. Partikel tersebut dinamakan neutron.
Catatan :
Partikel alfa yaitu partikel yang dipancarkan oleh unsur radioaktif yang bermuatan positif.
1.4. Massa dan Muatan Partikel Sub Atom
Berdasarkan percobaan yang dilakukan oleh Sir Joseph J. Thomson (1897) dan Robert A. Millikan (1906), massa dan muatan partikel sub atom sanggup ditentukan. Untuk menyatakan massa subatom, massa proton dan neutron ditetapkan sama dengan satu, sedangkan elektron  kali massa proton. Massa proton gotong royong adalah 1,67 × 10–27 kg dan massa elektron sesungguhnya adalah 9,11 × 10–31 kg.
kali massa proton. Massa proton gotong royong adalah 1,67 × 10–27 kg dan massa elektron sesungguhnya adalah 9,11 × 10–31 kg.
Berapakah muatan elektron? Pertanyaan ini dijawab pada kala ke-20 oleh jago fisika Amerika, Robert A. Millikan. Penelitiannya yang terkenal dinamakan percobaan Tetes Minyak Millikan. Pada 1906, Robert A. Millikian berhasil memilih harga muatan elektron melalui percobaan tetes minyak. Minyak disemprotkan sampai tetesan minyak jatuh melalui celah yang terdapat pada pelat kepingan atas dan tetesan minyak memasuki ruang di antara dua pelat yang dipasang sejajar. Jika gas Z di antara kedua pelat itu disinari dengan sinar-x maka gas Z akan melepaskan elektron dan elektron ini terikat oleh tetesan minyak :
Z + sinar-x → Z+ + e–.
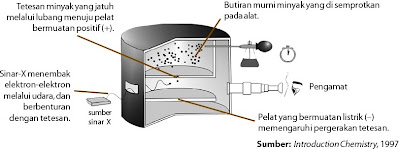 |
| Gambar 5. Percobaan tetes minyak Millikan untuk mengukur muatan elektron |
Dengan mengatur potensial pada pelat P, gerak tetesan minyak dapat diatur naik turun, gerakan ini sanggup diamati melalui teleskop (Gambar 5). Turunnya tetes minyak akhir gaya gravitasi (mg) dan naiknya tetes minyak diatur oleh potensial untuk mengimbangi gaya gravitasi yang besarnya sesuai dengan aturan Stokes (6πη rv), dengan r = jari-jari minyak, v= kecepatan jatuh minyak, dan η = viskositas minyak. Dari percobaan tetes minyak, Millikan menemukan bahwa muatan tetes minyak (q) selalu merupakan kelipatan bilangan bundar dari 1,6 × 10–19 C, yakni:
q = n e, dengan n = 1, 2, 3, ..., i
Hal ini disebabkan satu tetes minyak sanggup menangkap elektron sebanyak kelipatan dari bilangan bulat. Oleh lantaran itu, disimpulkan bahwa muatan sebuah elektron sama dengan 1,6 x 10-19.
Dengan mengetahui besar muatan elektron, harga massa elektron dapat dihitung dengan cara memasukkan harga muatan tersebut ke dalam persamaan angka banding :

yang ditemukan oleh Thomson, yaitu:
yang ditemukan oleh Thomson, yaitu:
Untuk menyatakan muatan partikel subatom, muatan proton sama dengan +1, elektron ditetapkan sama dengan –1, sedangkan neutron tidak bermuatan (netral). Muatan elektron dan proton sesungguhnya adalah : -1,67 × 10–19 dan 1,67 x 10-19.
Tabel 1. Muatan Partikel Sub Atom.
Tabel 1. Muatan Partikel Sub Atom.
Partikel Subatom | Massa | Muatan | ||
Eksak (kg) | Relatif | Eksak (coulomb) | Relatif | |
Proton, p | 1,67 × 10 –27 | 0 | +1,60 × 10–19 | +1 |
Neutron, n | 1,67 × 10 –27 | 1 | – | – |
Elektron, e | 9,11 × 10 –31 | – 1,60 × 10–19 | –1 | |
J.J Thomson (1856-1940)
Robert A. Millikan (1871-1937)
 |
| J. J. Thomson menemukan elektron sebagai unit penting dalam arus listrik (atas), Robert A. Millikan menemukan muatan elektron melalui percobaan minyak tetes (bawah). |
Apakah yang dimaksud dengan nomor atom dan nomor massa? Kedua besaran ini menyatakan identitas suatu atom untuk membedakan dengan atom-atom lain.
2.1. Nomor Atom
Jika suatu anode disinari dengan sinar katode akan dihasilkan sinar-X dengan panjang gelombang bergantung pada jumlah proton dalam atom logam yang dijadikan anode (Gambar 6). Panjang gelombang sinar-X menurun dengan bertambahnya jumlah proton dalam atom logam.
 |
| Gambar 6. Sinar-X dipancarkan oleh anode yang disinari dengan berkas sinar elektron berenergi tinggi |
Pada percobaan lain, Moseley menemukan bahwa jumlah proton berbanding lurus dengan nomor atom. Jika jumlah proton bertambah satu satuan maka nomor atom unsur tersebut juga bertambah satu satuan. Apa yang sanggup Anda simpulkan dari data di atas? Simak pernyataan berikut.
- Setiap logam tersusun atas atom-atom logam dan atom logam disusun oleh proton, elektron, dan neutron. Oleh lantaran sinar-X bergantung pada proton maka jumlah proton merupakan sifat khas suatu atom.
- Jumlah proton sebanding dengan nomor atom. Oleh lantaran itu, nomor atom menyatakan jumlah proton dalam atom dan bersifat khas untuk setiap atom. Nomor atom dilambangkan dengan Z.
Contoh Soal Hubungan Jumlah Proton, Elektron, dan Nomor Atom (3)
- Berapakah nomor atom besi jikalau jumlah proton dalam inti atom besi = 26?
- Berapakah jumlah elektron dalam atom natrium netral jikalau nomor atom natrium = 11?
Kunci Jawaban :
1. Nomor atom = jumlah proton
Oleh lantaran jumlah proton dalam atom besi = 26 maka nomor atom besi = 26
2. Nomor atom = jumlah proton
Dalam atom netral, jumlah proton = jumlah elektron Jadi, jumlah elektron dalam atom natrium = 11.
Berdasarkan hasil percobaan spektograf massa diketahui bahwa satu macam unsur terdiri atas atom-atom dengan massa berbeda.
Contoh :
Unsur karbon terdiri atas atom-atom dengan massa: 12, 13, 14. Ketiga bilangan ini dinamakan nomor massa dari atom karbon (nomor atomnya sama, yaitu 6). Di dalam atom hanya ada proton, elektron, dan neutron. Pada atom netral, jumlah proton sama dengan elektron. Oleh lantaran atom karbon hanya memiliki satu nomor atom maka yang membedakan massa atom adalah neutron.
Contoh Soal Hubungan Jumlah Proton, Elektron, dan Nomor Massa (4) :
- Berapa nomor massa atom karbon yang mempunyai jumah neutron = 7 dan jumlah elektron = 6?
- Berapa jumlah neutron dalam atom neon yang mempunyai nomor massa = 20 dan nomor atom = 10
1. Nomor massa = jumlah neutron + jumlah proton
Oleh lantaran atom netral maka jumlah proton = jumlah elektron
Sehingga sanggup ditulis:
nomor massa = jumlah neutron + jumlah elektron = 7 + 6 = 13
Jadi, nomor massa atom karbon = 13
2. Nomor massa = jumlah neutron + jumlah proton
Oleh lantaran jumlah proton = nomor atom
maka sanggup ditulis,
nomor massa = jumlah neutron + nomor atom
nomor massa = jumlah neutron + nomor atom
20 = n + 10, atau n = 10
Jadi, jumlah neutron dalam atom yaitu 10.
C. Isotop, Isobar, dan Isoton
Oleh lantaran atom-atom suatu unsur sanggup mempunyai jumlah neutron yang berbeda maka dibutuhkan suatu istilah untuk menyatakan hubungan nomor atom dan nomor massa atom-atom.
3.1. Isotop
Pada pembahasan sebelumnya, dijelaskan bahwa atom karbon memiliki nomor massa berbeda, sedangkan nomor atomnya sama. Untuk ketiga atom karbon itu dinamakan isotop. Isotop suatu atom memiliki sifat dan fisika yang sama.
Nomor atom dinyatakan dengan Z dan A menyatakan nomor massa. Jadi, isotop karbon sanggup ditulis sebagai  ;
;  ; dan
; dan 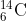 . Secara umum ditulis:
. Secara umum ditulis: 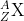 . Contoh lainnya yaitu oksigen yang mempunyai 3 isotop dengan nomor massa 16, 17, dan 18 (Gambar 7)
. Contoh lainnya yaitu oksigen yang mempunyai 3 isotop dengan nomor massa 16, 17, dan 18 (Gambar 7)
 |
| Gambar 7. Oksigen mempunyai 3 isotop dengan nomor massa 16, 17, dan 18 |
3.2. Isobar
Isobar yaitu atom-atom yang mempunyai nomor massa sama, tetapi nomor atom berbeda. Jadi, isobar merupakan kebalikan dari isotop. Isobar suatu atom mempunyai sifat kimia berbeda.
Contoh:
Contoh:
14N dan 14C memiliki nomor massa sama yakni 14, tetapi nomor atomnya berbeda. Atom N mempunyai nomor atom 7, sedangkan atom C mempunyai nomor atom 6. 40K dan 40Ca adalah tumpuan isobar yang lain. Berapakah nomor atom dan nomor massa dari kedua atom tersebut?
3.3. Isoton
Isoton yaitu atom-ataom yang mempunyai jumlah neutron sama, tetapi jumlah protonnya berbeda. Isoton suatu atom mempunyai sifat fisika dan kimia berbeda.
Contoh :
Contoh :
13C dan 14N. Kedua atom mempunyai jumlah neutron sama, yakni 7 buah neutron, tetapi jumlah protonnya berbeda. Masing-masing C = 6 dan N = 7.
Di laboratorium, pengukuran massa suatu zat memakai satuan gram. Bagaimanakah mengukur massa atom? Penentuan massa atom dilakukan dengan cara membandingkan massa atom yang akan ditentukan terhadap massa atom suatu unsur yang massanya ditetapkan (massa atom standar).
4.1. Standar Massa Atom
Standar massa atom yang kali pertama diberlakukan yaitu atom hidrogen, massanya ditetapkan sebesar 1,0 sma (satuan massa atom). Pada perkembangan selanjutnya, standar massa atom yaitu atom oksigen, yang massanya ditetapkan sebesar 16,0 sma.
Dengan berkembangnya teknologi dalam bidang instrumentasi, khususnya spektrometer massa, diketahui bahwa atom-atom suatu unsur dapat memiliki lebih dari satu macam isotop. Berdasarkan sifat-sifat isotop atom, ditetapkan bahwa standar massa atom yaitu isotop karbon yang massanya 12 sma. Alasannya, isotop karbon-12 merupakan isotop paling stabil. Penetapan isotop karbon-12 sebagai standar massa atom dibakukan oleh IUPAC (International Union of Pure and Applied Chemistry) pada 1961 dan didefinisikan sebagai:
Penentuan massa isotop atom-atom lain didasarkan pada nilai perbandingan terhadap massa atom isotop karbon-12. Jadi, massa atom isotop suatu unsur, contohnya isotop atom X sama dengan:
 |
| Gambar 8. Isotop |
4.2. Massa Atom Relatif
Dengan ditetapkannya massa isotop atom karbon-12 sebagai standar massa atom maka massa isotop atom unsur-unsur lain sanggup ditentukan secara eksperimen memakai spektrometer massa. Spektrometer massa memberikan data akurat wacana jumlah isotop atom suatu unsur dan kelimpahannya di alam. Contoh :
Pengukuran secara kimia terhadap massa atom karbon yaitu 12,0 sma. Oleh lantaran itu, pengukuran dengan spektrometer massa diharapkan menawarkan satu puncak spektrum di tempat 12,0 e/m. Fakta memperlihatkan bahwa karbon menawarkan tiga puncak pada data runutan spektrometer massa, yaitu pada tempat massa 12, 13, dan 14 sma dengan tinggi puncak memperlihatkan kelimpahan relatif masingmasing, yaitu 98,90%, 1,009% dan 0,001% menyerupai yang ditunjukkan pada Gambar 9.
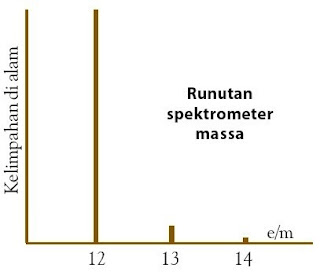 |
| Gambar 9. Tinggi puncak memperlihatkan persen kelimpahan isotop di alam. |
Berdasarkan data runutan spektrometer massa, karbon merupakan gabungan tiga macam isotop dengan sifat kimia yang sama, tetapi massa dan kelimpahannya di alam berbeda. Demikian pula unsur-unsur lain sanggup mempunyai isotop lebih dari satu dengan persen kelimpahan yang berbeda.
Permasalahan kini yaitu isotop mana yang akan dijadikan rujukan untuk mengukur massa zat di laboratorium. Oleh lantaran isotop-isotop suatu unsur tidak sanggup dipisahkan dalam suatu zat kimia juga kelimpahannya berbeda untuk setiap isotop maka perlu ditetapkan massa atom unsur untuk kepentingan pengukuran zat di laboratorium.
Menurut IUPAC, massa atom unsur ditentukan berdasarkan massa setiap isotop dan kelimpahannya. Penentuan dengan cara ini dinamakan massa atom relatif, disingkat Ar. Massa atom relatif (Ar) suatu unsur didefinisikan sebagai jumlah dari massa isotop dikalikan dengan kelimpahannya di alam.
Contoh:
Contoh:
Jika suatu unsur mempunyai n isotop: isotop-1, massanya m1 dengan kelimpahan Z1; isotop-2, massanya m2 dengan kelimpahan Z2; dan seterusnya maka massa atom relatif unsur tersebut ditentukan dengan persamaan berikut:
Oleh lantaran massa atom relatif sudah mempertimbangkan isotop dan kelimpahannya di alam maka untuk perhitungan dan pengukuran massa zat didasarkan pada massa atom relatifnya. Tabel berikut menunjukkan massa atom relatif unsur-unsur.
Tabel 2. Massa Atom Relatif Unsur-Unsur
Unsur | Massa Atom Relatif |
H | 1,008 |
Li | 6,975 |
C | 12,011 |
N | 14,006 |
O | 15,999 |
F | 18,998 |
Na | 22,989 |
Mg | 24,305 |
Al | 26,981 |
P | 30,974 |
Si | 28,080 |
Cl | 35,453 |
K | 39,091 |
Ca | 40,080 |
Br | 79,904 |
Contoh Soal Menghitung Massa Atom Relatif Unsur (5) :
Hasil analisis spektrometer terhadap unsur boron memperlihatkan bahwa unsur boron terdiri atas dus isotop, yaitu isotop 10B massanya 10,013 dengan kelimpahan 19,10% dan isotop 11B massanya 11,01 sma dengan kelimpahan 80,90% sma. Berapakah massa atom relatif boron?
Penyelesaian :
Ar atom = Σ(massa isotop X % kelimpahan)
Jadi, massa atom relatif (Ar) unsur boron yaitu 10,819.
E. Struktur Atom
Perkembangan pemahaman struktur atom sejalan dengan awal perkembangan ilmu Kimia modern. Ilmuwan pertama yang membangun model (struktur) atom yaitu John Dalton, kemudian disempurnakan secara sedikit demi sedikit oleh J.J. Thomson, Rutherford, dan Niels Bohr.
5.1. Model Atom Dalton
Teori atom Dalton didasarkan pada pengukuran kuantitatif reaksireaksi kimia. Dalton menghasilkan beberapa postulat sebagai berikut.
- Materi tersusun atas partikel-partikel sangat padat dan kecil yang tidak sanggup dipecah-pecah lagi. Partikel itu dinamakan atom.
- Atom-atom suatu unsur identik dalam segala hal, tetapi berbeda dengan atom-atom unsur lain.
- Dalam reaksi kimia, terjadi penggabungan atau pemisahan dan penataan ulang atom-atom dari satu komposisi ke komposisi lain.
- Atom sanggup bergabung dengan atom lain membentuk suatu molekul dengan perbandingan sederhana.
Kesimpulan dari model atom Dalton, yaitu unsur terdiri atas atom-atom yang sama dalam segala hal, baik bentuk, ukuran, dan massanya, tetapi berbeda dengan atom-atom unsur lain. Dengan kata lain, atom adalah partikel terkecil suatu unsur yang masih mempunyai sifat unsur itu.
 |
| Gambar 10. Model atom dan molekul Dalton |
5.2. Model Atom Thomson
Berdasarkan fakta bahwa elektron merupakan partikel dasar penyusun materi, mendorong Thomson membangun suatu model atom untuk menyempurnakan teori atom Dalton alasannya yaitu model atom Dalton tidak memperlihatkan adanya sifat-sifat listrik. Menurut Thomson, atom mengandung elektron yang bermuatan negatif dan elektron-elektron ini tersebar merata di dalam seluruh atom. Atomnya sendiri diasumsikan berupa bola pejal yang bermuatan positif.
Jika model atom Thomson ini digambarkan dalam bentuk tiga dimensi akan menyerupai makanan ringan anggun onde, bijih wijen menyatakan elektron dan onde menyatakan bentuk atom. Gambar 11 memperlihatkan model atom Thomson. Jika model atom Thomson dibelah dua maka elektron-elektron di dalam atom akan tampak menyerupai bijih jambu kerikil yang tersebar merata di dalam jambu.
 |
| Gambar 11. Model atom Thomson |
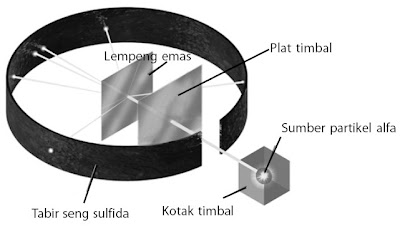
Rutherford melaksanakan percobaan penembakan lempeng emas yang sangat tipis dengan partikel alfa yang diemisikan oleh unsur radioaktif. Data hasil percobaan memperlihatkan bahwa sebagian besar dari partikel alfa sanggup melewati lempeng emas, tetapi hanya sebagian kecil partikel alfa yang dipantulkan kembali. Gambar 12 memperlihatkan diagram hamburan partikel alfa.
Berdasarkan data itu, Rutherford menyimpulkan bahwa volume atom sebagian besar berupa ruang kosong. Ini ditunjukkan oleh banyaknya partikel alfa yang sanggup melewati lempeng emas. Adanya partikel alfa yang dipantulkan akhir bertumbukan dengan suatu partikel yang sangat keras dengan ukuran sangat kecil. Rutherford menamakan partikel itu sebagai inti atom. Oleh lantaran partikel alfa bermuatan positif maka inti atom harus bermuatan positif. Jika inti atom bermuatan negatif maka akan terjadi tarik menarik antara inti atom dan partikel alfa.
 |
| Gambar 13. Model atom Rutherford |
Berdasarkan percobaan tersebut, Rutherford menyusun suatu model atom (perhatikan Gambar 13) untuk menyempurnakan model atom Thomson. Model yang dikembangkan oleh Rutherford yaitu sebagai berikut.
- Atom tersusun atas inti atom yang bermuatan positif dan elektron-elektron yang bermuatan negatif.
- Sebagian besar volume atom merupakan ruang kosong yang massanya terpusat pada inti atom.
- Oleh lantaran atom bersifat netral maka jumlah muatan positif harus sama dengan jumlah muatan negatif.
- Di dalam atom, elektron-elektron bermuatan negatif selalu bergerak mengelilingi inti atom.
Kelemahan Model Atom Rutherford
Seperti halnya model atom pendahulunya, teori atom Rutherford memiliki kelemahan. Kelemahan utama terletak pada pergerakan elektron dalam mengelilingi inti atom.
Menurut Hukum Fisika Klasik dari Maxwell, jikalau suatu partikel yang bermuatan listrik bergerak melingkar akan mengemisikan energinya dalam bentuk cahaya yang menyebabkan percepatan partikel semakin berkurang dan jadinya diam. Dengan demikian, jikalau elektron yang bermuatan negatif bergerak melingkar (mengelilingi inti bermuatan positif) maka akan kehilangan energinya sehingga gerakan elektron akan berkurang, yang jadinya akan jatuh ke inti. Gambar 14 menunjukkan model atom Rutherford berdasarkan teori Maxwell.
 |
| Gambar 14. Model atom Rutherford berdasarkan teori Maxwell |
Jadi, berdasarkan Hukum Fisika Klasik, model atom Rutherford tidak stabil alasannya yaitu elektron akan kehilangan energinya dan akan jatuh ke inti, pada jadinya atom akan musnah. Akan tetapi, faktanya atom stabil.
Ernest Rutherford
(1871-1937)
 |
| Rutherford menyimpulkan bahwa struktur atom terdiri atas elektron yang melingkar mengelilingi inti. |
Fakta apakah yang dijadikan dasar kesimpulan oleh Rutherford bahwa inti atom berukuran sangat kecil?
Kunci Jawaban :
Kesimpulan Rutherford didasarkan pada fakta bahwa dari sejumlah besar partikel alfa, hanya sebagian kecil yang dipantulkan. Hal ini memperlihatkan bahwa ukuran inti atom sangat kecil.
5.4. Model Atom Bohr
Pada 1913, pakar fisika Denmark, Niels Bohr menyatakan bahwa kegagalan model atom Rutherford sanggup disempurnakan dengan menerapkan Teori Kuantum dari Planck.
- Model atom Bohr dinyatakan dalam bentuk empat postulat berkaitan dengan pergerakan elektron, yaitu sebagai berikut.
- Dalam mengelilingi inti atom, elektron berada pada kulit (lintasan) tertentu. Kulit ini merupakan gerakan stasioner (menetap) dari elektron dalam mengelilingi inti atom dengan jarak tertentu.
- Selama elektron berada pada lintasan stasioner tertentu, energi elektron tetap sehingga tidak ada energi yang diemisikan atau diserap.
- Elektron sanggup beralih dari satu kulit ke kulit lain. Pada peralihan ini, besarnya energi yang terlibat sama dengan persamaan Planck, ΔE = h.
- Lintasan stasioner elektron mempunyai momentum sudut. Besarnya momentum sudut yaitu kelipatan dari nh/2π , dengan n adalah bilangan kuantum dan h yaitu tetapan Planck.
 |
| Gambar 15. Model atom Bohr menyempurnakan model atom Rutherford dalam hal kedudukan elektron di sekeliling inti atom |
Kulit atau lintasan elektron dalam mengelilingi inti atom dilambangkan dengan n = 1, n = 2, n = 3, dan seterusnya. Lambang ini dinamakan bilangan kuantum. Model atom Bohr ditunjukkan pada Gambar 15. Huruf K, L, M, dan seterusnya dipakai untuk menyatakan lintasan elektron dalam mengelilingi inti atom. Lintasan dengan n = 1 disebut kulit K, lintasan dengan n = 2 disebut kulit L, dan seterusnya.
Tabel 3. Lambang Kulit Elektron Atom Bohr
Kulit ke- | 1 | 2 | 3 | 4 |
Lambang | K | L | M | N |
Energi Keadaan Dasar dan Tereksitasi
Suatu atom dikatakan mempunyai energi terendah atau stabil jika elektronnya berada pada keadaan dasar. Keadaan dasar untuk atom hidrogen yaitu jikalau elektronnya berada pada kulit, n = 1. Keadaan di mana n > 1 bagi atom hidrogen dinyatakan tidak stabil, keadaan ini disebut keadaan tereksitasi. Keadaan ini terjadi apabila atom hidrogen menyerap energi sebesar ( Δn)hv. Pada keadaan tereksitasi, elektron yang kembali ke kulit semula disertai emisi energi sebesar ( Δn)hv. Ketika elektron kembali ke kulit yang lebih rendah akan terbentuk suatu spektrum. Perhatikan Gambar 16.
 |
| Gambar 16. Keadaan transisi elektron saat elektron dari keadaan tereksitasi dan kembali ke keadaan dasar, disertai emisi energi dalam bentuk radiasi cahaya menghasilkan spektrum. |
Gagasan Bohr wacana elektron mengelilingi inti atom dalam kulit-kulit tertentu serupa dengan sistem tata surya kita, gampang dipahami. Oleh lantaran itu, model atom Bohr sanggup diterima pada waktu itu.
Matahari
Maha besar Tuhan yang telah menciptakan Matahari yang merupakan sumber energi bagi setiap makhluk hidup. Cahaya Matahari ini terdiri atas semua spektrum cahaya. Gas pada permukaan Matahari menghasilkan cahaya Matahari dengan temperatur kira-kira 5.500 °C (sekitar 10.000 °F). Pada kepingan ini, elektron dalam atom didorong ke kulit yang lebih tinggi dan mengeluarkan cahaya begitu kembali ke keadaan dasar. (Sumber: Jendela IPTEK: Materi, 1997)
Contoh Soal Peralihan Tingkat Energi Elektron Menurut Model Atom Bohr (7) :
- Gambarkan peralihan tingkat energi elektron atom hidrogen dari keadaan dasar ke tingkat energi n = 3. Berapakah energi yang diserap oleh atom hidrogen?
- Gambarkan peralihan tingkat energi elektron atom hidrogen dari keadaan tereksitasi dengan n= 2 ke keadaan dasar. Berapakah energi yang dipancarkan oleh atom hidrogen?
Pembahasan :
- Atom hidrogen pada keadaan dasar mempunyai bilangan kuantum, n = 1. Jika beralih ke tingkat energi n = 3 maka atom hidrogen menyerap energi sebesar 2 hv.
- Peralihan tingkat energi dari keadaan tereksitasi (n=2) ke keadaan dasar (n=1) akan diemisikan energi sebesar hv.
Atom tersusun atas proton, neutron, dan elektron. Proton dan neutron terdapat dalam inti atom, sedangkan elektron selalu bergerak mengelilingi inti atom. Menurut Bohr, dalam mengelilingi inti atom, elektron berada pada kulit-kulit(lintasan) tertentu.
Pertanyaannya, bagaimanakah keberadaan elektron-elektron (banyak) di dalam atom? Apakah semua elektron pada atom berelektron banyak berada dalam satu kulit tertentu atau tersebar merata pada setiap kulit atau ada aturannya? Pertanyaan ini semua akan dijawab dalam konfigurasi elektron.
6.1. Konfigurasi Elektron
Nomor atom suatu unsur menyatakan jumlah proton dalam inti atom. Jika atom unsur itu bersifat netral secara listrik maka jumlah proton sama dengan jumlah elektron. Dengan demikian, nomor atom menyatakan jumlah elektron pada atom netral.
Elektron-elektron dalam atom berelektron banyak akan menghuni kulit berdasarkan aturan tertentu. Aturan ini dikembangkan berdasarkan hasil perhitungan secara kuantum. Berdasarkan hasil perhitungan, keberadaan elektron-elektron dalam atom menghuni kulit-kulit dengan aturan berikut.
- Kulit pertama maksimum dihuni oleh 2 elektron.
- Kulit kedua maksimum dihuni oleh 8 elektron.
- Kulit ketiga maksimum dihuni oleh 18 elektron.
- Kulit keempat maksimum dihuni oleh 32 elektron.
Kulit (n) | 1 | 2 | 3 | 4 | 5 |
Maksimum Jumlah Elektron | 2 | 8 | 18 | 32 | 50 |
Catatan :
Atom berelektron banyak adalah atom-atom yang mengandung dua elektron atau lebih, sedangkan atom hidrogen dikategorikan sebagai atom berelektron tunggal.
Contoh Soal Menentukan Konfigurasi Elektron Atom (8) :
- Tuliskan konfigurasi elektron atom neon (Ne) yang mempunyai nomor atom 10.
- Tuliskan konfigurasi elektron atom X dengan nomor atom 15.
Kunci Jawaban :
1. Nomor atom menyatakan jumlah proton. Pada atom netral, jumlah proton sama dengan jumlah elektron. Jadi, jumlah elektron atom neon = 10. Konfigurasi elektronnya adalah 10Ne = 2 8.
2. Jumlah elektron dari atom X sama dengan nomor atomnya, yaitu 15. Konfigurasi elektronnya adalah 15X = 2 8 5.
Bagaimanakah konfigurasi elektron untuk atom kalsium (Ca) dengan nomor atom 20? Perhatikan beberapa kemungkinan berikut.
a. 20Ca = 2 8 10
b. 20Ca = 2 8 8 2
c. 20Ca = 2 18
d. 20Ca = 2 8 18
Manakah di antara konfigurasi itu yang benar? Jawabannya yaitu b. Mengapa demikian?
Pada pengisian kulit M (untuk elektron ke-11 dan seterusnya), jikalau belum memenuhi jumlah maksimal (18 elektron) maka akan membentuk sub-sub kulit yang jumlahnya maksimal 8 elektron. Jadi, pada atom kalsium, sesudah mengisi kulit ke-2 dengan 8 elektron akan tersisa 10 elektron. Ke-10 elektron ini akan membentuk konfigurasi dengan 8 elektron dan 2 elektron. Perhatikan konfigurasi elektron beberapa unsur berikut.
Tabel 5. Konfigurasi Elektron Unsur Sesuai dengan Nomor Atom
Z | Lambang Unsur | Konfigurasi Elektron |
10 | Ne | 2 8 |
12 | Mg | 2 8 2 |
17 | Cl | 2 8 7 |
20 | Ca | 2 8 8 2 |
Contoh Soal Menentukan Konfigurasi Elektron Atom (9) :
- Tuliskan konfigurasi elektron atom kalium dengan nomor atom 19.
- Tuliskan konfigurasi elektron atom bromin dengan nomor atom 35.
Jawaban :
1. Kulit K dihuni 2 elektron; Kulit L dihuni 8 elektron.
Kulit M maksimal dihuni 18 elektron. Jika belum terisi penuh dengan 18 elektron maka kulit M akan membentuk sub-kulit maksimal dengan 8 elektron. Jadi, konfigurasi elektron atomnya adalah 19K = 2 8 8 1.
2. Kulit K dihuni 2 elektron; Kulit L dihuni 8 elektron; Kulit M dihuni 18 elektron; dan Kulit N maksimal dihuni 32 elektron. Jika kulit N belum terisi penuh maka akan membentuk sub-kulit maksimal dengan 18 atau 8 elektron. Jadi, konfigurasi elektron atomnya adalah 35Br = 2 8 18 7.
6.2. Elektron Valensi
Apakah yang dimaksud dengan elektron valensi? Elektron valensi yaitu elektron-elektron yang menghuni kulit terluar dari suatu atom, yaitu kulit yang paling jauh dari inti atom. Gambar 7 memperlihatkan elektron valensi suatu atom.
 |
| Gambar 17. Elektron-elektron valensi dari suatu atom |
Contoh Soal (10) :
Berapakah elektron valensi dari natrium? Konfigurasi elektron atom, 11Na= 2 8
Penyelesaian :
Kulit terluar dihuni 1 elektron. Jadi, elektron valensi dari natrium = 1.
Contoh Soal Menentukan Elektron Valensi Atom (11)
- Berapakah jumlah elektron valensi atom 8O ?
- Berapakah jumlah elektron valensi atom 17Cl ?
Kunci Jawaban :
1. Konfigurasi elektron atom 8O = 2 6
Jadi, elektron valensi atom O = 6
2. Konfigurasi elektron atom 17Cl = 2 8 7
Jadi, elektron valensi atom Cl = 7
Rangkuman :
- Atom dibangun oleh partikel-partikel subatom, yaitu proton, elektron, dan neutron. Keberadaan elektron kali pertama dibuktikan oleh Crookes melalui percobaan tabung sinar katoda. Muatan elektron pada atom sebesar –1,67 × 10–19 coulomb dan massa elektron sebesar 9,11 × 10–31 Kg.
- Proton kali pertama ditemukan oleh Goldstein melalui percobaan tabung sinar terusan. Muatan proton sama dengan muatan elektron, tetapi beda tanda, yaitu +1,67 × 10–19 coulomb dan massanya jauh lebih besar dari massa elektron (1,67 × 10–27 Kg).
- Neutron ditemukan oleh J.J. Chadwick melalui percobaan kamar kabut, massanya lebih besar sedikit dari massa proton, tetapi tidak bermuatan.
- Nomor atom (Z) suatu unsur memperlihatkan jumlah proton dalam inti atom unsur itu. Nomor massa (A) suatu atom memperlihatkan jumlah nukleon (proton dan neutron) yang terdapat dalam inti atom.
- Isotop atom suatu unsur mempunyai nomor atom sama, tetapi nomor massa berbeda. Isobar yaitu isotop-isotop atom yang mempunyai nomor massa sama, tetapi nomor atom berbeda. Isoton yaitu isotop-isotop atom yang mempunyai jumlah neutron sama, tetapi jumlah proton berbeda.
- Standar satuan massa atom mengalami perubahan, mulai dari atom hidrogen hingga isotop atom karbon-12. Satuan massa isotop karbon karbon-12 sama dengan 12 sma.
- Massa atom relatif suatu unsur (disingkat Ar) ditentukan berdasarkan pada jumlah perkalian antara massa atom isotop unsur dan kelimpahannya di alam.
- Struktur atom mengalami perkembangan berdasarkan kemampuannya dalam menjelaskan fakta atau tanda-tanda yang ditemukan di alam. Model atom kali pertama diajukan oleh Dalton, kemudian Thomson, Rutherford, dan Bohr.
- Berdasarkan model atom Rutherford dan Bohr, atom dibangun oleh inti atom dan elektron. Massa atom terpusat pada inti atom alasannya yaitu dalam inti atom terdapat proton dan neutron, sedangkan elektron berputar mengelilingi inti atom dengan jarak tertentu dari inti. Lintasan-lintasan elektron dalam mengelilingi inti atom dinamakan kulit.
- Elektron dalam atom berada dalam kulit-kulit dengan jarak tertentu dari inti atom. Jumlah maksimum elektron dalam suatu kulit dinyatakan dengan rumus 2n2, n yaitu kulit ke-n dari inti.
Anda kini sudah mengetahui Struktur Atom. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Sunarya, Y. dan A. Setiabudi. 2009. Praktis dan Aktif Belajar Kimia 1 : Untuk Kelas X Sekolah Menengah Atas / Madrasah Aliyah. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 226.

No comments:
Post a Comment