Pengertian Kecepatan Reaksi Kimia, Rumus, Contoh Soal, Faktor, Tingkat, Teori Tumbukan, Energi Pengaktifan, Aplikasi, Pembahasan - Salah satu kajian utama dalam ilmu Kimia setelah termodinamika (termokimia) dan struktur (bentuk molekul dan sifat-sifatnya) yaitu kinetika reaksi (kecepatan reaksi). Jika dalam termokimia mempelajari kekerabatan energi dan reaksi maka kinetika mengkaji prosedur reaksi (proses). Mekanisme reaksi sifatnya teoritis, yang perlu dibuktikan kebenarannya melalui kajian kecepatan reaksi. Kecepatan reaksi sendiri mengkaji kekerabatan antara reaksi dan waktu untuk memilih orde reaksi. Berdasarkan orde reaksi ini, prosedur suatu reaksi sanggup diterima kebenarannya.
Apakah pengertian kecepatan reaksi? Kecepatan reaksi sama dengan laju reaksi. Faktor-faktor apa sajakah yang menghipnotis kecepatan reaksi? Apakah faktor-faktor penentu kecepatan dan orde reaksi? Anda sanggup menjawab pertanyaan-pertanyaan tersebut kalau Anda mempelajari belahan ini secara seksama.
A. Kecepatan Reaksi
Sifat-sifat suatu materi sanggup dipelajari berdasarkan strukturnya (bentuk molekul). Besarnya energi yang terlibat dalam suatu reaksi sanggup diketahui dari kajian termokimia. Bagaimana dengan tingkat reaksi? Berapakah usang waktu yang diharapkan oleh suatu reaksi? Ini hanya sanggup diketahui dengan mempelajari kecepatan reaksi (rate of reaction).
1.1. Kemolaran (Konsentrasi Larutan)
Sebelum membahas kecepatan reaksi, terlebih dahulu Anda akan dikenalkan dengan satuan konsentasi larutan yang digunakan dalam kecepatan reaksi. Satuan yang dimaksud yaitu kemolaran. Kemolaran yaitu satuan konsentrasi larutan untuk menyatakan jumlah mol zat terlarut per liter larutan, dilambangkan dengan M. Secara matematika, kemolaran sanggup diungkapkan dengan persamaan berikut.
Kemolaran larutan (M) = jumlah mol zat terlarut / jumlah liter larutan = mol / liter
Contoh Soal Menghitung Kemolaran Larutan :
Sebanyak 58,5 g NaCl dilarutkan dalam air sehingga volume larutan menjadi 500 mL. Berapakah kemolaran larutan NaCl?
Diketahui Mr NaCl = 58,5
Pembahasan :
Ubah satuan berat (g) ke dalam mol, kemudian hitung kemolaran larutannya.
Jumlah mol NaCl = 58,5g / 58,5 gmol-1 = 1 mol
Kemolaran larutan = (1 mol / 500 mL) x (1.000 mL / liter) = 2 mol L–1
Jika pembilang dan penyebut pada persamaan tersebut dibagi oleh faktor 1.000, nilai kemolaran larutan tidak berubah, tetapi satuannya yang berubah. Satuan mol/1.000 yaitu milimol (mmol) dan satuan liter/ 1.000 yaitu mililiter (mL). Jadi, kemolaran sanggup dinyatakan sebagai berikut.
Kemolaran = mol / liter = mmol / mL
1.2. Pengertian Kecepatan Reaksi
Anda tentu pernah mendengar bom meledak atau besi berkarat. Ledakan bom berlangsung begitu cepat hingga orang-orang di sekitarnya tidak sempat menghindar. Sebaliknya, pengaratan besi sukar diamati secara pribadi disebabkan reaksinya berlangsung sangat lambat.
Apakah yang dimaksud dengan kecepatan reaksi? Dalam ilmu Fisika (kinematika), Anda telah mencar ilmu kecepatan, yaitu perubahan jarak per satuan waktu, v = Δx/Δt, . Dalam ilmu Kimia, kecepatan reaksi didefinisikan sebagai perubahan konsentrasi molar pereaksi atau hasil reaksi per satuan waktu.
Jika Anda melaksanakan reaksi, akan tampak bahwa konsentrasi molar pereaksi berkurang, sedangkan konsentrasi molar hasil reaksi bertambah hingga semua pereaksi habis. Perubahan konsentrasi molar pereaksi dan hasil reaksi akan tampak menyerupai pada Gambar 1. kalau dialurkan ke dalam bentuk grafik. Baik pereaksi maupun hasil reaksi berubah secara eksponensial.
 |
| Gambar 1. Kurva perubahan konsentrasi terhadap waktu. |
Perhatikan reaksi berikut.
A + B → X
Laju reaksinya sanggup dinyatakan dalam rumus berikut.
Kecepatan = 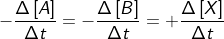
Δ[A] dan Δ[B] menyatakan perubahan konsentrasi molar pereaksi; Δ[X] menyatakan perubahan konsentrasi molar hasil reaksi; Δt menyatakan rentang waktu reaksi. Tanda negatif memperlihatkan bahwa konsentrasi pereaksi berkurang, tanda positif memperlihatkan konsentrasi hasil reaksi bertambah.
Satuan untuk kecepatan reaksi yaitu kemolaran per satuan waktu (M M s–1). Untuk sistem gas, kecepatan reaksi sanggup dinyatakan dalam satuan tekanan parsial per satuan waktu, yaitu atm s–1 atau mmHg s–1.
1.3. Jenis Perubahan Konsentrasi Reaksi per Satuan Waktu (Rate of Reaction)
Dalam ilmu Fisika dikenal kecepatan (velocity) dan laju (speed). Dalam ilmu Kimia, juga dikenal dua jenis rate of reaction, yaitu laju reaksi dan kecepatan reaksi. Laju reaksi yaitu perubahan konsentrasi molar zat-zat yang bereaksi pada setiap waktu (laju reaksi sesaat), sedangkan kecepatan reaksi yaitu perubahan konsentrasi molar zat-zat yang bereaksi pada selang waktu tertentu (laju reaksi rata-rata).
Untuk sanggup membedakan kecepatan reaksi dan laju reaksi, Anda sanggup menyimak data hasil penguraian N2O5 pada Tabel 1. Reaksinya:
2N2O5(g) → 4NO2(g) + O2(g)
Tabel 1 Data Penguraian N2O5
t(s, detik) | N2O5 Terurai (mol L–1) | Laju Reaksi (mol L–1 s–1) | Kecepatan Reaksi (mol L–1 s–1) |
0 | 2,33 | 1,42 × 10–3 | 1,44 × 10–3 |
180 | 2,07 | 1,27 × 10–3 | |
320 | 1,90 | 1,17 × 10–3 | 1,07 × 10–3 |
525 | 1,68 | 1,02 × 10–3 | |
860 | 1,35 | 0,83 × 10–3 | 0,71 × 10–3 |
1200 | 1,11 | 0,68 × 10–3 |
a. Laju Reaksi
Dalam ilmu Kimia laju reaksi memperlihatkan gosip ihwal perubahan konsentrasi reaksi setiap waktu. Perubahan konsentrasi pereaksi atau hasil reaksi sanggup diukur setiap saat, contohnya setiap detik, setiap menit, setiap jam, dan seterusnya. Jika data pada Tabel 1. diubah ke dalam bentuk grafik, laju reaksi membentuk kurva eksponensial (lihat Gambar 2).
 |
| Gambar 2. Contoh kurva perubahan konsentrasi N2O5 terhadap waktu. |
b. Kecepatan Reaksi
Reaksi penguraian N2O5 dapat diungkapkan dalam bentuk kecepatan reaksi sebagai berikut:
Kecepatan = 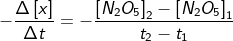
Oleh lantaran konsentrasi pereaksi menurun sejalan dengan waktu maka {[N2O5]2 – [N2O5]1} berharga negatif, tetapi lantaran persamaan berharga negatif maka kecepatan reaksi menjadi positif. Simak Tabel 4.1, kecepatan reaksi antara rentang waktu ke-320 detik dan ke-525 detik dengan konsentrasi [N2O5] masing-masing 1,90 M dan 1,68 M sebagai berikut.
Kecepatan = 
Kecepatan reaksi penguraian N2O5 dan pembentukan O2 dapat dihubungkan melalui rasio stoikiometri.
Contoh:
Jika dua mol N2O5 terurai membentuk satu mol O2 maka kecepatan penguraian N2O5 dua kali pembentukan O2. Untuk menyetarakannya, kecepatan penguraian N2O5 harus dibagi dua.
c. Variabel-Variabel Kecepatan Reaksi
Untuk mengukur kecepatan reaksi, Anda harus memutuskan dulu variabel-variabel penyelidikannya, menyerupai variabel bebas (besaran yang akan diselidiki), variabel terikat (besaran yang bergantung pada variabel bebas), dan variabel kontrol (besaran yang harus dikendalikan).
Contoh:
Anda berencana menyidik imbas suhu terhadap laju penguraian H2O2, referensi set alat percobaan sanggup dilihat pada Gambar 3.
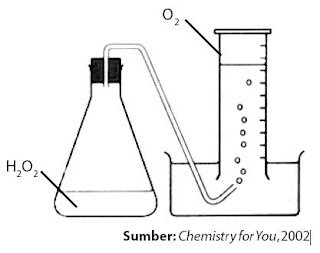 |
| Gambar 3. Percobaan sederhana untuk mengukur reaksi penguraian H2O2 pada suhu kamar. |
Persamaan reaksinya :
H2O2(l) → H2O(l) + ½ O2(g)
Manakah variabel bebas, variabel terikat, dan variabel kontrolnya?
Oleh lantaran Anda ingin mengetahui imbas suhu terhadap penguraian H2O2 maka suhu ditetapkan sebagai variabel bebas. Dalam hal ini, Anda bebas memilih suhu reaksi, contohnya reaksi dilakukan pada 30 °C, 40 °C, 60 °C, dan seterusnya. Besaran lainnya, menyerupai jumlah mol H2O2 dan konsentrasi molar H2O2 harus dikendalikan atau dibentuk tetap. Besaran-besaran ini dinamakan sebagai variabel kontrol.
Bagaimana memilih variabel terikat? Variabel terikat yaitu besaran yang sanggup diamati dan terukur, nilainya bergantung pada variabel bebas. Untuk sanggup memilih variabel terikat, Anda harus mengetahui jenis dan sifat reaksi yang terjadi biar sanggup memilih indikator terjadinya reaksi dan dijadikan sebagai variabel terikat.
Dalam reaksi kimia, ada beberapa fenomena yang sanggup dijadikan indikator, menyerupai perubahan warna, perubahan suhu, pembentukan gas, dan pembentukan endapan. Dalam reaksi penguraian H2O2, terbentuk gas O2 maka pembentukan gas O2 dapat dijadikan sebagai indikator. Oleh lantaran indikator terjadinya reaksi berupa gas maka tekanan atau volume gas O2 dapat dijadikan variabel terikat.
Setelah semua variabel ditetapkan, selanjutnya Anda menciptakan tabel untuk menuliskan data hasil pengamatan (lihat Tabel 2). Dalam tabel tersebut, sanggup juga dicantumkan konsentrasi H2O2 terurai, yang ditentukan melalui perhitungan.
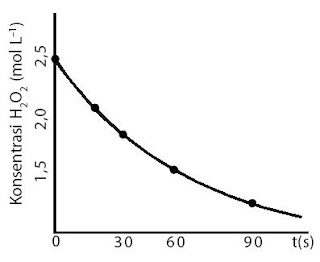 |
| Gambar 4. Contoh kurva penguraian H2O2 pada 40 °C. |
Untuk tujuan analisis, data tersebut sanggup dikonversikan ke dalam bentuk grafik yang menyatakan kekerabatan antara waktu reaksi dan konsentrasi molar O2 yang terbentuk atau konsentrasi H2O2 yang terurai menyerupai pada Gambar 4.
Tabel 2. Contoh Data Pengamatan Reaksi Penguraian H2O2 pada 40 °C
t/detik | Vo2 (mL) | [H2O2] | |
0 | 0 | 2,5 M | |
30 | |||
10 | |||
60 | |||
18 | |||
90 |
B. Faktor-Faktor yang Mempengaruhi Kecepatan Reaksi
Perubahan konsentrasi pereaksi per satuan waktu sanggup dimanipulasi biar lebih cepat atau lebih lambat, bahkan reaksi dihentikan. Untuk melaksanakan manipulasi kecepatan reaksi, Anda perlu mengetahui faktor-faktor apa yang sanggup memengaruhi kecepatan sutau reaksi. Faktor-faktor tersebut yaitu konsentrasi pereaksi, luas permukaan zat-zat yang bereaksi, suhu reaksi, dan katalisator.
2.1. Konsentrasi Pereaksi
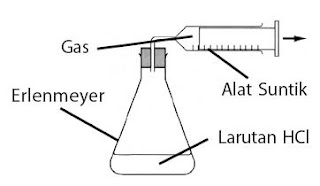
Jika dalam suatu reaksi, konsentrasi molar salah satu pereaksi diperbesar atau diperkecil, bagaimana pengaruhnya terhadap kecepatan reaksi? Untuk menjawab kasus ini, Anda sanggup melaksanakan penyelidikan sebagai berikut.
Praktikum Kimi Mengetahui Pengaruh Konsentrasi terhadap Kecepatan Reaksi :
Tujuan :
Mempelajari imbas konsentrasi terhadap kecepatan reaksi.
Alat :
- Erlenmeyer
- Gabus
- Timbangan
- Gelas ukur 250 mL
- Selang karet
- Stopwatch
- Alat suntik 20 mL
Bahan :
- Na2CO3
- Larutan HCl 0,5 M
Langkah Kerja :
- Susunlah peralatan menyerupai pada gambar di atas.
- Masukkan 100 mL HCl 0,5 M ke dalam erlenmeyer.
- Masukkan 1 gram Na2CO3 ke dalam erlenmeyer, segera tutup erlenmeyer dan mulailah menghitung waktu reaksi.
- Hentikan pengukuran waktu setelah terkumpul 10 mL gas.
- Ulangi percobaan dengan memakai 2 g, 3 g, dan 4 g Na2CO3.
- Masukkan data ke dalam tabel berikut.
Berat Na2CO3 (gram) | Konsentrasi Na2CO3 (M) | Waktu |
1. … 2. … 3. … | ................................. ................................. ................................. | ................................. ................................. ................................. |
Pertanyaan :
- Apakah yang sanggup dijadikan indikator reaksi?
- Apakah yang menjadi variabel bebas, variabel terikat, dan variabel kontrol pada reaksi?
- Komposisi manakah yang membebaskan 10 mL gas tercepat?
- Apakah yang sanggup Anda simpulkan dari percobaan ini? Diskusikan dengan teman sekelas Anda.
2.2. Luas Permukaan Sentuh
Apakah yang dimaksud dengan luas permukaan? Untuk mengetahui ini, Anda sanggup mencitrakan luas permukaan bola. Berbeda dengan luas permukaan bola, yang dimaksud dengan luas permukaan dalam reaksi kimia yaitu luas permukaan zat-zat pereaksi yang bersentuhan untuk menghasilkan reaksi (perhatikan Gambar 5).
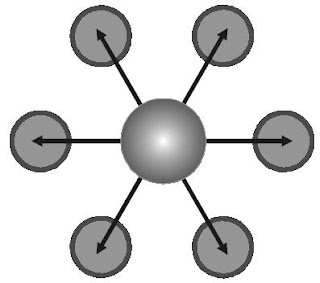 |
| Gambar 5. Bidang sentuh butiran zat padat dalam larutan. |
Dalam reaksi kimia, tidak semua luas permukaan zat yang bereaksi sanggup bersentuhan hingga terjadi reaksi, hal ini bergantung pada bentuk partikel zat-zat yang bereaksi. Untuk mengetahui imbas luas permukaan pereaksi suatu zat padat terhadap kecepatan reaksi sanggup dilakukan penyelidikan berikut.
Praktikum Kimia Mengetahui Pengaruh Luas Permukaan terhadap Kecepatan Reaksi :
Tujuan :
Mempelajari imbas konsentrasi terhadap kecepatan reaksi.
Alat :
- Gelas Kimia 500 mL
- Gelas ukur 250 mL
- Stopwatch
- Timbangan
- Pisau
- Batang pengaduk
Bahan :
- Kapur tulis (CaCO3)
- Larutan HCl 0,5 M
Langkah Kerja :
- Masukkan masing-masing 250 mL HCl 0,5 M ke dalam dua gelas kimia.
- Ke dalam gelas kimia pertama masukkan 2 gram CaCO3 dalam bentuk batangan. Hitung waktu yang diharapkan biar semua CaCO3 larut.
- Ke dalam gelas kimia kedua masukkan 25 gram CaCO3 yang telah dihaluskan (dipotong-potong). Hitung waktu yang diharapkan biar semua CaCO3 larut.
Pertanyaan :
- Bentuk CaCO3 manakah yang luas permukaannya lebih besar?
- Pada gelas manakah CaCO3 lebih gampang larut?
- Apakah yang sanggup Anda simpulkan dari percobaan ini? Diskusikan dengan teman sekelas Anda.
Simak kubus pada Gambar 6. yang panjang sisinya 5 cm, kemudian Anda pecah-pecah menjadi delapan buah kubus dengan ukuran masing-masing sama, yaitu panjang sisinya 2,5 cm. Berapakah luas permukaan kubus sebelum dan sehabis dipecah-pecah?
 |
| Gambar 6. Untuk total volume yang sama, semakin kecil kubus semakin besar luas permukaannya. |
Sebelum dipecah, luas permukaan kubus sebesar 6 muka × luas muka (150 cm2). Setelah dipecah menjadi 8 bagian, luas permukaan kubus menjadi 8 kubus × 6 muka × luas muka (300 cm2). Jadi, semakin kecil (halus) ukuran butiran zat padat, semakin besar luas permukaannya. Akibatnya, peluang untuk terjadinya reaksi semakin besar.
2.3. Suhu Sistem Reaksi
Apakah suhu besar lengan berkuasa terhadap kecepatan reaksi? Untuk mengetahui hal ini, lakukanlah penyelidikan berikut.
Praktikum Kimia Mengetahui Pengaruh Suhu Reaksi terhadap Kecepatan Reaksi :
Tujuan
Mempelajari imbas suhu reaksi terhadap kecepatan reaksi.
Alat :
- Tabung reaksi
- Pembakar spiritus/alkohol
- Gelas kimia 500 mL
- Gelas ukur 250 mL
- Termometer
- Kawat kassa
- Kaki tiga dan kasa
Bahan :
- Larutan KMnO4 0,01 M
- Larutan C2H2O4 0,5 M
- Air
Langkah Kerja :
- Panaskan 250 mL air dalam gelas kimia hingga 30°C (penangas air).
- Dalam tabung reaksi, campurkan 5 mL larutan C2H2O4 0,5 M dengan 1 mL larutan KMnO4 0,05 M.
- Masukkan tabung reaksi tersebut ke dalam penangas air.
- Amati perubahan yang terjadi dan catat semua data .
- Ulangi percobaan memakai penangas air dengan suhu 40 °C dan 50 °C.
Suhu Uji (°C) | Indikator Reaksi | Waktu Reaksi (detik) | Kecepatan Reaksi (kualitatif) |
30 40 50 | .................... .................... .................... | ...................... ...................... ...................... | ......................... ......................... ......................... |
Pertanyaan :
- Perubahan apakah yang terjadi dalam reaksi tersebut?
- Pada percobaan tersebut, besaran apakah yang sanggup dijadikan variabel bebas, variabel terikat, dan variabel kontrolnya?
- Dari ketiga reaksi, reaksi manakah yang mempunyai kecepatan reaksi terbesar?
- Jika data hasil percobaan Anda dibentuk ke dalam grafik yang menyatakan kekerabatan suhu dan laju, perkirakan kecepatan reaksi pada suhu 60°C.
- Apakah yang sanggup Anda simpulkan dari percobaan tersebut? Diskusikan dengan teman sekelas Anda.
Reaksi asam oksalat (C2H2O4) dan KMnO4 merupakan reaksi redoks.
Persamaan reaksinya:
3C2H2O4(aq) + 2KMnO4(aq) → 2MnO2(s)+2H2O(l) + 6CO2(g) + 2KOH
Sebagai indikator terjadinya reaksi, sanggup diukur dari pembentukan gas atau perubahan warna larutan KMnO4, tetapi yang paling gampang diamati yaitu perubahan warna dari ungu menjadi tidak berwarna. Berdasarkan data hasil penyelidikan, sanggup disimpulkan bahwa semakin tinggi suhu, reaksi berlangsung semakin cepat. Umumnya, kenaikan suhu 10 °C sanggup mempercepat reaksi dua kali lipat.
Contoh Soal (UNAS 2005) :
Di antara data kondisi reaksi berikut.
No. | Seng | [HCl] | Suhu |
1 | Serbuk | 0,1 M | 35 |
2 | Serbuk | 0,1 M | 45 |
3 | Lempeng | 0,2 M | 25 |
4 | Serbuk | 0,2 M | 45 |
5 | Lempeng | 0,2 M | 45 |
Manakah yang laju reaksinya paling rendah?
A. 1
B. 2
C. 3
D. 4
E. 5
Pembahasan :
Laju reaksi dipengaruhi oleh faktor:
- luas permukaan: zat berupa serbuk lajunya semakin besar.
- konsentrasi: konsentrasi semakin tinggi lajunya semakin besar.
- suhu: suhu semakin tinggi lajunya semakin besar.
Jadi, laju reaksi paling rendah yaitu zat yang berupa lempeng dengan suhu yang paling rendah. Jadi, jawabannya (C)
2.4. Katalisator
Untuk mempercepat laju reaksi, sanggup dilakukan dengan cara meningkatkan konsentrasi pereaksi atau suhu reaksi, tetapi adakala cara ini kurang efisien. Misalnya, sintesis gas NH3 dari gas N2 dan gas H2, reaksi ini berlangsung pada suhu sekitar 450 °C. Jika suhu terlalu rendah, reaksi berlangsung sangat lambat.
 |
| Gambar 7. Reaksi yang terlalu usang sanggup membosankan sehingga perlu ditambah katalis. |
Reaksi pada suhu tinggi kurang menguntungkan secara ekonomi alasannya yaitu memerlukan peralatan khusus dan pemeliharaannya sukar. Adakah cara lain selain metode yang telah dibahas sebelumnya? Jawabannya ada, yaitu dengan menambahkan katalisator.
Apa dan bagaimana kerja katalis dalam mempercepat reaksi? Katalis yaitu zat yang ditambahkan dalam jumlah sedikit ke dalam suatu sistem reaksi untuk mempercepat reaksi. Pada selesai reaksi, katalis diperoleh kembali dalam bentuk zat semula. Katalis bekerja dengan cara turut terlibat dalam setiap tahap reaksi, tetapi pada selesai tahap, katalis terbentuk kembali.
Jika suatu adonan zat tidak sanggup bereaksi, penambahan katalispun tidak akan menciptakan reaksi terjadi. Dengan kata lain, katalis tidak sanggup memicu reaksi, tetapi hanya membantu reaksi yang berlangsung lambat menjadi lebih cepat.
Katalis bekerja secara khusus. Artinya, tidak semua reaksi sanggup dipercepat dengan satu macam katalis. Dengan kata lain, katalis bekerja hanya pada satu atau dua macam reaksi, tetapi untuk reaksi yang lain tidak sanggup digunakan. Untuk mengetahui peranan katalis dalam mempercepat reaksi sanggup dilakukan penyelidikan sebagai berikut.
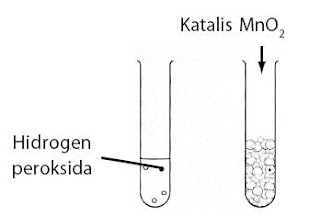
Praktikum Kimia Mengetahui Pengaruh Katalis terhadap Kecepatan Reaksi :
Tujuan :
Mempelajari imbas penambahan terhadap kecepatan reaksi penguraian H2O2.
Alat :
- Tabung reaksi
- Gelas ukur 10 mL
- Pipet tetes
Bahan :
- Larutan H2O2 3%
- MnO2
- Larutan sabun
Langkah Kerja :
- Campurkan 4 mL larutan H2O2 3% dan 1 tetes sabun cair ke dalam tabung reaksi. Kocok dan amati perubahan yang terjadi.
- Lakukan menyerupai cara sebelumnya, kini tambahkan sedikit serbuk MnO2. Amati perubahan yang terjadi.
Pertanyaan :
- Apakah terjadi perubahan setelah reaksi berlangsung? Apakah yang sanggup dijadikan indikator berlangsungnya reaksi.
- Bandingkan hasil pengamatan antara reaksi dengan MnO2 dan tanpa MnO2. Manakah reaksi yang berlangsung lebih cepat?
- Apakah yang sanggup Anda simpulkan dari percobaan tersebut?
Contoh Soal SPMB 2005 :
Percobaan yang dilakukan untuk mempelajari kinetika kimia dari reaksi A + B → C + D. Memperhatikan hasil reaksi berikut:
Dari hasil percobaan tersebut sanggup disimpulkan bahwa persamaan kecepatan reaksi yang sesuai yaitu ....
A. laju = k [A] [B]
B. laju = k [A]2 [B]
C. laju = k [A] [B]2
D. laju = k [A]1
E. laju = k [B]2
Penyelesaian :
Mencari orde A, percobaan 1 dan 3
m = 0
mencari orde B, percobaan 3 dan 4
4n = 16
n = 2
Jadi, persamaan kecepatan reaksinya:
v = k [B]2
Jadi, jawabannya (E).
2.5. Jenis Katalis
Berdasarkan jenis fasanya, katalis digolongkan ke dalam katalis homogen dan katalis heterogen. Katalis homogen yaitu katalis yang mempunyai fasa yang sama dengan pereaksi. Katalis heterogen yaitu katalis yang berbeda fasa dengan pereaksi. Katalis homogen bekerja melalui interaksi dengan partikel pereaksi membentuk keadaan transisi. Selanjutnya, keadaan transisi bergabung dengan pereaksi lain membentuk produk, dan setelah produk dihasilkan katalis melaksanakan regenerasi menjadi zat semula.
Katalis heterogen biasanya berupa padatan yang bekerja pada pereaksi berupa gas atau cairan, dan reaksi katalisis terjadi pada permukaan katalis. Untuk alasan ini, katalis biasanya dipecah-pecah menjadi butiran halus. Mengapa demikian? Coba jelaskan dengan kalimat sendiri.
C. Kecepatan Reaksi dan Tingkat Reaksi
Persamaan kecepatan reaksi selalu ditentukan secara eksperimen. Orde reaksi selalu ditentukan dari konsentrasi pereaksi (bukan konsentrasi produk).
Persamaan kecepatan reaksi yang diungkapkan sebelumnya masih dalam bentuk persamaan diferensial, yaitu:
ΔC/Δt atau dx/dt
Persamaan ini sanggup dinyatakan dalam bentuk sederhana yang memperlihatkan kekerabatan kecepatan reaksi dan konsentrasi molar pereaksi.
3.1. Persamaan Kecepatan Reaksi
Berdasarkan hasil penyelidikan, diketahui bahwa kecepatan reaksi dipengaruhi oleh konsentrasi pereaksi. Semakin tinggi konsentrasi pereaksi, semakin cepat reaksi berlangsung. Bagaimana kekerabatan konsentrasi pereaksi dan kecepatan reaksi?
Jika terjadi reaksi: xA + yB → zC maka kecepatan reaksi berbanding lurus dengan konsentrasi pereaksi dipangkatkan dengan bilangan tertentu yang sama dengan koefisien reaksinya. Oleh lantaran itu, kecepatan reaksi tersebut sanggup dinyatakan dengan persamaan berikut.
v = [A]m [B]n
atau,
v = k [A]m [B]n
[A] dan [B] menyatakan konsentrasi molar pereaksi, k menyatakan tetapan kesetaraan, eksponen m dan n dinamakan orde atau tingkat reaksi.
Persaman tersebut dinamakan persamaan kecepatan reaksi atau aturan kecepatan reaksi, yaitu persamaan yang menyatakan kekerabatan antara kecepatan reaksi dan konsentrasi molar pereaksi dipangkatkan tingkat reaksi atau orde reaksinya.
Tetapan kesetaraan (k) bergantung pada macam pereaksi dan suhu reaksi. Untuk reaksi yang sama, harga k tetap selama suhu reaksi tidak berubah. Jika suhu atau pereaksi berubah, harga k juga berubah.
Kecepatan reaksi digolongkan berdasarkan tingkat reaksinya. Untuk reaksi tersebut, tingkat reaksi untuk zat A yaitu m dan tingkat reaksi untuk B yaitu n. Tingkat reaksi keseluruhan yaitu (m + n). Sebagaimana dinyatakan sebelumnya, tingkat reaksi tidak ada hubungannya dengan koefisien reaksi. Oleh lantaran itu, tingkat reaksi tidak sanggup ditentukan dari koefisien reaksi, tetapi harus ditentukan dari hasil penyelidikan. Beberapa persamaan kecepatan dan tingkat reaksi yang diperoleh dari data hasil penyelidikan ditunjukkan pada Tabel 3.
Tabel 3. Beberapa Persamaan Kecepatan Reaksi
Persamaan Reaksi | Persamaan Kecepatan | Orde Reaksi | Penjelasan |
2NH3(g) → N2(g) + 3H2(g) | v = k [NH3]0 | Nol | Laju reaksi tidak bergantung pada konsentrasi NH3 |
2CO2(g) → 2CO(g) + O2(g) | v = k [CO2] | Satu | Koefisien reaksi ≠ orde reaksi |
2HI (g) → H2(g) + I2(g) | v = k [HI]2 | Dua | Koefisien reaksi = orde reaksi |
2NO(g) + 2H2(g) → N2(g) + 2H2O(g) | v = k [NO]2 [H2] | Tiga | Koefisien reaksi ≠ orde reaksi |
2SO2(g) + O2(g) → 2SO3(g) | v= k [SO2] [O2] ½ | Satu setengah | Koefisien reaksi ≠ orde reaksi |
3.2. Penentuan Persamaan Kecepatan Reaksi
Terdapat dua metode yang sanggup dikembangkan untuk memilih perubahan konsentrasi pereaksi per satuan waktu, yaitu metode diferensial dan metode integral. Metode diferensial mempunyai kegunaan untuk memilih tingkat reaksi, sedangkan metode integral mempunyai kegunaan untuk mengevaluasi tingkat reaksi.
Metode integral didasarkan pada pengukuran reaksi setiap saat. Data yang terkumpul selanjutnya dievaluasi dengan persamaan integral yang dimodifikasi ke dalam bentuk grafik. Kemudian, ditentukan apakah reaksi tersebut tingkat satu, tingkat dua, atau tingkat tertentu. Mengingat metode integral memerlukan pemahaman matematika, khususnya integral yang memadai maka tidak diberikan di sini.
Metode diferensial disebut juga metode laju awal atau metode laju rata-rata. Metode ini didasarkan pada perubahan konsentrasi pereaksi dalam selang waktu tertentu. Dengan kata lain, metode diferensial yaitu metode untuk memilih tingkat reaksi atau kecepatan reaksi. Dalam praktiknya, penentuan kecepatan reaksi didasarkan pada konsentrasi awal pereaksi yang berbeda secara beraturan, sedangkan selang waktu reaksi dibentuk tetap. Simak reaksi berikut: A → produk.
Persamaan kecepatan reaksinya sanggup ditulis: v = k [A]x. Nilai x ditentukan dari hasil penyelidikan memakai metode laju awal. Untuk memilih tingkat reaksi diharapkan sekurang-kurangnya tiga kali pengukuran dengan konsentrasi awal berbeda dalam selang waktu yang dibentuk tetap. Data hasil pengukuran kemudian ditabulasikan ke dalam tabel, contohnya sebagai berikut.
Tabel 4. Contoh Data Hasil Pengukuran Kecepatan Reaksi Hipotetik A → Produk
Percobaan | [A] awal (mol L–1) | Waktu Reaksi (detik) | Kecepatan Reaksi (mol L–1 s–1) |
1 | a | 30 | v |
2 | 2a | 30 | 4v |
3 | 4a | 30 | 16v |
Setelah data ditabulasikan ke dalam tabel, selanjutnya masing-masing kecepatan dibandingkan, contohnya :  ,
,  , atau
, atau  .
.
Contoh :
Jadi, tingkat reaksinya sama dengan 2. Oleh lantaran itu, persamaan untuk kecepatan reaksi hipotetik di atas sanggup ditulis sebagai: v = k [A]2 .
Contoh Soal Menentukan Persamaan Kecepatan Reaksi :
Kalium iodida direaksikan dengan natrium hipoklorit berdasarkan persamaan:
KI(aq) + NaOCl(aq) → KIO(aq) + NaCl(aq)
Pada setiap reaksi, konsentrasi awal KI dan NaClO diubah dan kecepatan reaksi diukur pada selang waktu tertentu. Hasilnya ditabulasikan ke dalam tabel:
Percobaan | [KI]0 (mol L–1) | [NaOCl]0 (mol L–1) | Kecepatan (M s–1) |
1 | 0,12 | 0,18 | 7,90 × 10–2 |
2 | 0,06 | 0,18 | 3,95 × 10–2 |
3 | 0,12 | 0,09 | 3,95 × 10–2 |
Tentukan tingkat reaksi masing-masing pereaksi dan persamaan kecepatan reaksinya.
Jawaban :
Persamaan kecepatan reaksinya adalah
v = k [KI]x [NaClO]y
Perhatikan percobaan ke-1 dan ke-2. Konsentrasi KI diturunkan dua kali, sementara konsentrasi NaClO dibentuk tetap. Oleh lantaran [NaClO] tetap, NaClO tidak besar lengan berkuasa terhadap kecepatan reaksi.
Dengan demikian, percobaan ke-1 dan ke-2 sanggup digunakan untuk memilih tingkat reaksi KI.
Jadi, tingkat reaksi terhadap KI yaitu orde 1.
Tinjau percobaan ke-1 dan ke-4. Konsentrasi KI dibentuk tetap, sementara konsentrasi NaClO diturunkan dua kali. Oleh lantaran itu, percobaan ke-1 dan ke-4 sanggup digunakan untuk memilih tingkat reaksi terhadap NaClO.
(2) = (2)y maka y = 1.
Jadi, tingkat reaksi terhadap NaClO yaitu orde 1.
Dengan demikian, persamaan kecepatan untuk reaksi tersebut adalah
v = k [KI] [NaClO]
Tingkat reaksi keseluruhan yaitu orde 2.
Contoh Soal UNAS 2005 :
Data percobaan untuk reaksi A + B → AB yaitu ....
No. | [A] | [B] | Laju |
1 | 0,1 | 0,05 | 20 |
2 | 0,3 | 0,05 | 180 |
3 | 0,1 | 0,2 | 320 |
Orde reaksi terhadap A dan B berturut-turut yaitu ....
A. 2 dan 4
B. 2 dan 2
C. 2 dan 1
D. 1 dan 2
E. 1 dan 1
Pembahasan :
orde reaksi terhadap A (data 1,2)
3x = 9
x = 2
orde reaksi terhadap B (data 1,3)
4y = 16
y = 2
Jadi, jawabannya (B)
Contoh Soal UNAS 2005 :
Data eksperimen untuk reaksi :
2A(g) + B(g) → 2AB(g)
Perc. | [A] | [B] | Laju |
1 | 0,1 | 0,1 | 6 |
2 | 0,1 | 0,2 | 12 |
3 | 0,1 | 0,3 | 18 |
4 | 0,2 | 0,1 | 24 |
5 | 0,3 | 0,1 | 54 |
Dari data tersebut sanggup disimpulkan bahwa persamaan laju reaksinya yaitu ....
A. v = k [A]2
B. v = k [B]
C. v = k [A] [B]
D. v = k [A] [B]2
E. v = k [A]2 [B]
Pembahasan :
• Orde reaksi terhadap A, percobaan 4 dan 5
• Orde reaksi terhadap B, percobaan 1 dan 2
Persamaan laju reaksinya:
v = k . [A]2 [B]
Jadi, jawabannya (E).
D. Teori Tumbukan dan Energi Pengaktifan
Mengapa kecepatan reaksi dipengaruhi oleh konsentrasi, suhu, katalis, dan luas permukaan zat-zat yang bereaksi? Semua ini sanggup dijelaskan dengan teori tumbukan dan energi pengaktifan. Asumsi dasar teori tumbukan yaitu bahwa suatu reaksi akan terjadi kalau partikel-partikel pereaksi bertumbukan satu sama lain secara efektif.
4.1. Teori Tumbukan
Menurut teori tumbukan, kecepatan reaksi ditentukan oleh faktor frekuensi tumbukan efektif (f) dan orientasi tumbukan (p). Kedua faktor tersebut terkandung dalam tetapan pada kecepatan reaksi, yaitu:
k = p f
Oleh lantaran tetapan berbanding lurus dengan kecepatan reaksi maka faktor-faktor tersebut berbanding lurus dengan kecepatan reaksi. Dengan kata lain, kalau frekuensi tumbukan tinggi maka kecepatan reaksi akan meningkat, sebaliknya kalau frekuensi tumbukan rendah maka kecepatan reaksi akan menurun.
Frekuensi tumbukan dipengaruhi oleh konsentrasi pereaksi. Jika konsentrasi pereaksi diperbesar maka peluang untuk bertumbukan juga semakin besar. Akibatnya, tumbukan semakin sering terjadi sehingga reaksi berlangsung lebih cepat. Hal ini bekerjasama dengan jumlah molekul, semakin tinggi konsentrasi, jumlah molekul semakin besar sehingga kemungkinan terjadi tumbukan efektif semakin besar.
Selain dipengaruhi konsentrasi, frekuensi tumbukan juga dipengaruhi suhu reaksi. Jika suhu reaksi dinaikkan, partikel-partikel pereaksi bergerak lebih cepat sehingga tumbukan lebih sering terjadi. Setiap kenaikan suhu 10 °C sanggup meningkatkan frekuensi tumbukan sekitar 2%. Faktor orientasi bekerjasama dengan luas permukaan bidang sentuh zat-zat yang bereaksi. Orientasi yang tepat dari partikel-partikel pereaksi akan menghasilkan tumbukan yang efektif, menyerupai digambarkan pada reaksi antara NO dan Cl2 berikut.
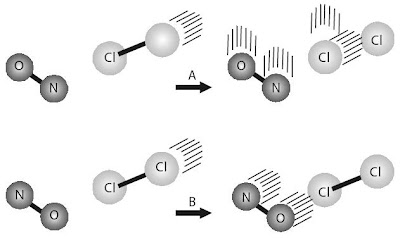 |
| Gambar 8. Model representasi orientasi tumbukan. N=O + Cl Cl → O=N Cl + Cl. Orientasi pada prosedur A menghasilkan tumbukan efektif sehingga reaksi lebih gampang terjadi. |
Pada Gambar 8. memperlihatkan bahwa prosedur A, molekul NO dan Cl2 saling mendekat dengan orientasi atom N mengarah pada molekul Cl2. Selain itu, sudut orientasi berada pada posisi pembentukan ikatan O=N–Cl. Orientasi menyerupai ini tepat untuk terjadinya reaksi. Sebaliknya, pada prosedur B, molekul NO dan Cl saling mendekat dengan atom O mengarah pada molekul Cl2. Oleh lantaran orientasinya tidak tepat untuk membentuk ikatan antara atom N dan Cl maka orientasi menyerupai ini tidak efektif untuk terjadinya reaksi.
4.2. Energi Pengaktifan (Ea)
Molekul-molekul pereaksi selalu bergerak dan peluang terjadinya tumbukan selalu ada. Akan tetapi, tumbukan yang terjadi belum tentu menjadi reaksi kalau energi yang dimiliki oleh masing-masing pereaksi tidak cukup untuk menghasilkan tumbukan efektif, meskipun orientasi molekul sudah tepat untuk menghasilkan tumbukan efektif. Agar tumbukan antar molekul pereaksi efektif dan menjadi reaksi maka fraksi molekul yang bertumbukan harus mempunyai energi lebih besar daripada energi pengaktifan. Apakah energi pengaktifan itu?
Energi pengaktifan yaitu energi minimum yang diharapkan untuk menghasilkan tumbukan efektif biar terjadi reaksi. Energi pengaktifan dilambangkan oleh Ea. Menurut Arrhenius, kekerabatan antara fraksi tumbukan efektif dan energi pengaktifan bersifat eksponensial sesuai persamaan berikut.
Keterangan :
f = frekuensi molekul yang bertumbukan secara efektif
R = tetapan gas
Ea = energi pengaktifan
T = suhu reaksi (K)
Persamaan tersebut memperlihatkan bahwa reaksi dengan energi pengaktifan kecil mempunyai harga f yang besar. Akibatnya, nilai tetapan laju (k) besar dan reaksi berlangsung lebih cepat. Jika suhu dinaikkan, harga f menjadi besar dan tetapan laju (k) juga besar sehingga reaksi berlangsung lebih cepat.
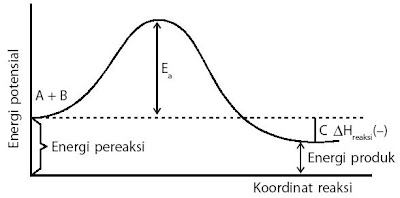
Energi pengaktifan untuk setiap reaksi (misalnya: A + B → C) umumnya mempunyai bentuk grafik menyerupai pada Gambar 9.
Pada Gambar 9, energi pengaktifan diungkapkan sebagai energi penghalang yang harus diatasi oleh setiap molekul pereaksi biar menjadi produk.
Jika Anda perhatikan grafik tersebut, energi pengaktifan ada hubungannya dengan perubahan entalpi reaksi. Dapatkah Anda memperlihatkan kekerabatan tersebut? Apakah reaksinya eksoterm atau endoterm? Oleh lantaran energi hasil reaksi lebih rendah dari energi pereaksi maka nilai ΔH untuk reaksi tersebut negatif. Dengan kata lain, reaksinya eksoterm. Sebaliknya, kalau arah reaksi dibalikkan, yakni: C → A + B maka produk reaksi (A + B) mempunyai energi lebih besar dari pereaksi C. Besarnya energi pengaktifan untuk reaksi kebalikannya, Ea(balik) = Ea(maju) + ΔHreaksi. Jadi, selisih energi pengaktifan untuk kedua reaksi yaitu sebesar ΔHreaksi.
 |
| Gambar 10. Grafik energi untuk reaksi kebalikan: C → A + B. |
Pada pembahasan sebelumnya, Anda sudah mengetahui bahwa katalis sanggup mempercepat reaksi dengan jalan turut serta dalam tahap-tahap reaksi dan pada selesai reaksi katalis diperoleh kembali. Bagaimana prosedur kerja katalis dihubungkan dengan energi pengaktifan? Sebagaimana diuraikan sebelumnya, reaksi penguraian hidrogen peroksida akan lebih cepat kalau pada reaksi ditambahkan katalis MnO2. Persamaan reaksinya:
MnO2 | ||
H2O2(l) | → | H2O(l) + O2(g) |
Kerja katalis dalam mempercepat reaksi yaitu dengan cara menciptakan jalan alternatif (jalan pintas) bagi pereaksi dalam membentuk produk (perhatikan Gambar 11), yaitu dengan cara menurunkan energi pengaktifannya, menyerupai ditunjukkan pada Gambar 12. berikut.
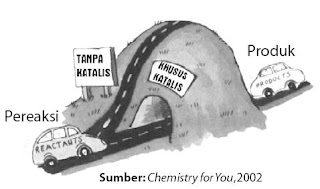 |
| Gambar 11. Katalis memperlihatkan jalan alternatif sehingga reaksi sanggup berlangsung lebih cepat. |
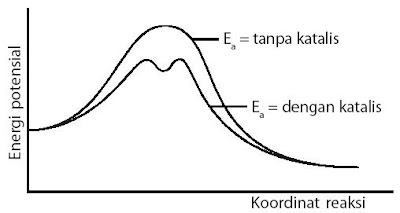 |
| Gambar 12. Mekanisme reaksi yang ditempuh oleh katalis yaitu dengan cara menurunkan energi pengaktifan reaksi. |
Jalan atau tahap-tahap reaksi yang ditempuh oleh pereaksi menjadi hasil reaksi sanggup dijelaskan. Misalnya, reaksi penguraian H2O2 dengan katalisator MnO2 adalah sebagai berikut.
Tahap 1 | : | 2H2O2 + MnO2 → 2H2O + 2MnO3 |
Tahap 2 | : | 2MnO3 + 2H2O2 → 2H2O + 2O2 + MnO2 |
Reaksi total | : | 4H2O2 → 4H2O + 2O2 |
Katalis sanggup menurunkan energi pengaktifan reaksi, baik ke arah pereaksi maupun ke arah produk dengan selisih energi sama besar, tetapi ΔHreaksi tidak berubah.
E. Aplikasi Kecepatan Reaksi
Semua proses kimia yang terjadi di alam maupun yang dikembangkan di industri mempunyai kecepatan yang berbeda. Seringkali kecepatan reaksi ini tidak sesuai dengan impian manusia. Pada umumnya, insan akan mempercepat reaksi-reaksi yang dianggap menguntungkan. Sebaliknya reaksi-reaksi yang merugikan diupayakan untuk diperlambat.
5.1. Peranan Luas Permukaan
Di Indonesia, banyak sekali industri-industri kecil, menyerupai industri keramik, batubata, dan penyaring zeolit. Pernahkah Anda berkunjung ke industri kecil pembuatan tembikar atau keramik tradisional? Untuk menciptakan keramik, bahan-bahan perlu dihaluskan dengan ukuran tertentu, disebut mesh. Ukuran material atau luas permukaan berperan penting dalam industri keramik. Jika luas permukaan sentuhan dari materi keramik kecil atau butirannya kasar, akan terjadi rongga-rongga yang mengakibatkan keramik gampang retak dan terjadi pengerutan.
Luas permukaan juga berperan penting pada pembuatan semen. Jika material semen semakin halus maka luas permukaan kontak semakin besar dan alhasil menjadi padat dan kompak sehingga bangunan menjadi kuat. Berbagai merek dagang jamu, umumnya dikemas dalam bentuk serbuk halus. Hal ini dimaksudkan biar pada dikala diseduh, senyawa yang terkandung di dalam jamu gampang terekstrak dan gampang larut dalam air panas. Jika diminum akan cepat dicerna dan diserap oleh sistem pencernaan.
4.2. Peranan Katalis Heterogen
Umumnya, katalis heterogen dibentuk dari unsur-unsur logam transisi alasannya yaitu mempunyai sifat pengadsorpsi gas yang baik. Sejumlah pereaksi berupa gas terkonsentrasi pada permukaan katalis heterogen dan reaksi berlangsung pada permukaan katalis heterogen. Pada prinsipnya, prosedur kerja katalis heterogen melibatkan empat tahap sebagai berikut:
- adsorpsi pereaksi pada permukaan katalis heterogen;
- migrasi pereaksi teradsorpsi pada permukaan katalis heterogen;
- reaksi zat-zat teradsorpsi di permukaan katalis heterogen;
- proses desorpsi hasil reaksi, produk reaksi meninggalkan permukaan katalis heterogen.
Contoh prosedur kerja katalis sanggup dilihat pada Gambar 13.
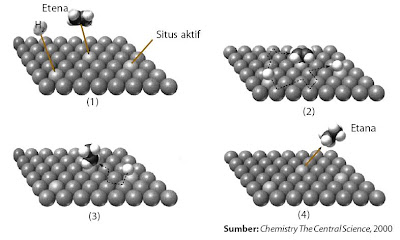 |
| Gambar 13. Mekanisme kerja katalis heterogen pada hidrogenasi etena, C2H4 + H2 → C2H6. |
Dalam proses di industri, walaupun dimungkinkan menerapkan suhu tinggi untuk mempercepat reaksi, tetapi biaya operasional dan pemeliharaan akan sangat mahal. Oleh alasannya yaitu itu, penggunaan katalis heterogen bagi industri kimia merupakan aspek yang sangat penting. Hampir semua industri kimia (nasional maupun internasional) memakai katalis heterogen di dalam prosesnya. Beberapa di antaranya yaitu industri pembuatan amonia, asam sulfat, dan asam nitrat.
Pada sintesis amonia, katalis heterogen yang digunakan yaitu besi(II) oksida dengan promotor ganda, yaitu penambahan sekitar 4% kalium oksida dan 0,8% aluminium oksida. Promotor ini berfungsi untuk meningkatkan acara katalitik dari besi oksida. Promotor yaitu materi yang menjadikan katalis lebih efektif. Dalam katalis padat, sejumlah kecil promotor sanggup mengakibatkan pembentukan kerusakan kisi kristal, yang menimbulkan belahan aktif pada permukaan katalis.
Dalam industri asam sulfat yang dikembangkan melalui proses kontak, untuk mempercepat pembentukan gas SO3 dari gas SO2 dan gas O2 digunakan katalis vanadium (V) oksida (V2O5). Tahap-tahap reaksi pembuatan asam sulfat sebagai berikut.
S(s) + O2(g) → SO2(g) | ||
V2O5 | ||
SO2(g) + O2(g) | → | SO3(g) |
SO3(g) + H2SO4(aq) → H2S2O7 (aq) | ||
H2S2O7(aq) + H2O(l) → H2SO4(aq) | ||
Dalam industri asam nitrat yang dikembangkan melalui proses Ostwald digunakan katalis Pt–Rh. Tahap-tahap reaksi pembuatan asam nitrat yaitu sebagai berikut.
Katalis | ||
4NH3(g) + 5O2(g) | → | 4NO(g) + 6H2O(l) |
Katalis | ||
2NO(g) + O2(g) | → | 2NO2(g) |
Katalis | ||
4NO2(g) + O2(g) + 2H2O(l) | → | 4HNO3(aq) |
Pada proses pembakaran yang tidak sempurna, selain gas karbon dioksida (CO2) dihasilkan juga gas karbon monoksida (CO). Berbeda dengan CO2, karbon monoksida berbahaya bagi insan lantaran bersifat racun sehingga perlu diubah menjadi senyawa yang lebih aman. Salah satu caranya yaitu dengan mereaksikan CO dan H2 menggunakan katalis.
Beberapa jenis katalis yang digunakan pada reaksi antara gas CO dan H2 dengan banyak sekali kondisi reaksi ditunjukkan pada Tabel 5. berikut.
Tabel 5. Beberapa Katalis untuk Reaksi CO dengan H2
Katalis | Kondisi | Reaksi |
Ni | 100–200 °C, 1–10 atm | CO + H2 → CH4 + H2O |
ZnO, Cr2O3 | 400 °C, 500 atm | CO + H2 → CH2OH + H2O |
CO, ThO2 | 190 °C, 1–20 atm | CO + H2 → H2O + CH4, C2H6, hingga C6H14 |
Ru | 200 °C, 200 atm | CO + H2 → Hidrokarbon dengan massa molekul tinggi dan air |
ThO2 | 400 °C, 200 atm | CO + H2 → Hidrokarbon rantai bercabang dan air |
Sumber: Chemistry with Inorganic Qualitative Analysis, 1989 | ||
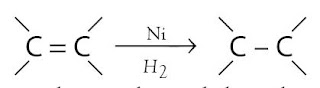
Logam nikel sanggup juga digunakan sebagai katalis dalam pembuatan mentega dari minyak nabati atau lemak takjenuh melalui proses hidrogenasi. Pada reaksi ini, ikatan-ikatan rangkap dua karbon (C=C) dalam lemak takjenuh diubah menjadi ikatan tunggal.
Katalis heterogen juga digunakan dalam konverter katalitik pada sistem pembuangan gas kendaraan bermotor menyerupai pada Gambar 14.
 |
| Gambar 14. Konverter katalitik yang digunakan pada kendaraan bermotor. |
Gas buang yang mengandung senyawa NO, CO, dan CHx dilewatkan melalui konverter yang berisi katalis padat.
Katalis | ||
CO(g) | → | CO2(g) |
Katalis | ||
NO(g) | → | N2(g) |
Katalis | ||
CHx | → | CO2(g) + H2O(g) |
Katalis tersebut menjadikan cepatnya pengubahan CO menjadi CO2, CHx menjadi CO2 dan H2O, serta NO menjadi gas N2, yang semuanya relatif ramah lingkungan. Oleh lantaran sifat reaksi yang rumit dalam konverter, biasanya digunakan adonan katalis. Material katalitik yang efektif yaitu oksida logam unsur transisi dan logam mulia menyerupai platina dan paladium.
Salah satu hambatan dalam penggunaan katalis heterogen yaitu hampir semua katalis teracuni. Maksudnya, pengotor-pengotor dalam pereaksi melapisi permukaan katalis atau memodifikasi permukaan katalis sehingga acara katalitiknya berkurang.
Kerja katalis sanggup dihambat oleh suatu inhibitor dengan cara mengikat katalis atau mengikat pereaksi. Contoh, bau tengik pada mentega disebabkan oleh adanya ion tembaga yang masuk ketika pengemasan. Ion tembaga ini berperan sebagai katalis sehingga mentega cepat teroksidasi. Bau tengik sanggup dikurangi dengan menambahkan sejumlah kecil zat organik tertentu. Penambahan zat ini sanggup mengikat ion tembaga sehingga imbas katalitik dari ion tembaga hilang.
5.3. Enzim
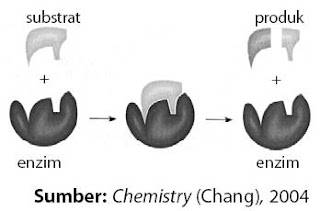
Pada umumnya reaksi kimia berlangsung lebih cepat dalam suhu tinggi, tetapi bagaimana dengan reaksi yang berada dalam sel makhluk hidup? Dapatkah kita meningkatkan suhu reaksinya? Tentu tidak, untuk itu Tuhan telah melengkapi makhluk hidup dengan katalis biologi yang dikenal sebagai enzim. Enzim yaitu molekul protein berukuran besar yang sanggup meningkatkan kecepatan reaksi biokimia dengan faktor 105 hingga dengan 1018. Selain itu, enzim bekerja dengan sangat spesifik menyerupai anak kunci yang hanya cocok untuk kunci tertentu. Pada enzim terdapat situs aktif daerah berlangsungnya reaksi biokimia. Skema kerja enzim yaitu sebagai berikut.
Rangkuman :
- Kemolaran yaitu satuan konsentrasi yang menyatakan jumlah mol per liter larutan.
- Perubahan konsentrasi pereaksi atau produk per satuan waktu dinamakan kecepatan reaksi.
- Ada dua macam kecepatan reaksi, yaitu laju reaksi rata-rata dan laju reaksi sesaat. Laju reaksi rata-rata disebut juga kecepatan reaksi.
- Untuk mengukur kecepatan reaksi sanggup dilakukan melalui pengukuran variabel terikat, variabel yang ingin diketahui dinamakan variabel bebas, sedangkan variabel yang lain dibentuk tetap (variabel kontrol).
- Ada beberapa faktor yang memengaruhi kecepatan reaksi, yaitu konsentrasi pereaksi, suhu, luas permukaan bidang sentuh, dan katalis.
- Kecepatan reaksi sanggup ditentukan dengan metode laju awal dan sederetan percobaan dilakukan dengan konsentrasi awal berbeda, sedangkan rentang waktu reaksi dibentuk tetap.
- Hukum laju reaksi yaitu persamaan yang memperlihatkan kekerabatan antara kecepatan reaksi dan konsentrasi pereaksi dipangkatkan orde reaksinya. Persamaan: v = k [X]a [Y]b [Z]c, k yaitu tetapan laju, [X], [Y], [Z] yaitu konsentrasi pereaksi, dan a, b, c yaitu orde reaksi.
- Orde reaksi tidak ada kekerabatan dengan koefisien reaksi. Orde reaksi hanya sanggup ditentukan melalui percobaan.
- Menurut teori tumbukan, reaksi sanggup terjadi kalau partikel-partikel pereaksi bertumbukan secara efektif.
- Energi pengaktifan yaitu energi minimum yang harus dilewati oleh pereaksi biar terjadi reaksi.
- Kerja katalis dalam meningkatkan laju reaksi yaitu dengan turut terlibat dalam beberapa tahap reaksi, tetapi pada selesai reaksi katalis diregenerasi kembali.
- Dalam hubungannya dengan energi pengaktifan, katalis berfungsi untuk menurunkan energi pengaktifan dengan cara menciptakan tahap-tahap reaksi yang mempunyai energi pengaktifan rendah.
- Katalis berperan penting dalam proses di industri kimia alasannya yaitu sanggup mempercepat produksi secara efektif dan efisien.
Anda kini sudah mengetahui Kecepatan Reaksi. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Sunarya, Y. dan A. Setiabudi. 2009. Praktis dan Aktif Belajar Kimia 2 : Untuk Kelas XI Sekolah Menengah Atas/Madrasah Aliyah Program Ilmu Pengetahuan Alam. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta. p. 250.

No comments:
Post a Comment