Energi Ikatan Rata-rata Kimia, Perubahan Entalpi, Contoh Soal, Pembahasan, Energi Disosiasi Molekul Diatom - Reaksi kimia merupakan proses pemutusan dan pembentukan ikatan. Proses ini selalu disertai perubahan energi. Energi yang dibutuhkan untuk memutuskan 1 mol ikatan kimia dalam suatu molekul gas menjadi atom-atomnya dalam fase gas disebut energi ikatan atau energi disosiasi (D). Untuk molekul kompleks, energi yang dibutuhkan untuk memecah molekul itu sehingga membentuk atom-atom bebas disebut energi atomisasi. Harga energi atomisasi ini merupakan jumlah energi ikatan atom-atom dalam molekul tersebut. Untuk molekul kovalen yang terdiri dari dua atom, seperti H2, O2, N2, atau HI yang mempunyai satu ikatan, maka energi atomisasi sama dengan energi ikatan. Energi yang dibutuhkan untuk reaksi pemutusan ikatan telah diukur. Contoh untuk molekul diatom dicantumkan pada tabel 1.
Tabel 1. Energi Disosiasi / Ikatan (D) Molekul Diatom dalam kJ/mol pada 25 oC.
Molekul | Energi Disosiasi (kJ mol–1) |
H – H(g) | 436,0 |
N ≡ N(g) | 945,3 |
O – O(g) | 498,3 |
F – F(g) | 157 |
Cl – Cl(g) | 242,6 |
Br – Br(g) | 193,9 |
I – I(g) | 152,6 |
H – F(g) | 567,6 |
H – Cl(g) | 431,6 |
H – Br(g) | 366,3 |
H – I(g) | 298,3 |
Cl – F(g) | 254,3 |
Cl – Br(g) | 218,6 |
Cl – I(g) | 210,3 |
Sumber: General Chemistry, Principles and Structure, James E. Brady, 1990) | |
Misalnya, energi untuk memutuskan 1 mol ikatan H–H dalam suatu molekul gas H2 menjadi atom-atom H yaitu 436 kJ mol–1.
H2(g) → 2H DH–H = 436 kJ mol–1.
Energi dibutuhkan untuk memutuskan molekul CH4 menjadi sebuah atom C dan 4 atom H :
CH4(g) → C(g) + 4H(g)
Besarnya perubahan entalpi reaksi tersebut sanggup dihitung dengan entalpi pembentukan standar sebagai berikut:
ΔH =ΔHf° (C, atomik) + 4 ΔHf° (H, atomik) – ΔHf° (CH4(g))
= (716,7 kJ mol–1) + (218, kJ mol–1) – (–74,5 kJ mol–1)
= 1.663,2 kJ mol–1
Saat perubahan entalpi tersebut setara untuk memutuskan 4 ikatan (–H) maka besarnya energi ikatan rata-rata C – H yaitu 415,8 kJ mol–1, selanjutnya kita sebut energi ini sebagai energi ikatan rata-rata sebab empat ikatan C – H dalam CH4 putus dalam waktu yang sama.
Contoh Soal Energi Ikatan (1) :
Diketahui :
ΔHf° C(g, atomik) = 716,7 kJ mol–1
ΔHf° H(g, atomik) = 218 kJ mol–1
ΔHf° C2H6(g) = –84,7 kJ mol–1
energi ikatan C–H = 415,8 kJ mol–1
Tentukan besarnya energi ikatan C – C pada C2H6 !
C2H6(g) → 2 C(g, atomik).
ΔH = 2 ΔΗf° C + 6 ΔHf° C – ΔHf° C2H6
= 2 (716,7) + 6 (218) – (–84,7)
= 2.826,1 kJ
Pada C2H6
EIkatan C – C + 6 EIkatan C – H = ΔH
EIkatan C – C + 6 (415,8) = 2.826,1
EIkatan C – C = 331,3 kJ/mol
Energi atomisasi suatu senyawa sanggup ditentukan dengan memakai entalpi pembentukan senyawa tersebut. Secara matematis, hal tersebut sanggup dijabarkan dengan persamaan:
ΔHreaksi = Σ energi pemutusan ikatan – Σ energi pembentukan ikatan
ΔHreaksi = Σ energi ikatan di kiri – Σ energi ikatan di kanan
Contoh Soal (2) :
Diketahui energi ikatan:
C – H = 415 kJ/mol
C = C = 607 kJ/mol
C – C = 348 kJ/mol
H – H = 436 kJ/mol
Ditanya :
ΔHreaksi pada reaksi : C2H4(g) + H2(g) → C2H6(g)
ΔHreaksi = Σ energi pemutusan ikatan – Σ energi pembentukan ikatan
= {4 (C – H) + (C = C) + (H – H)} – {6 (C – H) + (C – C)}
= {(C = C) + (H – H)} – {2 (C – H) + (C – C)}
= (607 + 436) – (2 × 415 + 348)
= 1.043 – 1.178
= –135 kJ
Jadi, C2H4(g) + H2(g) → C2H6(g) ΔH = –135 kJ
Energi ikatan rata-rata yaitu energi rata-rata per ikatan yang dibutuhkan untuk menguraikan 1 mol molekul menjadi atom-atom penyusunnya.
Tabel 2. Energi Ikatan Rata-rata
Ikatan | Energi Ikatan Rata-rata (kJ mol–1) | Ikatan | Energi Ikatan Rata-rata(kJ mol–1) |
C – C | 348 | C – Br | 276 |
C = C | 607 | C – I | 238 |
C ≡ C | 833 | H – H | 436 |
C – H | 415 | H – F | 563 |
C – N | 292 | H – Cl | 432 |
C = N | 619 | H – Br | 366 |
C ≡ N | 879 | H – I | 299 |
C – O | 356 | H – N | 391 |
C = O | 724 | H – O | 463 |
C – F | 484 | H – S | 338 |
C – Cl | 338 | H – Si | 376 |
(Sumber: General Chemistry, Principles and Structure, James E. Brady, 1990) | |||
Contoh Soal Energi Ikatan rata-rata (3) :
Diketahui :
ΔHf° F2O = 257 kJ mol–1
energi ikatan gas fluorin = 157 kJ mol–1
energi ikatan gas oksigen = 498 kJ mol–1
Tentukan besarnya energi ikatan rata-rata F–O!
Pembahasan :
F2O(g) → 2 F(g) + ½ O2(g)
F2(g) + ½ O2(g) → F2O(g) | ΔH = 257 kJ mol–1 |
F2(g) → 2 F(g) | ΔH = 157 kJ mol–1 |
O2(g) → 2 O(g) | ΔH = 498 kJ mol–1 |
F2O(g) → | ΔH = –257 kJ mol–1 |
ΔH = 157 kJ mol–1 | |
ΔH = 249/2 kJ mol–1 = 74,5 kJ mol–1 |
1. Energi Kimia dan Bahan Peledak
Ikatan kovalen rangkap tiga N ≡ N pada molekul N2 memiliki energi ikatan yang sangat besar. Oleh sebab itu banyak reaksi kimia yang melibatkan pembentukan molekul N2 bersifat sangat eksotermik. Sebagai pola yaitu reaksi peledakan. Bahan peledak pada umumnya terbuat dari senyawa nitrogen. Pada ketika peledakan dihasilkan energi kalor yang sangat besar (sangat eksoterm), dan pelepasan gas produk reaksi dalam volume yang sangat besar. Daya rusak dari peledakan diakibatkan oleh gelombang udara yang bergerak sangat cepat (100 m/detik hingga 6 km/detik), akhir peningkatan volume gas produk reaksi yang sangat besar dan atau akhir pemuaian udara oleh sebab pelepasan energi kalor yang besar dalam waktu singkat.
Bahan peledak yang dibentuk pertama kali yaitu abu mesiu yang mengandung 75% KNO3, 12% S, dan 13% C. Setelah itu muncul amonium nitrat (NH4NO3) dengan kekuatan peledakan yang lebih tinggi. Hal ini dikarenakan peledakan NH4NO3 menghasilkan O2, yang selanjutnya mengoksidasi (membakar) zat-zat lain, sehingga menaikkan jumlah energi kalor yang dilepaskan.
2 NH4NO3(s) → 2 N2(g) + O2(g) + 4 H2O(g)
Oleh sebab sanggup menyuplai O2 yang cukup, NH4NO3 juga dipakai sebagai materi adonan untuk materi peledak dengan daya rusak tinggi, menyerupai TNT (trinitrotoluena, C7H5O6N3) dan dinamit (nitrogliserin, C3H5O9N3). (Sumber: Chemistry, Gillespie, Humphreys, Bair, Robinson, Allyn & Bacon Inc.)
2. Ikatan pada Bahan Bakar dan Makanan
Pada umumnya materi bakar untuk mesin-mesin yaitu hidrokarbon dan watu bara. Bahan bakar untuk makhluk hidup yaitu lemak dan karbohidrat. Dua macam materi bakar itu tersusun dari molekul-molekul organik yang besar dengan ikatan-ikatan C – C dan C – H. Ketika materi bakar bereaksi dengan O2 terbakar), maka ikatan-ikatan pada materi bakar tersebut akan putus dan atom-atom C, H, dan O membentuk ikatan C – O dan O – H pada produk CO2 dan H2O.
Ketika terbakar, materi bakar membebaskan energi. Kita tahu bahwa total kekuatan ikatan-ikatan pada produk lebih besar daripada total kekuatan ikatan-ikatan pada materi bakar dan O2. Bahan bakar dengan ikatan yang lebih lemah (kurang stabil, energi tinggi), menghasilkan energi lebih besar daripada materi bakar yang ikatannya lebih kuat. Tabel 3. menunjukkan bahwa untuk beberapa materi organik, jikalau jumlah ikatan C – C dan C – H berkurang dan atau jumlah ikatan C – O dan O – H bertambah dan bila sedikit energi dibebaskan dari pembakaran, maka ΔH bertanda negatif (eksoterm). Dengan kata lain, jikalau ikatan-ikatan O pada materi bakar lebih sedikit, maka makin banyak energi yang dibebaskan ketika dibakar.
Tabel 3. ΔHc (Entalpi Pembakaran) beberapa lemak dan karbohidrat
Zat | ΔHc (kJ/g) |
Lemak | |
• Minyak sayur | 37,0 |
• Margarin | 30,1 |
• Mentega | 30,0 |
Karbohidrat | |
• Sukrosa | 16,2 |
• Beras merah | 14,9 |
• Sirup maple | 10,4 |
Lemak dan karbohidrat merupakan bahan-bahan organik yang berfungsi sebagai sumber makanan yang menyediakan energi yang tinggi. Lemak terdiri dari rantai atom-atom karbon ( C – C ) yang sangat besar mengikat atom-atom hidrogen (C – H). Karbohidrat mempunyai ikatan-ikatan C – O dan O – H. Kedua jenis makanan ini dimetabolisme di dalam badan menjadi CO2 dan H2O. (Sumber: Chemistry, The Molecular Nature of Matter and Change Martin S. Silberberg, 2000.)
Anda kini sudah mengetahui Energi Ikatan Bahan Bakar. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Utami, B. A. Nugroho C. Saputro, L. Mahardiani, S. Yamtinah, dan B. Mulyani. 2009. Kimia 2 : Untuk SMA/MA Kelas XI, Program Ilmu Alam. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 274.
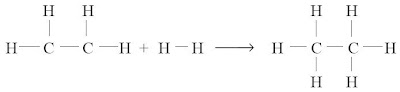
No comments:
Post a Comment