Contoh Reaksi Eksotermik dan Reaksi Endotermik, Perbedaan, Percobaan, Kimia - Berdasarkan arah berpindahnya kalor dalam sistem dan lingkungan, maka reaksi dibedakan menjadi dua jenis, yaitu reaksi eksoterm dan reaksi endoterm. Dikatakan reaksi eksotermik (berasal dari kata eks (keluar) dan therm (panas)) apabila kalor berpindah dari sistem ke lingkungan, artinya sistem melepas kalor. Adapun reaksi endotermik terjadi apabila sistem menyerap kalor atau kalor berpindah dari lingkungan ke sistem. (Baca juga : Termokimia)
1. Reaksi Eksotermik / Reaksi Eksoterm
Pernahkah kalian memperhatikan bahwa setiap kali selesai makan nasi, tubuh kita menjadi gerah? Mengapa demikian? Mari kita ingat kembali proses asimilasi. Dalam tubuh, nasi yang kita makan akan bereaksi dengan oksigen yang kita hirup dengan reaksi ibarat berikut.
Cn(H2O)m + O2 n → CO2 + m H2O + energi
Persamaan termokimianya :
amilum + O2(g) n → CO2(g) + m H2O(aq) ∆H = -X kJ
Energi dalam bentuk panas yang dilepas tubuh inilah yang menjadikan gerah.
Di dalam reaksi eksoterm, panas berpindah dari sistem ke lingkungan, karenanya panas dalam sistem berkurang sehingga ∆H-nya bertanda negatif. Secara matematis, ∆H dirumuskan sebagai berikut.
∆H = ∆H hasil reaksi – ∆H pereaksi
Karena akibatnya negatif, berarti ∆H hasil reaksi lebih rendah dari ∆H pereaksi, dan digambarkan dalam diagram berikut.
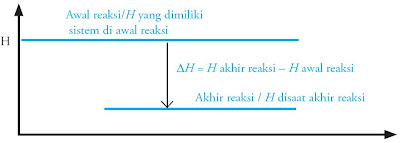 |
| Gambar 1. Diagram reaksi eksoterm. |
Arah panah ke bawah menawarkan bahwa energi semakin berkurang alasannya ialah sebagian terlepas.
2. Reaksi Endotermik / Reaksi Endoderm
Reaksi endoterm merupakan kebalikan dari reaksi eksoterm. Dalam reaksi ini, sistem menyerap kalor dari lingkungan sehingga harga entalpi reaksinya bertambah besar dan ∆H-nya berharga positif, atau ∆H hasil reaksi –∆H pereaksi > 0. Karena akibatnya positif, berarti ∆H hasil reaksi lebih tinggi dari ∆H reaksi, dan digambarkan dalam diagram berikut.
 |
| Gambar 2. Diagram reaksi endoterm. |
Arah panah ke atas menawarkan energi semakin bertambah alasannya ialah sistern menyerap panas dari lingkungan. Perhatikan pola reaksi berikut.
Ba(OH)2.8H2O(s) + 2 NH4C1(aq) → BaCl2 (aq) + 2 NH4OH(aq) + 8 H2O(aq) ∆H > 0
Reaksi mempunyai AH > 0 sehingga merupakan reaksi endoterm. Agar kalian dapat membedakan dengan terang antara reaksi eksoterm dengan reaksi endoterm, kerjakanlah rubrik Aktivitas berikut.
3. Percobaan Reaksi Eksotermik dan Reaksi Endotermik
A. Dasar Teori
Reaksi eksoterm merupakan perpindahan energi dari sistem ke lingkungan, sehingga apabila kita pegang daerah reaksinya akan terasa panas alasannya ialah adanya panas yang keluar dari sistem. Reaksi endoterm merupakan perpindahan energi dari lingkungan ke sistem, sehingga apabila kita pegang daerah reaksinya akan terasa hirau taacuh alasannya ialah panas lingkungan diserap oleh sistem. (Nathan, Harold D., 2001, Film. 143, dengan pengembangan)
3.2. Tujuan Percobaan
Dapat membedakan reaksi eksoterm dengan reaksi endoterm
3.3. Alat dan Bahan
3.3.1. Alat :
- Gelas Beker
- Tabung reaksi
- Sendok spatula
- Pemanas
- Pengaduk kaca
3.3.2. Bahan
- Natrium karbonat (Na2CO3(s))
- Natrium hidroksida (NaOH (s))
- Barium hidroksida hidrat (Ba(OH)2.8H2O (s))
- Amonium klorida (NH4C1(s))
- Sebuk besi (Fe(s))
- Serbuk welirang (S(s))
- Akuades
3.4. Cara Kerja
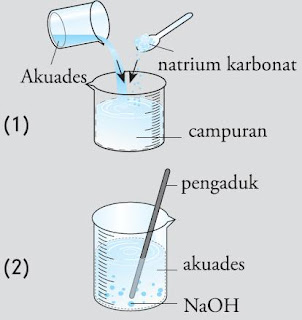
- Masukkan 1 sendok spatula natrium karbonat ke dalam gelas beker, lalu tambahkan 100 mL akuades, aduk sampai larut. Selama pengadukan atau segera setelah pengadukan selesai, pegang gelas beker dan rasakan suhunya.
- Masukkan 5-10 butir natrium hidroksida ke dalam gelas beker, lalu tambahkan 100 ml akuades, aduk sampai larut. Selama pengadukan atau segera setelah pengadukan selesai, pegang gelas beker don rasakan suhunya.
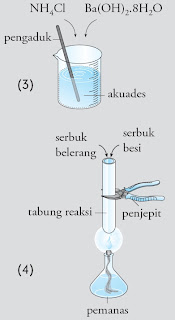
- Masukkan serbuk barium hidroksida hidrat clan amonium klorida, masing-masing 2 sendok spatula ke dalam beker gelas, lalu aduk sampai larut semua. Tutuplah beker gelas dan rasakan suhu pada beker. Buka tutupnya, lalu cium basi yang timbul.
- Campurkan 3 sendok spatula serbuk welirang dengan 1 spatula serbuk besi ke dalam tabung reaksi. Panaskan tabung tersebut sampai adonan mulai berpijar. Hentikan pemanasan dan amati apa yang terjadi sebelum, selama, dan sehabis pemanasan.
Perhatian : Gunakan penjepit untuk memegangi tabung reaksi yang dipanaskan. Arahkan muka tabung ke daerah kosong.
3.5. Hasil Percobaan
Isilah tabel berikut menurut hasil pengamatan kalian dengan klarifikasi serinci mungkin.
3.6. Pembahasan
Analisalah hasil aktivitas yang telah kalian lakukan sampai kalian paham betul dan dapat membedakan reaksi eksoterm dengan endoterm.
3.7. Kesimpulan
Tariklah kesimpulan wacana perbedaan reaksi eksoterm dengan reaksi endoterm menurut hasil aktivitas kalian.
Anda kini sudah mengetahui Reaksi Eksoterm dan Reaksi Endoterm. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Premono, S. A. Wardani, dan N. Hidayati. 2009. Kimia : SMA/ MA Kelas XI. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 282.
No comments:
Post a Comment