Pengertian Laju Reaksi Kimia, Rumus, Contoh Soal, Faktor-faktor yang Mempengaruhi, Orde, Praktikum, Pembahasan, Grafik, Katalis, Persamaan - Laju reaksi sama dengan kecepatan reaksi. Langit di malam hari, ketika perayaan tahun gres atau hari-hari istimewa lainnya, menjadi lebih indah ketika nyala kembang api mulai kelihatan di angkasa. Tampak nyalanya gemerlapan menambah terang sinar rembulan. Sekejap kemudian, langit nampak redup kembali, cahaya gemerlap dari nyala kembang api tidak lagi kelihatan. Begitu cepatnya nyala itu hilang, berbeda tatkala kita menyalakan kayu bakar pada api unggun, membutuhkan waktu cukup lama. Cepat dan lambatnya nyala api ini memperlihatkan cepat atau lambatnya reaksi kimia dalam kembang api maupun dalam kayu bakar. Cepat dan lambatnya proses reaksi kimia yang berlangsung dinyatakan dengan laju reaksi. Lantas, apakah pengertian laju reaksi itu? Bagaimana cara mengukurnya? Apa saja faktor-faktor yang mempengaruhinya? Apa manfaat mempelajarinya bagi kehidupan kita? Kalian akan memperoleh jawabannya sehabis mempelajari belahan ini.
Cepatnya reaksi kimia dari kembang api sanggup kita amati dari menyalanya kembang api hingga matinya. Begitu pula dengan beberapa reaksi kimia yang kita laksanakan di laboratorium. Selesainya sebuah reaksi ditandai dengan terbentuknya produk yang sebagian besar sanggup kita amati. Nah, untuk mengetahui berapa kecepatan reaksi kimia yang kita lakukan, kita sanggup mengetahui dari konsentrasi pereaksinya atau hasil reaksinya. Konsentrasi ini biasa dinyatakan dengan satuan molaritas.
Ada beberapa faktor yang menawarkan imbas pada laju reaksi kimia. Faktor-faktor tersebut ialah konsentrasi, luas permukaan, suhu, dan katalis. Bagaimana masing-masing faktor mempengaruhi laju suatu reaksi, dan bagaimana cara kita menganalisis faktor tersebut akan kita pelajari pula dalam belahan ini. Selain hal-hal di atas, kita juga akan mempelajari ihwal persamaan laju reaksi, waktu reaksi, dan orde reaksinya.
A. Pengertian Laju Reaksi
Laju reaksi ialah laju penurunan reaktan (pereaksi) atau laju bertambahnya produk (hasil reaksi). Laju reaksi ini juga menggambarkan cepat lambatnya suatu reaksi kimia, sedangkan reaksi kimia merupakan proses mengubah suatu zat (pereaksi) menjadi zat gres yang disebut sebagai produk. Reaksi kimia digambarkan ibarat pada denah berikut.
Beberapa reaksi kimia ada yang berlangsung cepat. Natrium yang dimasukkan ke dalam air akan memperlihatkan reaksi andal dan sangat cepat, begitu pula dengan petasan dan kembang api yang disulut. Bensin akan terbakar lebih cepat daripada minyak tanah. Namun, ada pula reaksi yang berjalan lambat. Proses pengaratan besi, misalnya, membutuhkan waktu sangat usang sehingga laju reaksinya lambat. Cepat lambatnya proses reaksi kimia yang berlangsung dinyatakan dengan laju reaksi. Dalam mempelajari laju reaksi dipakai besaran konsentrasi tiap satuan waktu yang dinyatakan dengan molaritas. Apakah yang dimaksud molaritas? Simak uraian berikut.
1.1. Molaritas sebagai Satuan Konsentrasi dalam Laju Reaksi
Molaritas menyatakan jumlah mol zat dalam 1 L larutan, sehingga molaritas yang dinotasikan dengan M, dan dirumuskan sebagai berikut.
M = n/V
Keterangan :
n = jumlah mol dalam satuan mol atau mmol
V = volume dalam satuan L atau mL
Bagaimana cara memakai dan menghitung molaritas? Kalian akan mengetahuinya dari contoh-contoh soal berikut.
Contoh Soal Molaritas (1) :
Sebanyak 17,1 g sukrosa (Mr = 342) dilarutkan dalam air hingga volume larutan 500 mL. Tentukan kemolaran sukrosa.
Penyelesaian:
Diketahui :
Mr sukrosa = 342
Massa (m) sukrosa = 17,1 g
Volume larutan = 500 mL
Ditanyakan :
Molaritas sukrosa.
Jawaban :
n sukrosa = massa/Mr = 171/342 = 0,05 mol = 50 mmol
M sukrosa = n/V = 50 mmol / 500 mL = 0,1 M
Jadi, molaritas sukrosa tersebut ialah 0,1 M.
Contoh Soal Molaritas (2) :
Berapa gram soda camilan bagus (NaHCO3) yang dibutuhkan untuk menciptakan 150 mL larutan NaHCO3 0,5 M? (Ar Na = 23, H = 1, C = 12, 0 = 16)
Pembahasan :
Diketahui :
Molaritas NaHCO3 = 0,5 M= 0,5 mol/L
Volume larutan = 150 mL = 0,15 L
Ditanyakan :
Massa NaHCO3 ?
Jawaban :
n =M xV = 0,5 mol/L x 0,15 L = 0,075 mol
massa = mol x Mr = 0,075 x 84 = 6,3 g
Jadi, massa soda camilan bagus tersebut ialah 6,3 g.
Pembuatan suatu larutan sanggup juga dilakukan dengan mengencerkan larutan yang sudah ada, dengan catatan molaritas larutan yang akan dibentuk lebih rendah dari molaritas larutan yang sudah ada. Misalnya di laboratorium hanya ada larutan HCl 1 M, sedangkan kita memerlukan larutan HCl 0,5 M sebanyak 100 mL, bagaimana kita mendapatkannya?
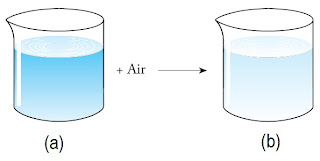 |
| Gambar 1. Pengenceran. |
Pada gambar 1 (a) :
sebelum pengenceran
V = V1
M = M1
n = n1
Pada gambar 1 (a) :
sebelum pengenceran
V = V2
M = M2
n = n2
Dalam pengenceran, jumlah zat terlarut tidak berubah sehingga jumlah molnya tetap. Jadi, n1 = n2 atau M1 x V1 = M2 x V2. Rumus ini biasa disebut sebagai rumus pengenceran.
Dari citra cara tcrsebut, maka larutan HC1 0,5 M sebanyak 100 mL sanggup dibentuk dengan mengencerkan larutan HC1 1M. Volume HC1 1 M yang dibutuhkan dicari melalui rumus pengenceran.
V1 x M1 = V2 x M2
V1 x 1 = 100 x 0,5
V1 = 50 mL
Jadi, kita sanggup mclakukannya dengan mengambil 50 mL HC1 1M, kemudian kin masukkan ke dalam labu ukur 100 mL kemudian ditambahi air hingga tanda batas, dan 100 ml Larutan HCl 0,5 M telah selesai dibuat.
 |
| Gambar 2. Larutan asam sulfat 97%. |
Apabila yang tersedia di laboratorium hanya larutan pekat yang diketahui massa jenis dan kadarnya tanpa diketahui konsentrasinya, contohnya larutan asam sulfat dengan kadar 97% dan massa jenisnya 1,8 kg/L, maka molaritas H2SO4 tersebut sanggup ditentukan dengan rumusan berikut.
Untuk menghitung molaritas larutan H2SO4 dengan kadar 97% dan massa jenis 1,8 kg/L, kita tinggal memasukkan data ke dalam rumus hingga diperoleh molaritas asam sulfat tersebut sebesar 17,82 M ibarat pada perhitungan berikut.
1.2. Rumus Laju Reaksi
Laju reaksi kimia bukan hanya sebuah teori, namun sanggup dirumuskan secara matematis untuk memudahkan pembelajaran. Pada reaksi kimia: A → B, maka laju berubahnya zat A menjadi zat B ditentukan dari jumlah zat A yang bereaksi atau jumlah zat B yang terbentuk per satuan waktu. Pada ketika pereaksi (A) berkurang, hasil reaksi (B) akan bertambah. Perhatikan diagram perubahan konsentrasi pereaksi dan hasil reaksi pada Gambar 3.
 |
| Gambar 3. Diagram perubahan konsentrasi pereaksi dan hasil reaksi. |
Berdasarkan gambar tersebut, maka rumusan laju reaksi sanggup kita definisikan sebagai:
a. berkurangnya jumlah pereaksi (konsentrasi pereaksi) per satuan waktu, atau : 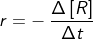 , dengan r = laju reaksi, - d[R] = berkurangnya reaktan (pereaksi), dan dt = perubahan waktu. Untuk reaksi : A → B, laju berkurangnya zat A ialah :
, dengan r = laju reaksi, - d[R] = berkurangnya reaktan (pereaksi), dan dt = perubahan waktu. Untuk reaksi : A → B, laju berkurangnya zat A ialah : 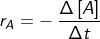
b. bertambahnya jumlah produk (konsentrasi produk) per satuan waktu, atau :  , dengan +Δ[P] = bertambahnya konsentrasi produk (hasil reaksi). Untuk reaksi : A → B, laju bertambahnya zat B ialah :
, dengan +Δ[P] = bertambahnya konsentrasi produk (hasil reaksi). Untuk reaksi : A → B, laju bertambahnya zat B ialah :  .
.
Bagaimana untuk reaksi yang lebih kompleks, semisal : pA + qB → rC.
Untuk reaksi demikian, maka :
Dalam perbandingan tersebut, tanda + atau – tidak perlu dituliskan sebab hanya memperlihatkan sifat perubahan konsentrasi. Oleh sebab harga dt masing-masing sama, maka perbandingan laju reaksi sesuai dengan perbandingan konsentrasi. Di sisi lain, konsentrasi berbanding lurus dengan mol serta berbanding lurus pula dengan koefisien reaksi, sehingga perbandingan laju reaksi sesuai dengan perbandingan koefisien reaksi. Perbandingan tersebut sanggup dituliskan sebagai berikut.
rA : rB : rC = p : q : r
Perhatikan teladan soal berikut.
Contoh Soal Laju Reaksi (3) :
Pada reaksi pembentukan gas SO3 menurut reaksi: 2SO2(g) + O2(g) → 2SO3(g), sehingga diperoleh data sebagai berikut.
No. | [SO3] mol/L | Waktu (s) |
1 | 0,00 | 0 |
2 | 0,25 | 20 |
3 | 0,50 | 40 |
Tentukanlah:
a. Laju bertambahnya SO3
b. Laju berkurangnya SO2
c. Laju berkurangnya O2
Penyelesaian :
Diketahui :
Persamaan reaksi : 2SO2(g) + O2(g) → 2SO3(g)
Data konsentrasi (pada tabel).
Ditanyakan :
a. r SO3.
b. r SO2.
c. r O2.
Jawaban :
a. Δ[SO3] = [SO3]3 – [SO3]2 = 0,50 – 0,25 = 0,25 M
Δt = t3 – t2 = 40 – 20 = 20 s
r SO3 =  =
=  = 0,0125 M/s
= 0,0125 M/s
Jadi, laju bertambahnya SO3 sebesar 1,25 x 10–2 M/s.
b. Karena koefisien SO2 = koefisien SO3, maka:
r SO2 = – r SO3 = – 0,0125 M/s
Jadi, laju berkurangnya SO2 sebesar –1,25 x 10–2 M/s
c. r O2 = - ½ x r SO3 = - ½ x 0,0125 = - 0,00625 M/s
Jadi, laju berkurangnya O2 sebesar – 6,25 x 10–3 M/s
Setelah kalian mempelajari apa itu laju reaksi dan bagaimana memilih besarnya laju reaksi zat dalam persamaan reaksi, maka sanggup kalian simpulkan bagaimana cepat lambatnya suatu reaksi kimia berdasarkan laju reaksi zat tersebut. Jika laju reaksi zat itu besar, maka reaksi berlangsung cepat, dan sebaliknya, kalau laju reaksi zat kecil, maka reaksi berlangsung lambat. Nah, tolong-menolong apa yang mempengaruhi cepat lambatnya laju reaksi kimia? Berikut ini akan kalian pelajari faktor-faktor yang mempengaruhi laju reaksi, termasuk di dalamnya teori tumbukan.
B. Faktor-faktor yang Mempengaruhi Laju Reaksi
Laju reaksi suatu reaksi kimia dipengaruhi oleh beberapa faktor, yaitu konsentrasi pereaksi, luas permukaan zat yang bereaksi, suhu pada ketika reaksi kimia terjadi, dan ada tidaknya katalis. Sehubungan dengan proses reaksi kimia, maka ada satu hal penting yang harus dipelajari untuk memilih berjalan tidaknya sebuah reaksi kimia, yakni tumbukan. Suatu reaksi kimia sanggup terjadi bila ada tumbukan antara molekul zat-zat yang bereaksi. Apakah setiap tumbukan niscaya menyebabkan berlangsungnya reaksi kimia? Akan kita ketahui jawabannya dengan mempelajari teori tumbukan dahulu sebelum melangkah pada pembahasan faktor-faktor yang mempengaruhi laju reaksi.
 |
| Gambar 4. Konsentrasi reaktan sangat kuat pada laju reaksi seng dengan asam sulfat. Laju reaksi lambat dalam larutan berkonsentrasi rendah (kiri) dan cepat dalam larutan berkonsentrasi tinggi. |
2.1. Tumbukan sebagai Syarat Berlangsungnya Reaksi Kimia
Tumbukan yang menghasilkan reaksi hanyalah tumbukan yang efektif. Tumbukan efektif harus memenuhi dua syarat, yaitu posisinya sempurna dan energinya cukup. Bagaimanakah posisi tumbukan yang efektif? Dalam wadahnya, molekul-molekul pereaksi selalu bergerak ke segala arah dan sangat mungkin bertumbukan satu sama lain. Baik dengan molekul yang sama maupun dengan molekul berbeda. Tumbukan tersebut sanggup tetapkan ikatan dalam molekul pereaksi dan kemudian membentuk ikatan gres yang menghasilkan molekul hasil reaksi. Contoh tumbukan antarmolekul yang sama terjadi pada pereaksi hidrogen iodida berikut.
HI(g) + HI(g) → H2(g) + I2(g)
Secara umum, dituliskan:
AB + AB → A2 + B2
Tumbukan yang efektif terjadi bila keadaan molekul sedemikian rupa sehingga antara A dan B saling bertabrakan (Gambar 5(a)). Jika yang bertabrakan ialah atom yang sama, yaitu antara A dan A (Gambar 5(b)) atau atom A dan B namun hanya bersenggolan saja (Gambar 5(c)), maka tumbukan tersebut merupakan tumbukan yang tidak efektif.
 |
| Gambar 5. (a) tumbukan yang efektif sebab posisi tumbukan tepat, (b) tumbukan tidak efektif sebab molekul yang bertabrakan sama (c) tumbukan tidak efektif sebab posisinya tidak tepat. |
Selanjutnya apa yang dimaksud energi tumbukan harus cukup? Jika kalian melemparkan kerikil pada beling dan kacanya tidak pecah, berarti energi kinetik kerikil tidak cukup untuk memecahkan kaca. Demikian juga tumbukan antarmolekul pereaksi, meskipun sudah terjadi tumbukan dengan posisi tepat, namun apabila energinya kurang, maka reaksi tidak akan terjadi. Dalam hal ini dibutuhkan energi minimum tertentu yang harus dipunyai molekul-molekul pereaksi untuk sanggup menghasilkan reaksi.
Energi tersebut dinamakan energi aktivasi atau energi pengaktifan (Ea).
Perhatikan Gambar 6. ihwal tumbukan dengan energi yang cukup dan tidak cukup.
 |
| Gambar 6. (a) energi cukup menghasilkan reaksi dan (b) energi tidak cukup tidak menghasilkan reaksi. |
Bila gerakan molekul AB dan C lambat, maka tidak akan terjadi ikatan antara B dan C ketika bertumbukan. Akibatnya, keduanya terpental tanpa ada perubahan (Gambar 6(a)). Dengan mempercepat gerakan molekul, maka akan menciptakan tumpang tindih B dan C serta menciptakan ikatan, dan akibatnya terjadi ikatan kimia (Gambar 6(b)).
Dalam suatu reaksi terdapat tiga keadaan yaitu keadaan awal (pereaksi), keadaan transisi, dan keadaan selesai (hasil reaksi). Keadaan transisi disebut juga komplek teraktivasi. Pada keadaan ini ikatan gres sudah terbentuk namun ikatan usang belum putus. Keadaan tersebut hanya berlangsung sesaat dan tidak stabil. Keadaan transisi ini selalu mempunyai energi lebih tinggi daripada keadaan awal dan akhir, sedangkan energi keadaan awal sanggup lebih tinggi atau lebih rendah daripada energi keadaan akhir.
Bila keadaan awal lebih tinggi energinya, reaksi mcnghasilkan kalor atau dinamakan reaksi eksoterm, dan bila yang terjadi ialah sebaliknya, dinamakan reaksi endoterm. Perhatikan Gambar 7. yang menggambarkan ihwal energi aktivasi pada reaksi eksoterm dan reaksi endoterm.
 |
| Gambar 7. (a) Diagram potensial reaksi eksoterm dan, (b) Diagram potensial reaksi endoterm. |
Dengan mengetahui teori tumbukan ini, kalian akan lebih gampang memahami klarifikasi ihwal faktor-faktor yang memengaruhi laju reaksi. Percepatan gerakan molekul akan memperbesar kemungkinan tumbukan efektif sebab percepatan gerakan menawarkan energi lebih besar. Percepatan gerakan molekul berarti percepatan laju reaksi. Dengan dipercepatnya laju reaksi memakai salah satu faktor-faktor berikut, diharapkan energi yang dibutuhkan untuk tumbukan sanggup tercukupi sehingga sanggup menghasilkan tumbukan yang efektif. Faktor-faktor tersebut akan segera diuraikan dalam klarifikasi berikut ini.
2.2. Pengaruh Konsentrasi terhadap Laju Reaksi
Jika konsentrasi suatu larutan makin besar, larutan akan mengandung jumlah partikel semakin banyak sehingga partikel-partikel tersebut akan tersusun lebih rapat dibandingkan larutan yang konsentrasinya lebih rendah. Susunan partikel yang lebih rapat memungkinkan terjadinya tumbukan semakin banyak dan kemungkinan terjadi reaksi lebih besar. Makin besar konsentrasi zat, makin cepat laju reaksinya. Perhatikan Gambar 8. ihwal imbas konsentrasi berikut.
 |
| Gambar 8. (a) tumbukan yang terjadi pada konsentrasi kecil, (b) tumbukan yang terjadi pada konsentrasi besar. |
Apabila dibentuk sebuah grafik yang memperlihatkan kekerabatan antara konsentrasi dengan laju reaksi, maka dihasilkan grafik ibarat pada Gambar 9. Grafik memperlihatkan bahwa semakin besar konsentrasi, semakin cepat pula laju reaksinya.
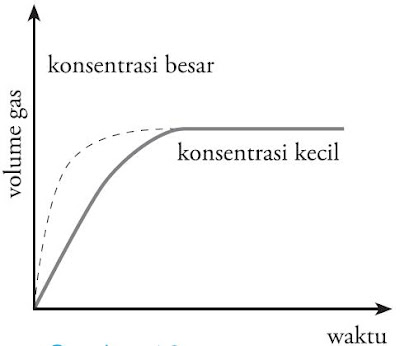 |
| Gambar 9. Grafik imbas konsentrasi terhadap laju reaksi. |
2.3. Pengaruh Luas Permukaan terhadap Laju Reaksi
Pada ketika zat-zat pereaksi bercampur, maka akan terjadi tumbukan antar partikel pereaksi di permukaan zat. Laju reaksi sanggup diperbesar dengan memperluas permukaan bidang sentuh zat yang dilakukan dengan cara memperkecil ukuran zat pereaksi. Perhatikan Gambar 10.
 |
| Gambar 10. Tumbukan antar partikel pada (a) permukaan kecil dan (b) permukaan besar. |
Semakin luas permukaan bidang sentuh zat, semakin besar laju reaksinya, ibarat yang ditunjukkan oleh grafik kekerabatan luas permukaan dengan laju reaksi pada Gambar 11.
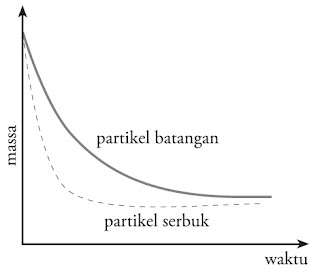 |
| Gambar 11. Grafik imbas luas permukaan terhadap laju reaksi. |
2.4. Pengaruh Suhu terhadap Laju Reaksi
Partikel-partikel dalam zat selalu bergerak. Jika suhu zat dinaikkan, maka energi kinetik partikel-partikel akan bertambah sehingga tumbukan antar partikel akan mempunyai energi yang cukup untuk melampaui energi pengaktifan. Hal ini akan menyebabkan lebih banyak terjadi tumbukan yang efektif dan menghasilkan reaksi (Gambar 12).
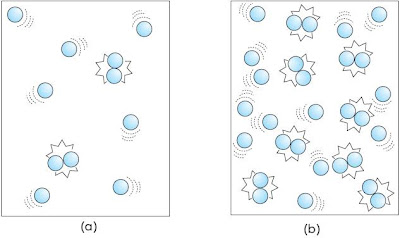 |
| Gambar 12. (a) tumbukan antarpartikel pada suhu rendah, (b) tumbukan antarpartikel pada suhu tinggi. |
Pada umumnya, setiap kenaikan suhu sebesar 10 oC, reaksi akan berlangsung dua kali lebih cepat. Dengan demikian, apabila laju reaksi awalnya diketahui, kita sanggup memperkirakan besarnya laju reaksi berdasarkan kenaikan suhunya. Lebih mudahnya, lihat perumusan berikut.
Karena besarnya laju berbanding terbalik dengan waktu yang ditempuh, maka perumusan di atas sanggup dituliskan sebagai berikut.
Keterangan :
∆r = kenaikan laju reaksi
∆T = kenaikan suhu = T2 –T1
T2 = suhu akhir
T1 = suhu awal
t0 = waktu reaksi awal
tt = waktu reaksi akhir
Agar lebih memahami perumusan di atas, perhatikanlah teladan soal berikut.
Contoh Soal Pengaruh Suhu terhadap Laju Reaksi (4) :
Suatu reaksi berlangsung dua kali lebih cepat setiap suhu dinaikkan 10 oC . Apabila pada suhu 25 oC laju reaksi suatu reaksi ialah 2y M/s. Berapa laju reaksi pada suhu 75 oC?
Penyelesaian :
Diketahui :
r0 = 2y
∆r = 2
T1 = 25 °C
T2 = 75 °C
Ditanyakan:
rt = .... ?
Jawab:
= (2)50/10 x 2y
= 25 x 2y = 32 . 2y
= 64y
Jadi, laju reaksinya ialah 64y.
Untuk lebih mudahnya, sanggup kita buat dalam bentuk tabel.
Suhu (°C) | 25 | 35 | 45 | 55 | 65 | 75 |
Laju reaksi (M/s) | 2y | 4y | 8y | 16y | 32y | 64y |
Jadi, laju reaksinya sama, yaitu 64y.
Apabila imbas suhu terhadap laju reaksi ini dibentuk grafik, akan tampak ibarat pada Gambar 13. Dari grafik tersebut sanggup disimpulkan bahwa makin tinggi suhu, laju reaksi semakin besar.
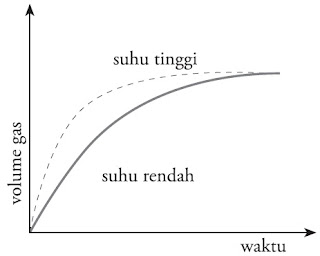 |
| Gambar 13. Grafik perubahan suhu terhadap laju reaksi. |
2.5. Pengaruh Katalis terhadap Laju Reaksi
Reaksi yang berlangsung lambat sanggup dipercepat dengan memberi zat lain tanpa menambah konsentrasi atau suhu reaksi. Zat tersebut disebut katalis. Katalis sanggup mempercepat laju reaksi, tetapi tidak mengalami perubahan kimia secara permanen sehingga pada selesai reaksi zat tersebut sanggup diperoleh kembali.
Fungsi katalis dalam reaksi ialah menurunkan energi aktivasi sehingga jumlah molekul yang sanggup melampaui energi aktivasi menjadi lebih besar. Gambar 14 memperlihatkan peranan katalis dalam menurunkan energi aktivasi.
 |
| Gambar 14. Diagram energi potensial reaksi tanpa katalis dan dengan katalis. Energi aktivasi reaksi dengan katalis (EaK) lebih kecil dari reaksi tanpa katalis. |
Katalis mempunyai beberapa sifat, di antaranya:
- Katalis tidak bereaksi secara permanen.
- Jumlah katalis yang dibutuhkan dalam reaksi sangat sedikit.
- Katalis tidak mempengaruhi hasil reaksi.
- Katalis tidak memulai suatu reaksi, tetapi hanya mempengaruhi lajunya.
- Katalis hanya bekerja efektif pada suhu optimum, artinya di atas atau di bawah suhu tersebut kerja katalis berkurang.
- Suatu katalis hanya mempengaruhi laju reaksi secara spesifik, artinya suatu katalis hanya mempengaruhi laju satu jenis reaksi dan tidak sanggup untuk reaksi yang lain.
- Keaktifan katalis sanggup diperbesar oleh zat lain yang disebut promotor.
- Hasil suatu reaksi sanggup bertindak sebagai katalis, sehingga zat tersebut disebut autokatalis.
- Katalis dalam senyawa organik disebut enzim.
- Terdapat katalis yang sanggup memperlambat suatu reaksi, sehingga katalis itu disebut katalis negatif atau inhibitor.
 |
| Gambar 15. Dekomposisi H2O2 dengan katalis MnO2 menjadi air dan oksigen. |
Berdasarkan wujudnya, katalis sanggup dibedakan dalam dua golongan, yaitu:
1. Katalis homogen ialah katalis yang mempunyai wujud sama dengan pereaksi. Katalis ini sanggup berada dalam dua wujud:
a. dalam wujud gas, contoh:
NO(g) | ||
2CO(g) + O2(g) | → | 2CO2(g) |
b. dalam wujud larutan, contoh:
H+ | ||
C12H22O11(aq) + H2O(l) | → | C6H12O6(aq) + C6H12O6(aq) |
2. Katalis heterogen adalah katalis yang mempunyai wujud berbeda dengan pereaksi. Biasanya katalis ini berwujud padat dan pereaksinya cair atau gas. Contohnya:
Fe(s) | ||
N2(g) + 3H2(g) | → | 2NH3(g) |
Ni(s) | ||
C2H4(g) + H2(g) | → | C6H6(g) |
Beberapa faktor yang memengaruhi laju reaksi telah usai kalian pelajari.
Untuk menganalisis lebih dalam kecenderungan peranan masingmaing faktor, lakukanlah kegiatan berikut.
Praktikum Kimia Menganalisis Faktor-Faktor yang Mempengaruhi Laju Reaksi (1) :
A. Dasar Teori
Suatu reaksi kimia berlangsung apabila terjadi tumbukan yang efektif antar partikel pereaksi. Cepat lambatnya suatu reaksi kimia dinyatakan dengan laju reaksi. Kecepatan laju reaksi ini sanggup dikendalikan sebab ada beberapa faktor yang memengaruhinya, yaitu konsentrasi pereaksi, luas permukaan partikel dari pereaksi, suhu ketika reaksi, dan keberadaan katalis.
Konsentrasi pereaksi sebanding dengan laju reaksi. Artinya, semakin besar konsentrasi pereaksi, maka laju reaksi akan semakin cepat. Begitu pula dengan luas permukaan dari partikel-partikel pereaksi. Semakin luas permukaan partikelnya, maka semakin cepat laju reaksinya. Mengenai suhu ketika reaksi juga sebanding dengan laju reaksi. Jadi, semakin tinggi suhu reaksi, maka laju reaksinya semakin cepat. Adapun keberadaan katalis akan mempercepat laju reaksi tanpa bereaksinya katalis tersebut.
Sumber : Syukri S, 1999, hlm. 472, 495, 502 (dengan pengembangan)
B. Tujuan Percobaan
- Mengetahui imbas konsentrasi pada laju reaksi.
- Mengetahui imbas luas permukaan pada laju reaksi.
- Mengetahui imbas suhu pada laju reaksi.
- Mengetahui imbas katalis pada laju reaksi penguraian H2O2 .
C. Alat dan Bahan Percobaan
Alat :
- tabung reaksi
- stop watch
- gelas kimia
- alat pemanas
- termometer
- gelas ukur
- kertas kosong yang diberi tanda silang (X)
Bahan :
- pita magnesium
- batu pualam, CaCO3 (bongkahan dan serbuk)
- larutan HCI 1M, 2M, 3M
- larutan Na2S2O3 0,1M
- larutan hydrogen peroksida (H2O2) 5%
- larutan besi (III) klorida (FeCI3) 0,1M
- larutan natrium klorida (Nod) 0,1M
D. Langkah Percobaan
1. Mengetahui imbas konsentrasi pada laju reaksi
a. Isilah 3 buah tabung reaksi masing-masing dengan 10 mL HCI 1 M, 10 mL HCI 2 M, dan 10 mL HCI 3 M.
b. Masukkan 1 cm pita magnesium ke tabung 1 dan catat waktunya mulai dari pita Mg dimasukkan hingga pita Mg habis bereaksi.
c. Ulangi langkah b untuk tabung 2 dan 3.
2. Mengetahui imbas luas permukaan terhadap laju reaksi
a. Isilah 2 tabung reaksi masing-masing dengan 10 mL HCI 2 M.
b. Masukkan 1 g serbuk CaCO3 ke dalam tabung dan catat waktunya mulai CaCO3 dimasukkan sampai CaCO3 habis bereaksi dengan HCI.
c. Masukkan 1 g bongkahan CaCO3 ke dalam tabung dan catat waktunya mulai dari CaCO3 dimasukkan sampai CaCO3 habis bereaksi dengan HCI.
3. Pengaruh suhu terhadap laju reaksi
a. Isilah 4 gelas kimia masing-masing dengan 20 mL larutan Na2S2O3 . Ukurlah suhunya masing-masing.
b. Letakkan gelas 1 di atas kertas bertanda silang. Masukkan 10 mL HCl 1 M dalam gelas kimia. Catat waktu ketika HCl dimasukkan dalam gelas kimia hingga tanda silang pada kertas tidak kelihatan dari atas gelas.
c. Panaskan gelas 2, 3, dan 4 di atas pemanas hingga suhu larutan naik 10 oC (gelas 2), 20 oC (untuk gelas 3), dan 30 oC (untuk gelas 4). Turunkan gelas dari pemanas dan letakkan di atas kertas bertanda silang. Segera masukkan 10 mL HCl 1M ke dalam gelas dan catat waktu mulai dari HCl dimasukkan hingga tanda silang pada kertas tidak kelihatan dari atas gelas.
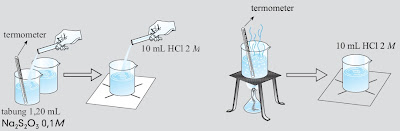 |
| Gambar 16.Langkah kerja untuk menganalisis faktor suhu yang mempengaruhi laju reaksi. |
4. Pengaruh katalis terhadap laju reaksi H2O2
a. Isilah 3 buah gelas kimia masing-masing dengan 50 mL H2O2
b. Gelas 1 dibiarkan saja.
c. Pada gelas 2, tambahkan 20 tetes NaCl.
d. Pada gelas 3, tambahkan 20 tetes FeCI3.
e. Amati reaksi yang terjadi pada setiap gelas dan catat hasilnya.
Tabel 1. Pengaruh Katalis terhadap Laju Reaksi
Tabung reaksi | Pita Mg | Konsentrasi HCl | Waktu (s) |
1 | 1 cm | 1 M | |
2 | 1 cm | 2 M | |
3 | 1 cm | 3 M |
Tabel 2. Pengaruh Luas Permukaan terhadap Laju Reaksi
Tabung | CaCO3 1 gram | Konsentrasi HCl | Waktu (s) |
1 | serbuk | 2 M | |
2 | bongkahan | 2 M |
Tabel 3. Pengaruh Suhu terhadap Laju Reaksi
Gelas Kimia | Suhu ( C) | V HCl 2 M | V Na2S2O3 0,1 M | Waktu (s) |
1 | x = | 10 mL | 20 mL | |
2 | x + 10 = | 10 mL | 20 mL | |
3 | x + 20 = | 10 mL | 20 mL | |
4 | x + 30 = | 10 mL | 20 mL |
Tabel 4. Pengaruh Katalis terhadap Laju Reaksi
Gelas Kimia | Larutan | Pengamatan |
1 | H2O2 | |
2 | H2O2 + NaCI | |
3 | H2O2 + FeCI, |
F. Pembahasan
Buatlah pembahasan ihwal hasil percobaan dengan menjawab beberapa pertanyaan berikut.
1. Mengetahui imbas konsentrasipada laju reaksi.
a. Reaksi pada tabung mana yang paling cepat?
b. Reaksi pada tabung mana yang paling lambat?
c. Mengapa kecepatan reaksi keduanya berbeda?
d. Tentukanlah variabel bebas dan variabel kontrolnya.
e. Buatlah grafik fungsi konsentrasi vs waktu dari hasil percobaan kalian.
2. Mengetahui imbas luas permukaan pada laju reaksi.
a. Reaksi pada tabung manakah yang lebih cepat selesai?
b. Faktor apakah yang mempengaruhi cepat lambatnya reaksi-reaksi tersebut?
c. Tentukanlah variabel bebas dan variabel kontrolnya.
d. Buatlah grafik fungsi antara bentuk partikel zat vs waktu dari hasil percobaan kalian.
3. Mengetahui imbas suhu pada laju reaksi.
a. Reaksi pada gelas manakah yang lebih cepat menghasilkan endapan belerang? (ditandai dengan larutan yang keruh dan tanda silang tidak kelihatan)
b. Faktor apa yang mempengaruhi cepat lambatnya reaksi?
c. Tentukanlah variabel bebas dan variabel kontrolnya.
d. Buatlah grafik fungsi suhu Vs waktu dari hasil percobaan.
e. Berapa kalikah laju reaksi pada tabung 2 dibandingkan dengan tabung 1?
4. Mengetahui imbas katalis pada laju reaksi.
a. Apa yang terjadi pada gelas kimia 1, 2, dan 3?
b. Apa yang berperan sebagai katalis?
G. Kesimpulan
Buatlah kesimpulan ihwal faktor-faktor yang mempengaruhi laju reaksi dan kecenderungan imbas faktor-faktor tersebut terhadap laju reaksi.
C. Persamaan Laju Reaksi dan Orde Reaksi
Laju reaksi dalam suatu reaksi sangat bergantung pada konsentrasi pereaksi. Besarnya laju reaksi akan berkurang sebab konsentrasi pereaksi makin kecil. Hubungan antara konsentrasi pereaksi dan laju reaksi tersebut dinyatakan dalam persamaan reaksi. Bagaimana kita menuliskan persamaan laju reaksi? Pelajari persamaan laju reaksi dan orde reaksi berikut.
3.1. Persamaan Laju Reaksi
Persamaan laju reaksi hanya dipengaruhi oleh konsentrasi pereaksi. Untuk reaksi secara umum:
pA + qB → rC + sD
maka laju reaksinya ditulis :
r = k [A]m [B]n
Dalam rumusan tersebut, r merupakan laju reaksi dengan satuan mol/Ls atau M/s, k ialah konstanta laju reaksi, lambang [A] dan [B] merupakan konsentrasi molar zat A dan B, sedangkan pangkat m dan n merupakan angka-angka bilangan lingkaran ( 0, 1, 2,...) dan disebut sebagai orde reaksi atau tingkat reaksi. m merupakan orde reaksi terhadap A, n orde reaksi terhadap B, dan m + n merupakan orde reaksi total. Besarnya m dan n tersebut tidak berafiliasi dengan koefisien reaksi. Jika ternyata besarnya sama, maka itu suatu kebetulan saja sebab orde reaksi hanya sanggup ditentukan dan data percobaan.
Contoh beberapa persamaan reaksi dan cara menuliskan persamaan laju reaksinya serta tingkat reaksinya sanggup dilihat pada Tabel 1.
3.2. Penentuan Orde Reaksi
Pada Tabel 1. terlihat bahwa tingkat (orde) reaksi tidak berafiliasi dengan koefisien pereaksi. Adapun langkah-langkah dalam penulisan persamaan laju reaksi dan pencntuan orde reaksinya ialah sebagai berikut.
Langkah pertama, menuliskan persamaan laju reaksi secara umum, diubahsuaikan dengan jumlah pereaksinya.
Jika pereaksinya tunggal : A → hasil, maka, v = k[A]m
Jika pereaksinya dua : A + B → hasil, maka, v = k[A]m [B]n
Jika pereaksinya tiga : A + B + C→ hasil, maka, v = k [A]m[B]n[C]°
 |
| Gambar 17.Grafik Reaksi Orde 0 (Nol). |
Langkah kedua, memilih m, n, dan o dari data percobaan. Untuk memilih orde reaksi, perhatikanlah teladan berikut.
Contoh Soal Orde Reaksi (5) :
Dalam ruang tertutup, direaksikan gas SO2 dan gas H2 dengan persamaan reaksi berikut.
SO2(g) + 2 H2(g) → S(s) + 2 H2O(g)
Berikut ialah data yang diperoleh dari percobaan.
Percobaan | [SO2] M | [H2] M | r (M/s) |
1 | 0,03 | 0,12 | 1 x 10–2 |
2 | 0,06 | 0,12 | 2 x 10–2 |
3 | 0,06 | 0,24 | 8 x 10–2 |
Tentukanlah:
a. Persamaan laju reaksinya
b. Konstanta laju reaksinya
Jawaban :
Penulisan persamaan laju reaksinya: r = k[SO2]m [H2]n
Untuk memilih m dan n sanggup dilakukan beberapa cara, yaitu:
Cara 1 :
a. Menentukan orde reaksi terhadap SO2 atau m. Kita ambil data pada konsentrasi H2 yang konstan, yaitu data 1 dan 2.
Percobaan | [SO2] M | v (M/s) |
1 | 0,03 | 1 x 10–2 |
2 | 0,06 | 2 x 10–2 |
Pada data tersebut, kalau [SO2] dinaikkan 2 kali ternyata laju reaksi juga naik 2 kali. Kaprikornus laju reaksi berbanding lurus dengan konsentrasi A, ditulis r = k [A]. Konsentrasi A berpangkat satu atau orde reaksi terhadap A ialah 1. Jika dibentuk grafik fungsi laju reaksi terhadap [A], maka grafiknya berupa garis lurus, ibarat terlihat pada Gambar 18.
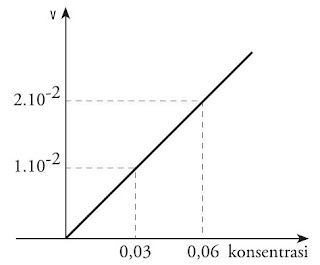 |
| Gambar 18. Grafik Reaksi Orde 1. |
b. Menentukan orde reaksi terhadap H2 atau n. Kita ambil data pada konsentrasi SO2 yang konstan, yaitu data 2 dan 3.
Percobaan | [H2] M | v (M/s) |
2 | 0,12 | 2 x 10–2 |
3 | 0,24 | 8 x 10–2 |
Dari data tersebut, kalau [H2] dinaikkan 2 kali ternyata laju reaksinya naik 4 kali. Jadi, laju reaksi berbanding lurus dengan konsentrasi H2 pangkat 2, ditulis r = k [H2]2. Grafik fungsi laju reaksi terhadap [B] berupa parabola, ibarat tampak pada Gambar 19.
 |
| Gambar 19.Grafik Reaksi Orde 2. |
c. Selanjutnya, persamaan laju reaksi secara keseluruhan dituliskan: r = k [A] [B]2. Orde reaksi totalnya ialah m + n yaitu 1 + 2 = 3.
Cara 2 :
Cara yang kedua ini dilakukan dengan membandingkan persamaan reaksi pada data satu dengan data lainnya. Berikut penyelesaiannya.
a. Menentukan orde reaksi terhadap SO2 pada data [H2] yang konstan, yaitu data 2 dan 1.
Jadi, orde reaksi terhadap SO2 adalah 1.
b. Menentukan orde reaksi terhadap H2 pada data [SO2] yang konstan, yaitu data 3 dan 2.
Jadi, orde reaksi terhadap hidrogen ialah 2.
c. Persamaan laju reaksinya ialah r = k [SO2] [H2]2
Untuk memilih harga k sanggup dipakai salah satu data, kemudian dimasukkan dalam persamaan laju reaksi yang sudah dituliskan tersebut. Misalnya kita ambil data 1.
r1 = k [SO2] [H2]2
1 x 10–2 M/s = k (0,03 M) (0,12 M)2
1 x 10–2 M/s = 4,32 x l0–4 k M–3
k = 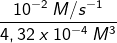
k = 23,15 M-2/s
Jadi, konstanta laju reaksinya ialah 23,15 M-2/s.
D. Penerapan Laju Reaksi
Kalian pernah melarutkan gula dalam air bukan? Mungkin sewaktu kalian menciptakan teh manis, kopi, atau minuman lainnya. Bagaimana kira-kira larutnya gula dalam air kalau yang dilarutkan bongkahan gula kerikil atau serbuk? Tentulah lebih cepat larut yang dalam bentuk serbuk. Itulah imbas luas permukaan pada laju reaksi yang kita jumpai dalam kehidupan sehari-hari. Dalam bidang industri, reaksi-reaksi yang terjadi selalu diusahakan berlangsung lebih cepat. Faktor laju reaksi yang sering dipakai ialah katalis. Seperti yang telah kalian pelajari ihwal uraian katalis di depan, katalis merupakan zat yang mempercepat laju reaksi tetapi pada selesai reaksi didapatkan kembali ibarat semula. Contoh industri yang memakai katalis ialah pembuatan amonia (NH3) dan asam sulfat (H2SO4).
Amonia merupakan materi untuk menciptakan asam nitrat, pupuk, dan materi peledak. Proses pembuatan amonia dikenal dengan nama Proses Haber-Bosch sesuai dengan nama penemunya, yaitu Fritz Haber dan Karl Bosch. Reaksi pembuatan amonia dari gas nitrogen dan gas hidrogen sebagai berikut:
N2(g) + 3 H2(g) ↔ 2 NH3(g) ∆H= - 92kJ/mol
Ternyata reaksi tersebut sangat lambat pada suhu kamar, sehingga perlu dilakukan usaha-usaha untuk mempercepat laju reaksinya. Usaha itu harus dilakukan biar segera didapatkan hasil sebanyak-banyaknya dalam waktu sesingkat-singkatnya, sesuai prinsip ekonomi. Salah satu perjuangan yang dilakukan ialah dengan menambahkan katalis besi. Pada proses pembuatan asam sulfat yang sering dikenal dengan nama proses kontak, juga dibutuhkan katalis yaitu Vanadium pentoksida, V2O5.
Silakan tonton video mengenai Faktor-faktor yang mempengaruhi laju reaksi. Jika bermanfaat, berikan santunan dengan cara klik suka video ini di YouTube di http://goo.gl/OKlWZ. Klik suka yang anda berikan, akan menawarkan motivasi bagi pembuat video ini untuk terus berkarya.
Silakan tonton video mengenai Faktor-faktor yang mempengaruhi laju reaksi. Jika bermanfaat, berikan santunan dengan cara klik suka video ini di YouTube di http://goo.gl/OKlWZ. Klik suka yang anda berikan, akan menawarkan motivasi bagi pembuat video ini untuk terus berkarya.
Anda kini sudah mengetahui Laju Reaksi. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Premono, S. A. Wardani, dan N. Hidayati. 2009. Kimia : SMA/ MA Kelas XI. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 282.


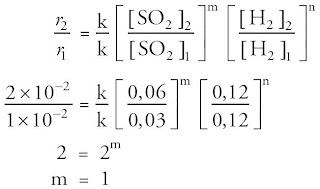
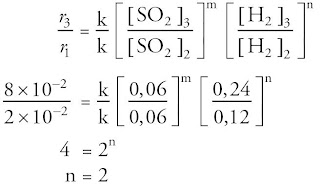
No comments:
Post a Comment