Jenis dan Metode Titrasi, Cara Melakukan yang Baik dan Benar, Praktikum, Menentukan Titik Awal Akhir Ekuivalen, Contoh Soal, Pembahasan, Stoikiometri, Kimia - Titrasi yaitu cara analisis yang memungkinkan kita untuk mengukur jumlah niscaya dari suatu larutan dengan mereaksikannya dengan larutan lain yang telah diketahui konsentrasinya. Setelah mempelajari materi stoikiometri larutan dan penentuan pereaksi pembatas, maka kita sanggup mempelajari titrasi dengan lebih mudah. Kalian telah mengetahui bukan bahwa reaksi antara asam dan basa akan membentuk garam dan air. Apabila HCl direaksikan dengan NaOH, maka akan terbentuk garam NaCl dan H2O. Reaksi ionisasinya sanggup dituliskan sebagai berikut.
H+(aq) + Cl-(aq) + Na+(aq) + OH-(aq) → Na+(aq) + Cl-(aq) + H2O(l)
NaCl akan mengalami ionisasi tepat sehingga tidak akan mengalami perubahan, dan dalam larutan berbentuk ion. Reaksi di atas juga sanggup disebut sebagai reaksi pembentukan air atau sering disebut sebagai reaksi netralisasi.
H+(aq) + OH-(aq) → H2O(l)
Reaksi netralisasi sanggup digunakan untuk memilih konsentrasi larutan asam atau basa, yaitu dengan menambahkan setetes demi setetes larutan asam ke dalam larutan basa atau sebaliknya. Setiap asam yang diteteskan akan bereaksi dengan basa, dan penetesan tidak boleh pada ketika jumlah mol H+ (ion H+ dari asam) setara dengan mol OH- (ion OH- dari basa). Pada ketika itu, larutan bersifat netral (sudah terbentuk air) dan disebut titik ekuivalen. Cara menyerupai ini disebut titrasi. Analisis ini juga disebut analisis volumetri alasannya yaitu yang diukur yaitu volume dari asam/basa yang terpakai dalam titrasi.
 |
| Gambar 1. Alat-alat titrasi. |
Tahu wacana pengertian titrasi saja tidak cukup. Bagaimana cara melaksanakan titrasi yang benar sangat penting untuk diketahui. Untuk itu simak baik-baik langkah-langkah titrasi berikut.
1. Cara Titrasi
Untuk lebih gampang berguru cara titrasi, coba kalian perhatikan langkah-langkah berikut ini.
Langkah 1 :
Larutan yang akan diteteskan dimasukkan ke dalam buret (pipa panjang berskala). Larutan dalam buret disebut penitrasi.
Langkah 2 :
Larutan yang akan dititrasi dimasukkan ke dalam erlenmeyer dengan mengukur volumenya terlebih dahulu menggunakan pipet gondok.
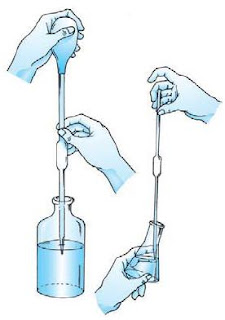 |
| Gambar 2. Mengukur volume larutan menggunakan pipet gondok. |
Langkah 3 :
Memberikan beberapa tetes indikator pada larutan yang dititrasi (dalam erlenmeyer) menggunakan pipet tetes. Indikator yang digunakan yaitu yang perubahan warnanya sekitar titik ekuivalen.
Langkah 4 :
Proses titrasi, yaitu larutan yang berada dalam buret diteteskan secara perlahan-lahan melalui kran ke dalam erlenmeyer. Erlenmeyer igoyang-goyang sehingga larutan penitrasi sanggup larut dengan larutan yang berada dalam erlenmeyer. Penambahan larutan penitrasi ke dalam erlenmeyer tidak boleh ketika sudah terjadi perubahan warna dalam erlenmeyer. Perubahan warna ini mengambarkan telah tercapainya titik simpulan titrasi (titik ekuivalen).
Langkah 5 :
Mencatat volume yang dibutuhkan larutan penitrasi de ngan melihat volume yang berkurang pada buret sehabis dilakukan proses titrasi.
 |
| Gambar 3. Langkah-langkah melaksanakan titrasi. |
2. Cara Menentukan Titik Akhir Titrasi
Kurva titrasi sanggup dibentuk dengan menghitung pH larutan asam/basa pada beberapa titik berikut.
1. Titik awal sebelum penambahan asam/basa.
2. Titik-titik sehabis ditambah asam/basa sehingga larutan mengandung garam yang terbentuk dan asam/basa yang berlebih.
3. Titik ekivalen, yaitu ketika larutan hanya mengandung garam, tanpa ada kelebihan asam atau basa. Pada ketika ini, berlaku rumus berikut:
N1 x V1 = N2 x V2
Keterangan :
N1 = normalitas larutan yang dititrasi (titran)
V1 = volume titran
N2 = normalitas larutan yang menitrasi (penitran)
V2 = volume penitran
N = n x M (dengan n = valensi asam/basa dan M molaritas larutan)
4. Daerah lewat ekivalen, yaitu larutan yang mengandung garam dan kelebihan asam/basa.
Untuk memperjelas uraian di atas, simaklah pola soal titrasi asam berpengaruh dengan basa berpengaruh di bawah ini.
Contoh Soal (1) :
Untuk menetralkan 50 mL larutan HCl diharapkan 20 mL larutan 0.25 M NaOH. Tentukan kemolaran larutan HCl.
Jawaban :
NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l)
mol HCl = 20 x 0,25 = 5 mmol
Berdasarkan koefisien reaksi di atas, maka :
mol HCl = mol NaOH = 5 mmol
M HCl = n/V = 5 m mol / 50mL = 0.1 M
Besarnya perubahan pH sanggup diamati dengan melihat kurva titrasi.
Bentuk kurva dari masing-masing titrasi berlainan tergantung pada kekuatan asam dan basa yang digunakan.
3. Jenis Titrasi
Berdasarkan kekuatan asam basanya, maka titrasi asam basa dibedakan menjadi 3, yaitu:
3. Jenis Titrasi
Berdasarkan kekuatan asam basanya, maka titrasi asam basa dibedakan menjadi 3, yaitu:
1. Titrasi asam berpengaruh dengan basa kuat
Contoh titrasi asam berpengaruh dengan basa berpengaruh yaitu titrasi 25 mL larutan HCl 0,1 M dengan NaOH 0,1M. Kurva titrasinya akan akan memperlihatkan bahwa di sekitar titik ekivalen terlihat garis kurva naik tajam,yang mengartikan bahwa pada kawasan tersebut, penambahan sedikit NaOH telah menimbulkan perubahan pH yang besar. Oleh alasannya yaitu itu, indikator dimasukkan pada larutan asam yang akan dititrasi bukan pada larutan basa
2. Titrasi asam lemah dengan basa kuat
Contoh titrasi asam lemah dengan basa berpengaruh yaitu titrasi 25 mL CH3COOH 0,1 M dengan larutan NaOH 0,1. Kurva titrasi memperlihatkan bahwa sehabis titik ekivalen, pH larutan cenderung naik
3. Titrasi basa lemah dengan asam kuat
Contoh titrasi antara basa lemah dengan asam berpengaruh yaitu titrasi 25 mL NH4OH dengan HCl 0,1M. Titrasi ini menyerupai dengan titrasi asam lemah dengan basa kuat, tetapi kurva yang terjadi kebalikannya, cenderung turun.
Titrasi dilakukan untuk larutan asam dan basa. Apa yang terjadi selama penambahan penitrasi ke dalam larutan asam ataupun basa? Kalian akan segera tahu sehabis membaca uraian berikut.
Jika kalian perhatikan ketika melaksanakan acara di atas, larutan yang berada di dalam erlenmeyer yaitu basa, sehingga pHnya > 7. Saat dititrasi dengan asam, tentu pH akan turun hingga terjadi titik ekivalen. Perubahan pH larutan secara visual sanggup dilihat dengan semakin samarnya warna pink dari larutan dalam erlenmeyer hingga akibatnya menjadi bening.
Besarnya perubahan pH sanggup diamati dengan melihat kurva titrasi. Bentuk kurva dari masing-masing titrasi berlainan tergantung pada kekuatan asam dan basa yang digunakan Kurva titrasi sanggup dibentuk dengan menghitung pH larutan asam/basa pada beberapa titik berikut.
- Titik awal sebelum penambahan asam/basa.
- Titik-titik sehabis ditambah asam/basa sehingga larutan mengandung garam yang terbentuk dan asam/basa yang berlebih.
- Titik ekuivalen, yaitu ketika larutan hanya mengandung garam, tanpa ada kelebihan asam atau basa.
- Daerah lewat ekuivalen, yaitu larutan yang mengandung garam dan kelebihan asam/basa.
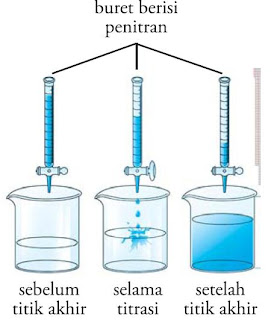 |
| Gambar 4. Penentuan titik simpulan titrasi. |
Kalian akan lebih paham ban terang dengan memperhatikan pola perhitungan dan Aktivitas berikut mi.
Contoh Soal (2) :
Untuk menetralkan 50 mL larutan HCI diharapkan 20 mL larutan 0.25 M NaOH. Tentukan kemolaran larutan HCI.
Penyelesaian :
NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l)
mol HCl = 20 x 0.25 = 5 mmol
Berdasarkan koefisien reaksi di atas, maka :
mol HCl = mol NaOH = 5 mmol
M HCl = n/V = 5 mmo1/50mL = 0,1 M
4. Percobaan / Praktikum Menentukan Konsentrasi Larutan NaOH
A. Dasar teori
Titrasi merupakan analisis yang digunakan untuk mengukur jumlah (konsentrasi) suatu larutan. Salah sat reaksi yang sering digunakan dalam titrasi yaitu netralisasi asam basa. Dalam pelaksanaan titrasi, indikator sangat diharapkan untuk mengetahui titik ekivalen. Indikator yaitu zat kimia yang warnanya tergantung keasaman dan kebasaannya. Indikator ada beberapa macam. Penggunaan indikator harus sesuai dengan tingkat keasaman larutan yang diukur konsentrasinya. Indikator akan memperlihatkan warna yang lain ketika berada dalam keadaan asam dan basa. Indikator yang biasa digunakan dalam laboratorium yaitu fenolftalein. Fenolftalein dalam kondisi asam tak berwarna, sedangkan dalam kondisi basa berwarna merah muda / pink. (Brady, 1999, hlm. 218)
B. Tujuan Percobaan
1. Menentukan konsentrasi larutan NaOH yang dititrasi dengan HCl.
2. Membuat grafik titrasi.
C. Alat dan Bahan Percobaan
Alat :
- erlenmeyer 250 mL
- pipet gondok 25 mL
- pipet tetes
- buret 25 mL
Bahan :
- Larutan NaOH 0,1 M
- Larutan HCl 0,1 M
- Indikator fenolftalein (PP)
D. Langkah Percobaan
- Masukkan larutan HCl 0,1 M ke dalam buret hingga angka nol.
- Ambil 25 mL NaOH kemudian masukkan ke dalam erlenmeyer.
- Berikan tiga tetes fenolftalein ke dalam erlenmeyer sehingga tampak berwarna pink.
- Menitrasi tetes demi tetes sambil erlenmeyer terus digoyang. Hentikan sementara titrasi ketika volume penitran (HCl 0,1 M) mencapai 5 mL dan kelipatannya (volume penitran ini sanggup dilihat dari skala buret). Ukur pH larutan titran dengan pH meter.
- Ketika warna larutan titran sudah mendekati bening, pengukuran pH dilakukan untuk setiap penambahan 1 mL penitran.
- Hentikan kembali titrasi ketika tercapai titik ekivalen, yaitu ketika larutan berwarna menjadi bening. Catat volume penitran.
- Pengukuran pH titran kembali dilakukan untuk setiap penambahan 1 mL penitran, hingga 3 kali pengukuran. Catat pH dan volume penitrannya.
- Pengukuran pH titran dilanjutkan untuk setiap penambahan 5 mL penitran, hingga 3 kali Bengukuran. Catat pH dan volume penitrannya
- Mengulangi langkah 1-8 sebanyak 3 kali, kemudian menghitung rata-rata volume HCl yang digunakan.
- Hitunglah konsentrasi NaOH yang dititrasi.
- Buatlah grafik titrasi volume HCl versus pH dari data percobaan.
E. Hasil Percobaan
Isilah tabel di bawah ini menurut hasil pengamatan kalian.
Volume penitran (mL) | pH titran |
0 | |
5 | |
10 | |
. . . | |
. . . |
F. Pembahasan
Untuk memperjelas dan lebih memahamkan kalian terhadap percobaan ini, jawablah pertanyaan berikut.
- Tuliskan reaksi yang terjadi antara HCl dengan NaOH.
- Tentukan jumlah mol HCl yang digunakan.
- Tentukan jumlah mol dan konsentrasi NaOH. (Gunakan perumusan yang telah diterangkan).
- Cermati grafik yang telah kalian buat, kemudian analisalah.
G. Kesimpulan
Apa kesimpulan yang sanggup kalian tarik dari percobaan ini?
Diskusikan dengan kelompok kalian dan tuliskan dalam laporan kegiatan, kemudian presentasikan hasilnya di depan kelas.
5. Percobaan / Praktikum Menentukan Kadar Cuka Perdagangan
A. Dasar teori
Titrasi merupakan analisis yang digunakan untuk mengukur jumlah (konsentrasi) suatu larutan. Salah satu reaksi yang sering digunakan dalam titrasi yaitu netralisasi asam basa. Dalam pelaksanaan titrasi, indikator sangat diharapkan untuk mengetahui titik ekuivalen. Asam asetat yang dalam bahasa dagangnya dikenal sebagai cuka, merupakan suatu asam lemah dengan rumus senyawa CH3COOH. Produk cuka dari suatu perusahaan yang satu dengan yang lain niscaya berbeda kadar asetatnya. Untuk mengetahuinya, maka cara yang gampang dilakukan yaitu dengan titrasi.
Berdasarkan reaksi netralisasi, analisis volumetrik dibedakan menjadi asidimetri dan alkalimetri. Keduanya dibedakan pada larutan standarnya. Salah satu pola analisis alkalimetri yaitu titrasi basa terhadap asam cuka (asam asetat). Reaksi antara natrium hidroksida dengan asam asetat akan menghasilkan garam yang berasal dari asam lemah dan basa kuat, sehingga titik ekivalen diperoleh pada pH > 7. Analisis asam asetat dalam cuka perdagangan bermanfaat untuk memperoleh informasi apakah kadar yang tertulis pada label botol sesuai dengan kenyataannya. (Brady, 1999, hlm. 218 (dengan pengembangan))
B. Tujuan Percobaan
Menentukan kadar asam cuka perdagangan.
C. Alat dan Bahan Percobaan
Alat :
- erlenmeyer 250 mL
- pipet
- pipet gondok 25 mL
- buret 25 mL
- labu ukur
- corong gelas
 |
| Gambar 5. Labu ukur dengan garis di tengah leher sebagai tanda batas. Ukuran labu bermacam-macam, dari 10, 25, 50, 100, 250, 500 hingga 1000 ml. |
Bahan :
- NaOH 0,1 M
- asam cuka perdagangan
- fenolftalein
- aquades
D. Langkah Percobaan
- Ambil 10 mL larutan asam cuka perdagangan dengan pipet gondok kemudian masukkan ke dalam labu ukur100 mL, encerkan hingga volume tanda batas.
- Ambil 10 mL larutan encer (dari labu ukur), kemudian maukkan ke dalam erlenmeyer 25 mL dan tambahkan 2 tetes indikator fenolftalein ke dalamnya.
- Lakukan titrasi dengan larutan standar NaOH 0,1M hingga terjadi perubahan warna menjadi merah muda (hati-hati dalam meneteskan, jangan hingga kelebihan sehingga warnanya menjadi merah tua).
- Catat volume NaOH yang dibutuhkan.
- Lakukan langkah 2-4 sebanyak 3 kali.
E. Hasil Percobaan
Isilah tabel di bawah ini menurut hasil pengamatan kalian.
Titrasi | Volume NaOH yang digunakan (mL) | Volume asam cuka encer yang diambil (mL) |
I | ||
II | ||
III | ||
Rerata |
F. Pembahasan
Untuk memperjelas percobaan ini, jawablah pertanyaan-pertanyaan berikut. (Cara mengerjakan sesuai dengan pola pada titrasi asam berpengaruh basa kuat).
1. Tuliskan reaksi yang terjadi antara asam cuka dengan NaOH.
2. Hitunglah kadar asam cuka perdagangan (dalam g/100mL).
Caranya, gunakan rumus berikut.
Kadar cuka (m garam) =  x 0,1 x V NaOH x 60
x 0,1 x V NaOH x 60
dengan:
V = volume rerata NaOH yang digunakan
60 = massa relatif (Mr) asam asetat
0,1 = konsentrasi NaOH = faktor pengenceran asam cuka 10 mL menjadi 100 mL
G. Kesimpulan
Apa kesimpulan dari percobaan ini?
Diskusikan dengan kelompok kalian dan tuliskan dalam laporan kegiatan. Jangan lupa menyertakan hasil acara kalian dalam menghitung kadar cuka yang sebenarnya, apakah sesuai dengan labelnya ataukah jauh dari nilai yang tertulis padanya.
Melalui percobaan pertama kita sanggup memilih konsentrasi suatu senyawa yang belum diketahui dengan metode titrasi.
Anda kini sudah mengetahui Jenis Titrasi dan Metode Titrasi. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Premono, S. A. Wardani, dan N. Hidayati. 2009. Kimia : SMA/ MA Kelas XI. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 282.
No comments:
Post a Comment